不同采收期广升麻产量及其蜕皮甾酮含量动态变化研究
吴佳 匡艳辉 刘湘丹
摘要:目的 研究不同采收期广升麻产量及其蜕皮甾酮的含量,为广升麻标准化栽培过程中采收期的确定提供依据。方法 于不同采收期采集广升麻植株,称重法测定其根质量;HPLC测定根中蜕皮甾酮含量,色谱柱为ZORBAX Eclipse XDB-C18(250 mm×4.6 mm,5 μm),流动相为甲醇-水(45︰55,V/V),流速1.0 mL/min,检测波长248 nm,柱温30 ℃,进样量10 μL。结果 不同采收期广升麻植株根质量和根中蜕皮甾酮含量均呈动态变化。根质量在10月下旬达到最大值,之后基本稳定;蜕皮甾酮含量于11月上旬达到最高,其后稍有下降。结论 综合根产量、蜕皮甾酮含量和广升麻植株物候期,确定广升麻根的最佳采收期为11月上、中旬。
关键词:广升麻;采收期;根;蜕皮甾酮
中图分类号:R284.1 文献标识码:A 文章编号:1005-5304(2019)10-0081-04
DOI:10.3969/j.issn.1005-5304.2019.10.018 开放科学(资源服务)标识码(OSID):
Abstract: Objective To study the dynamic change of the yield and ecdysterone of Serratulae Chinensis Radix in different harvest time; To provide scientific basis for determination of harvesting time in its standardized cultivation. Methods The weight of the root of Serratula chinensis at different harvest time was measured by weighing method. The content of ecdysterone in the sample was determined by HPLC. The column was ZORBAX Eclipse XDB-C18 (250 mm × 4.6 mm, 5 μm) and the methanol-water (45:55, V/V) was mobile phase. The velocity of flow was 1.0 mL/min and the detection wavelength was 248 nm with column temperature of 30 ℃. The injection volume was 10 μL. Results The root weight and ecdysterone content in different harvest time showed dynamic changes. The weight of root reached the maximum in late October, and then basically stabilized. The content of ecdysterone in root reached the maximum in early November, and then decreased slightly. Conclusion Integrating root yield, ecdysterone content and phenological phase of Serratula chinensis can determine that the best harvest time is the early and middle November.
Keywords: Serratulae Chinensis Radix; harvest time; root; ecdysterone
广升麻来源于菊科植物麻花头Serratula chinensis S. Moore的干燥块根,其味辛、苦,性寒,归胃、肺经,具有解毒透疹、升阳举陷功效,用于热毒咽肿、风热头痛、麻疹不透等[1]。广升麻主要分布于广东、湖南、江西、浙江、福建、广西等地,其中广东韶关、湖南郴州、江西赣州交界地为其道地产区,而产于湖南郴州桂东、汝城地区者习称汝升麻。研究表明,广升麻中主要化学成分为蜕皮甾酮类、挥发油、脑苷脂、神经酰胺类化合物等[2-7]。其中蜕皮甾酮是一种昆虫蜕皮活性的天然甾体化合物,能促进蛋白质的合成,具有抗脂质过氧化、抗内皮细胞损伤、调节基因表达、降低胆甾醇等作用[8-9]。广升麻根部入药有降低胆固醇和治疗脑血管疾病等作用,其治療脑缺氧、脑缺血效果尤为显著,药理研究表明该作用与蜕皮甾酮相关[10-11]。
随着心脑血管疾病发病率不断上升和年轻化,广升麻的市场需求也日趋增长,由于其野生资源减少,人工种植广升麻供不应求,探究广升麻最佳采收期使其资源利用最大化具有十分重要的研究意义。因此,本试验采用HPLC测定2016年9月中旬-12月中旬采收的广升麻样品中蜕皮甾酮的含量,结合广升麻物候期和根产量,以探究广升麻的最佳采收期,为充分合理地利用广升麻资源提供依据。
1 仪器与试药
1260Agilent型HPLC仪(包括G14212A型紫外检测器、G4220A型二元泵、G1316C型色谱工作站和手动进样器),美国Agilent公司;KQ-500DE数控超声波清洗器(功率500 W,频率40 kHz),昆山市超声仪器有限公司;DK-98-1数显电热水浴锅,天津市泰斯特仪器有限公司;LK-600A摇摆式高速万能粉碎机,上海精胜科学仪器有限公司;BT214D万分之一电子天平、CP225D十万分之一电子天平,德国Sartorius公司。
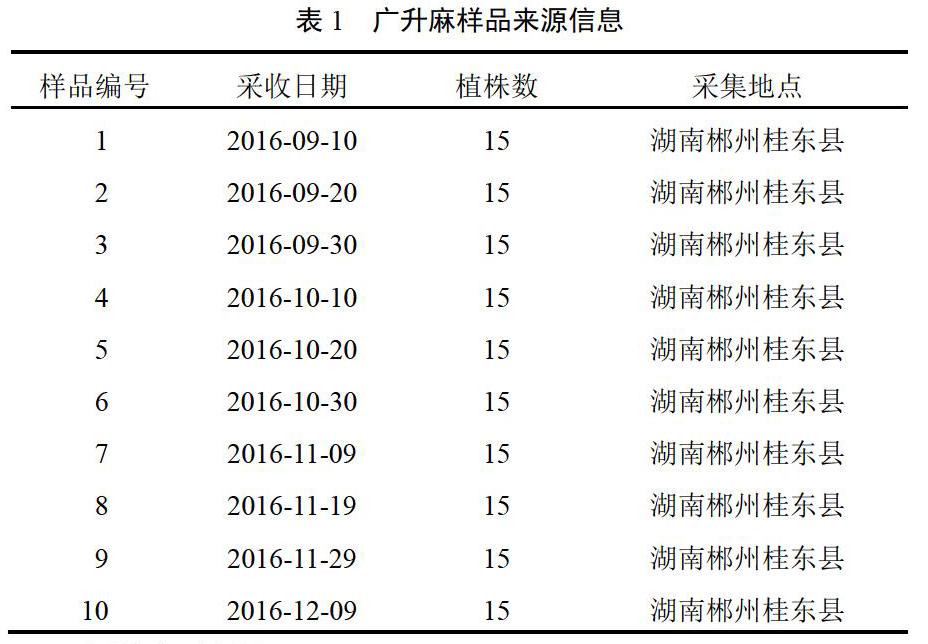
蜕皮甾酮对照品(成都曼思特生物科技有限公司,批号MUST-12122111,纯度>98%);甲醇为色谱纯,其他试剂均为分析纯,水为纯净水。结合传统采收时间和广升麻物候期,于2016年9月10日-12月9日每隔10 d采挖样品(编号1~10),每号地块随机取样5株,共3个重复,取样在样地中具代表性,样品经湖南中医药大学药学院中药资源教研室周日宝教授鉴定为菊科植物麻花头Serratula chinensis S. Moore的干燥块根。样品来源信息见表1。
2 方法与结果
2.1 色谱条件
色谱柱:ZORBAX Eclipse XDB-C18(250 mm×4.6 mm,5 μm);流动相:甲醇-水(45︰55,V/V);流速:1.0 mL/min;检测波长:248 nm;柱温:30 ℃;进样量:10 μL。
2.2 溶液制备
2.2.1 对照品溶液
精密称取蜕皮甾酮对照品20.48 mg,置于100 mL棕色量瓶中,加甲醇溶解并稀释至刻度,摇匀,制成浓度为204.8 μg/mL的对照品溶液;用移液管量取5 mL,置于10 mL棕色量瓶中,加甲醇稀释至刻度,摇匀,制成浓度为102.4 μg/mL的对照品溶液,置4 ℃冰箱避光保存。
2.2.2 供试品溶液
将广升麻样品烘干,粉碎,过40目筛。取各采收期粉碎样品约0.5 g,精密称定,分别置于250 mL圆底烧瓶中,加甲醇50 mL,称定质量,75 ℃加热回流提取60 min,放冷,再称定质量,用甲醇补足减失的质量。取一定量的提取液,过0.45 μm微孔滤膜,取续滤液,即得,置4 ℃冰箱避光保存。
2.2.3 阴性对照溶液
取甲醇50 mL,置于250 mL圆底烧瓶中,称定质量,75 ℃加热回流提取60 min,放冷,再称定质量,用甲醇补足减失的质量。取一定量的提取液,过0.45 μm微孔滤膜,取续滤液,即得。
2.3 系统适用性试验
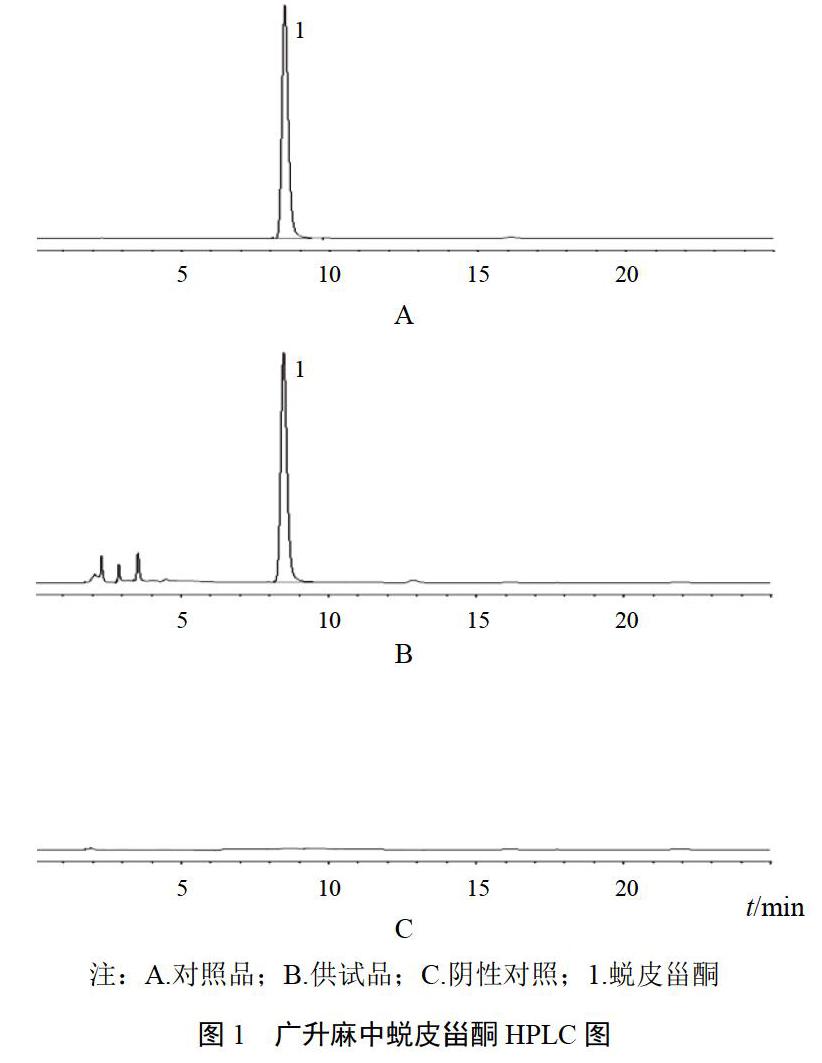
精密量取“2.2”项下对照品、供试品和阴性对照溶液适量,按“2.1”项下色谱条件进样测定,色谱图见图1。在该色谱条件下,蜕皮甾酮与其他峰分离良好,分离度>1.5,理论塔板数以蜕皮甾酮峰计为8482,保留时间约8.4 min。其他成分对测定无干扰。
2.4 线性关系考察
分别精密量取“2.2.1”项下对照品溶液2、4、6、8、10、20 μL,按“2.1”项下色谱条件进样测定,记录峰面积,以进样量为横坐标,峰面积为纵坐标,进行线性回归,得回归方程Y=1869.3X+6.751(r=0.999 7)。结果表明,蜕皮甾酮的线性范围为0.204 8~2.048 μg。
2.5 精密度试验
精密吸取“2.2.1”项下对照品溶液10 μL,按“2.1”项下色谱条件连续进样6次测定,记录峰面积,结果蜕皮甾酮峰面积RSD=1.67%,表明仪器精密度良好。
2.6 稳定性试验
取7号供试品溶液适量,分别于室温放置0、4、8、10、12、24 h时按“2.1”项下色谱条件进样测定,记录峰面积,结果蜕皮甾酮峰面积RSD=1.98%,表明供试品溶液在室温放置24 h内稳定性良好。
2.7 重复性试验
取7号样品,按“2.2.2”项下方法平行制备6份供试品溶液,按“2.1”项下色谱条件进样测定,记录峰面积并计算含量,结果蜕皮甾酮的平均含量为0.83%,RSD=1.23%,表明本方法重复性良好。
2.8 加样回收率试验
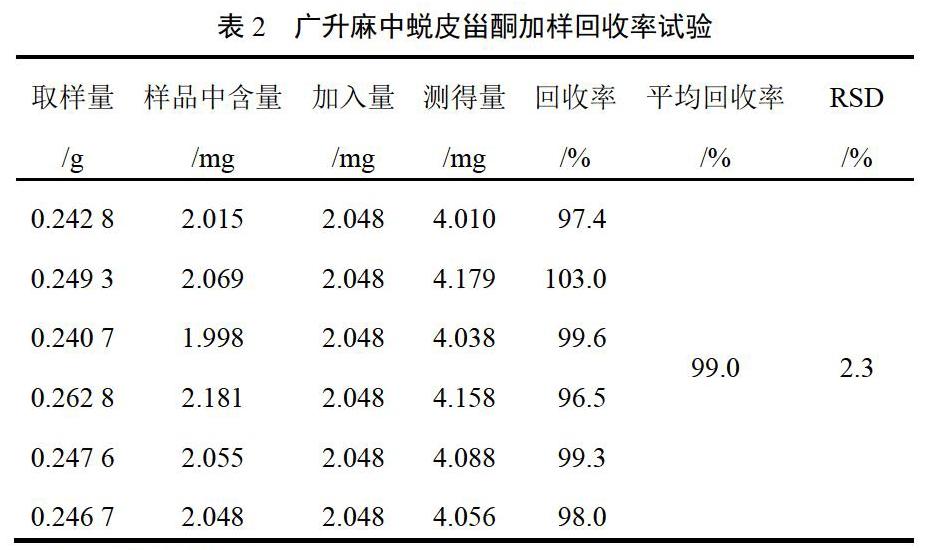
精密称取已知蜕皮甾酮含量的7号样品粉末0.25 g,共6份,置于50 mL棕色量瓶中,分别加入“2.2.1”项下浓度为204.8 μg/mL的对照品溶液10 mL,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表2。
2.9 样品测定
样品采收后称重,记录各编号样品干重、鲜重。按每株占地40 cm×40 cm,每亩3125株(666.7 m2÷0.16 m2×75%,排水沟占地25%),计算亩产量。前期试验测得折干率(干重/鲜重)为31%,计算折干亩产量。样品按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,记录峰面积并计算样品蜕皮甾酮含量,结果见表3。不同采收期亩产鲜重动态变化见图2,蜕皮甾酮含量动态变化见图3。
由表3、图2、图3可知,不同采收期广升麻产量及蜕皮甾酮含量呈动态变化:9月中旬至12月上旬,随着采收期的推迟,广升麻亩产鲜重呈现先上升后平稳的趋势,10月下旬达到最大值,其后直至12月上旬基本保持稳定;蜕皮甾酮含量于9月中旬至12月上旬呈现先升高后缓降直至基本平稳的趋势,10月底达峰值,11月上旬稍有下降后直至12月上旬基本趋于平稳,且较10月底前蜕皮甾酮含量处于较高水平。
3 讨论
本试验进行了提取方法考察,对比超声提取和回流提取样品前处理方法,结果回流提取效率高;对比提取溶剂乙醇、甲醇,回流时间30、60 min,结果甲醇回流提取60 min样品的蜕皮甾酮提取效率更高。因而最终选择甲醇75 ℃回流提取60 min。本试验对色谱条件中的流动相比例进行了优化,结果表明,以甲醇-水(45︰55,V/V)流动相,蜕皮甾酮分离效果好,与其他物质分离度良好,且方法学稳定,可用于广升麻中蜕皮甾酮含量测定。
本研究对不同采收期广升麻产量及蜕皮甾酮含量的变化规律进行比较研究。广升麻亩产量于9月中旬至12月上旬呈先上升后平稳的趋势,于10月下旬达峰值;蜕皮甾酮含量于9月中旬至12月上旬呈先上升后缓降直至平稳的趋势,10月下旬达峰值。10月中旬至10月下旬,蜕皮甾酮含量呈急剧上升趋势,且10月下旬亩产量已达峰值。综合考虑2项指标,10月下旬即可开始采收,再结合广升麻物候期及農艺性状,初步确定广升麻的最佳采收期为11月上、中旬,即植株地上部分枯萎时期,以保障亩产量、蜕皮甾酮含量均高,为合理采收广升麻药材提供了依据。
广升麻的常规入药部位为干燥块根,在产地采收加工时多除去芦头及须根[12]。本研究发现,广升麻须根数量多,相对产量较大,故进行了不同粗细广升麻芦头、须根中蜕皮甾酮含量初步比较,结果同一时期采收的不同规格(直径<2 mm、2 mm<直径<6 mm、直径>6 mm)的广升麻芦头、须根中蜕皮甾酮含量差异无统计学意义(P>0.05),提示可进行扩大广升麻入药部位的相关研究,使其资源利用最大化。
参考文献:
[1] 广东中药志编委会.广东中药志:一卷[M].广州:广东科技出版社, 1994:142-144.
[2] 蔡巧燕,曾建伟,林珊,等.广升麻质量标准研究[J].福建中医药大学学报,2011,21(4):38-40.
[3] 李毅然,陈玉萍,黄艳,等.升麻与广升麻挥发油成分的GC-MS分析[J].广西中医药,2012,35(4):56-59.
[4] 黄驰.广升麻的提取物、其制备方法及其用途:200410014710.6[P]. 2006-03-22.
[5] 凌铁军,马文哲,魏孝义.华麻花头根中的蜕皮甾酮类成分[J].热带亚热带植物学报,2003,11(2):143-147.
[6] LING T, XIA T, WAN X, et al. Cerebrosides from the roots of Serratula chinensis[J]. Molecules,2006,11(9):677-683.
[7] 凌铁军,吴萍,刘梅芳,等.华麻花头根中的神经酰胺成分[J].热带亚热带植物學报,2005,13(5):403-407.
[8] 王刚涛,张旭辉,张卫东,等.蜕皮甾酮对脂多糖诱导兔软骨细胞损伤的保护作用[J].天津医药,2015,43(6):587-589.
[9] 朱玉霞,孙丽莎,杨矫,等.蜕皮甾酮对2型糖尿病大鼠肝细胞IRS-2蛋白表达的影响[J].山东医药,2014,54(33):10-12.
[10] 罗春霞,张映琦,迟路湘,等.蜕皮甾酮对大鼠局灶性脑梗死的保护作用及机制初讨[J].西南国防医药,2009,19(2):176-178.
[11] 王洪明,陈炜,刘冬洁,等.HPLC测定牛膝和决津颗粒中β-蜕皮甾酮的含量[J].中国实验方剂学杂志,2012,18(9):122-125.
[12] 肖浩.广升麻质量标准的研究[D].广州:广州中医药大学,2014.
(收稿日期:2018-09-21)
(修回日期:2019-02-18;编辑:陈静)

