白桦BpZFP4基因启动子克隆和逆境响应元件功能分析
秦琳琳 张 曦 姜 骋 李 莉
(林木遗传育种国家重点实验室,东北林业大学,哈尔滨 150040)
植物的生长和发育会受到各种不利环境的影响,为了抵抗这些逆境,植物在长期的进化过程中形成了许多复杂的防御机制,这种防御机制往往是通过一系列感知和传导逆境信号的分子来实现的,如转录因子、酶和离子通道等[1]。转录因子又称反式作用因子,能够与基因启动子区域中顺式作用元件发生特异性结合来调控基因的转录过程,在调控基因表达中起着重要作用[2]。锌指蛋白是一类具有“手指状”结构域的转录因子,广泛的分布于人类和动植物中[3~4]。根据半胱氨酸(Cys)和组氨酸(His)残基的数目和位置的不同可将锌指转录因子分为C2H2、C8、C6、C3HC4(RING型)、C2HC、C2HC5(LIM型)、C4、C3H和C4HC3九个亚类,其中大部分锌指蛋白属于C2H2型[5]。
C2H2型锌指蛋白在植物应答生物和非生物胁迫方面发挥着重要作用[6]。研究发现,水稻C2H2型锌指蛋白基因ZFP245受高盐、低温和干旱的诱导,过表达ZFP245能够显著提高烟草的耐盐性[7]。水稻ZFP182在低温、干旱、高盐和ABA胁迫下表达量显著提高,过表达ZFP182的水稻植株在没有显著改变植株株型的同时提高了转基因植株的耐逆性[8]。Cheuk and Houde[9]等研究了53个小麦C2H2型锌指蛋白基因在不同胁迫条件下的表达模式,发现有44个基因对强光、37个基因对干旱胁迫、31个基因对水涝产生应答,其中有16个基因能够响应所有实验胁迫条件,表明这些TaZFPs在小麦耐受非生物胁迫中具有重要的作用。对毛果杨109个C2H2型锌指蛋白转录因子的研究发现,大多数基因的启动子区域包含有光响应元件或者非生物胁迫响应元件,RT-PCR分析结果表明这些基因在高盐、干旱和高温的胁迫下表达量显著增加[10]。这些胁迫相关元件的大量存在,预示着这些基因可能受胁迫响应蛋白的调控,进而在诸多逆境胁迫及生理过程中其重要作用。
本课题组应用转录组测序分析技术对白桦在盐、干旱胁迫下的表达谱进行了分析,发现一个C2H2型锌指蛋白基因BpZFP4(GenBank Accession number:KU234173.1)在盐、干旱胁迫处理下表达显著增强[11],为了进一步研究该基因启动子的功能,本研究首先通过染色体步移技术克隆获得BpZFP4基因启动子片段,通过生物信息学分析发现其中包含许多与逆境响应和激素响应相关的顺式作用元件,推测该启动子受干旱、盐等胁迫的诱导表达,为此我们通过5′端一系列缺失突变分析了启动子序列响应干旱(渗透胁迫)、盐胁迫以及植物激素ABA的主要调节区域及可能的顺式作用元件,为进一步探究BpZFP4基因对干旱、高盐以及ABA胁迫应答的调控机制提供理论依据。
1 材料与方法
1.1 实验材料
用于提取植物基因组DNA的白桦(BetulaplatyphyllaSuk.)无性系组培苗和遗传转化受体植物烟草(Nicotianabenthamiana)以及pCAMBIA 1301载体由本课题组保存。无缝克隆ClonExpress Ⅱ One Step Cloning Kit购自Vazyme。Genome Walking Kit、Ex Taq Polymerase、dNTPs Mixture以及DNA Marker均购自TaKaRa。胶回收试剂盒购自康为世纪,质粒小提试剂盒购自Omega。XbaⅠ、BglⅡ、T4DNA聚合酶以及T4-DNA连接酶购自Promega,大肠杆菌(Escherichiacoli)DH5α和根癌农杆菌(Agrobacteriumtumefaciens)GV3101感受态细胞购自北京庄盟国际生物基因科技有限公司。GUS组织化学染色底物X-Gluc和GUS酶活测定所用4-methylumbelliferyl β-D-glucuronide购自Sigma公司。
1.2 白桦BpZFP4基因启动子的克隆
按照BioTeke公司“新型快速植物基因组DNA提取试剂盒”的操作流程,以白桦无性系叶片为材料提取基因组DNA。采用染色体步移技术(TaKaRa Genome Walking Kit),根据白桦BpZFP4基因5′端序列信息,设计三条特异性引物SP1:5′-GGTGTCAAGTTCAAGTCCAAGCACA-3′,SP2:5′-CCACAGATTGAGCACTCATGCATCT-3′,SP3:5′-GTCGGTCGTGTTTAGCACATGAGA-3′,与试剂盒中随机引物AP1、AP2、AP3和AP4组合进行PCR反应,反应体系参照试剂盒说明书,经三次巢式PCR反应得到一段BpZFP4的CDS5′端侧翼序列。根据已获取的片段的5′端侧翼序列,继续设计三条特异引物,分别为SP4:5′-GGAAAGGCAATTGGGAAGTTGGGTA-3′,SP5:5′-CAGAGGTACGGAATATGAACGAGGA-3′,SP6:5′-GGAAGGATCCGATGACGCTCATA-3′进行第二次染色体步移。用BioEdit软件将通过两次染色体步移扩增的两条片段拼接成为BpZFP4基因启动子片段。
1.3 BpZFP4基因启动子顺式作用元件预测
将克隆获得的BpZFP4基因的启动子序列提交到New PLACE[12](http://www.dna.affrc.go.jp/PLACE/)和Plant CARE[13](http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线网站进行顺式作用元件的预测分析。
1.4 BpZFP4基因启动子5′-缺失片段融合GUS基因的植物表达载体构建
根据ClonExpress Ⅱ One Step Cloning Kit(Vazyme)使用说明设计PCR引物,其中在正反向引物中分别引入XbaⅠ和BglⅡ酶切位点以及线性化载体两末端的同源序列(表1)。以携带BpZFP4全长启动子的T载体质粒为模板进行PCR扩增。PCR反应体系如下:10×Ex PCR Buffer 2.0 μL,2.5 mmol·L-1dNTPs 2.0 μL,10 mmol·L-1上下游引物各0.5 μL,100 ng DNA,2 U·μL-1Ex Taq DNA Polymerase 0.1 μL,ddH2O补足20 μL。PCR反应程序:94℃预变性3 min,94℃变性30 s,58℃退火30 s,72℃延伸2 min,35个循环,72℃延伸10 min。将不同片段PCR产物胶回收,酶切验证并与去除CaMV35S启动子的pCAMBIA1301载体片段进行重组反应。
表1BpZFP4启动子5′缺失片段与GUS基因融合所用引物序列
Table 1 A list of primers used to construct different deletions of theBpZFP4 promoter::GUSexpression vector
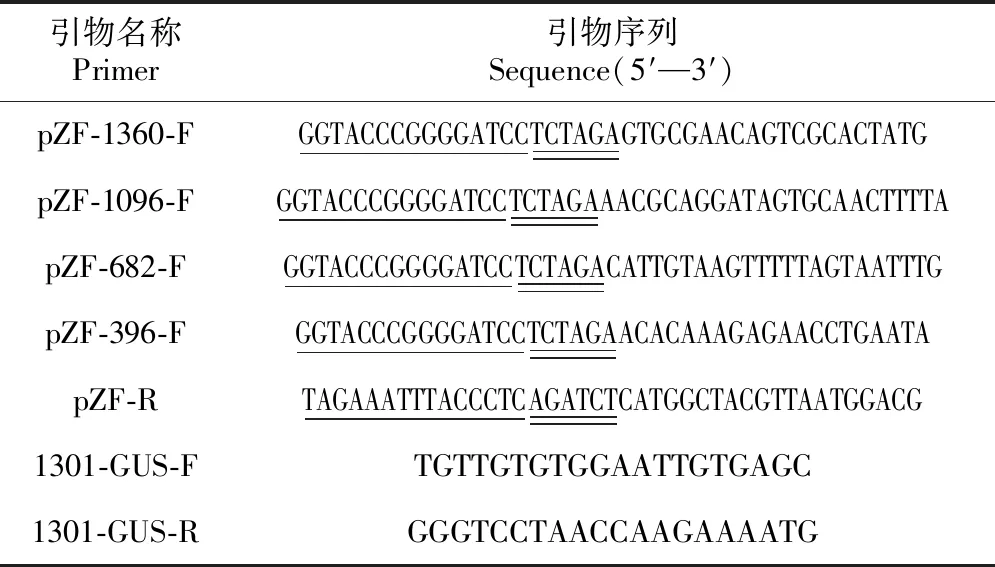
引物名称Primer引物序列Sequence(5′—3′)pZF-1360-FGGTACCCGGGGATCCTCTAGAGTGCGAACAGTCGCACTATGpZF-1096-FGGTACCCGGGGATCCTCTAGAAACGCAGGATAGTGCAACTTTTApZF-682-FGGTACCCGGGGATCCTCTAGACATTGTAAGTTTTTAGTAATTTGpZF-396-FGGTACCCGGGGATCCTCTAGAACACAAAGAGAACCTGAATApZF-RTAGAAATTTACCCTCAGATCTCATGGCTACGTTAATGGACG1301-GUS-FTGTTGTGTGGAATTGTGAGC1301-GUS-RGGGTCCTAACCAAGAAAATG


将含有CaMV35S启动子的pCAMBIA1301载体作为阳性对照;以去除CaMV35S启动子的pCAMBIA1301载体作为阴性对照,其构建方法是采用XbaⅠ和BglⅡ双酶切pCAMBIA1301载体质粒以去除CaMV 35S启动子,用T4DNA聚合酶将线性化载体的5′突出末端补平后,使用T4DNA连接酶将平末端载体相连。
1.5 农杆菌介导的烟草瞬时转化
农杆菌注射渗透法转化烟草参照Yang等[14]。方法如下:将连接后的重组质粒转化大肠杆菌DH5α感受态细胞,对阳性克隆进行菌液PCR鉴定,把经测序比对正确的重组质粒通过液氮冻融法导入农杆菌感受态细胞GV3101中,在含有50 mg·L-1Kan的LB固体培养基上筛选阳性克隆。经菌液PCR验证的单菌落扩大培养至OD600=0.6~0.8,5 000 r·min-1常温离心10 min收集菌体,用渗透液MMA[10 mmol·L-1MgCl2,10 mmol·L-1MES,150 mmol·L-1乙酰丁香酮,pH=5.7]重悬,室温静置3 h,分别将阳性对照、阴性对照和含有重组载体的农杆菌渗透缓冲液注射到6周龄、长势接近的烟草植株叶片中,浸染后的植株在16 h/8 h光照/黑暗和25℃条件下继续培养48 h时,用直径为1 cm的叶片打孔器制备烟草叶盘,并立即进行逆境胁迫处理。
1.6 非生物胁迫处理烟草叶盘的GUS组织化学染色分析
分别将叶盘悬浮在含有200 mmol·L-1NaCl、18% PEG6000、100 mmol·L-1ABA的1/2MS液体培养基中处理24 h,每个处理设3个重复,未做胁迫处理组作对照。
按照Jefferson[15]等的方法,对材料进行GUS组织化学染色分析,将材料浸泡于GUS染液中,染液包含0.1 mol·L-1K4Fe(CN)6、0.1 mol·L-1K3Fe(CN)6、50 mmol·L-1磷酸钠缓冲液(pH7.0)、10 mmol·L-1Na2EDTA、0.001%(V/V) Triton X-100、0.5 mg·mL-1X-Gluc和20%甲醇。37℃保温过夜,用脱色液(无水乙醇∶冰乙酸=3∶1)脱色,观察叶盘上深蓝色分布情况和颜色深浅,并拍照保存。
1.7 非生物胁迫处理烟草叶盘的GUS活性定量分析
剪取100 mg处理后的烟草叶盘加入3倍体积的GUS提取缓冲液[50 mmol·L-1磷酸钠缓冲液(pH7.0),10 mmol·L-1EDTA(pH8.0),0.1% Triton X-100,0.1%(w/v)SDS和0.1% β-巯基乙醇],研磨成匀浆,于12 000 r·min-1,4℃离心10 min,收集上清4℃保存备用。利用TAKARA Bradford protein assay kit测定总蛋白含量,使用Infinie200 PRO多功能酶标仪测定样品的荧光强度。
1.8 数据处理
采用IBM SPSS Statistics 18.0软件进行数据处理,测定结果利用Origin 8.0作图软件绘制图形。所有数据均为3次重复。
2 结果与分析
2.1 白桦BpZFP4基因启动子的克隆
以白桦基因组DNA为模板,采用染色体步移技术经过三轮PCR扩增获得一条长度约为900 bp的片段(图1a),将该产物胶回收纯化,连接至pMD19-T载体,转化大肠杆菌。用载体通用引物M13-47和RV-M对菌液进行PCR鉴定,选择阳性单克隆测序。通过序列比对,发现该片段3′端的99个碱基与BpZFP4基因的CDS起始序列(1~99 bp)完全一致,说明分离到的片段是BpZFP4基因的启动子序列。
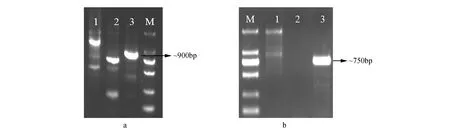
图1 BpZFP4启动子片段的克隆 a~b.第一次和第二次染色体步移扩增产物(M.DNA Marker DL2000;1~3.第1、2及3三轮PCR反应产物Fig.1 Cloning of the BpZFP4 promoter fragment by Genome Walking a-b.1st and 2nd amplification by genome walking(M.DNA Marker DL2000; 1-3.The 1st, 2nd and 3rd Nested PCR amplification products
根据第一次染色体步移获取的片段序列信息,设计第二次染色体步移的特异性引物,经三轮PCR扩增获得长度约为750 bp的侧翼序列(图1b)。将两次获得的片段序列拼接,根据其两端序列设计引物,进行PCR扩增。PCR产物按照如上所述方法连接、转化及测序验证,序列分析表明,该序列长度为1 360 bp。
2.2 BpZFP4基因启动子顺式作用元件预测分析
利用New PLACE和PlantCARE在线分析软件预测BpZFP4启动子上顺式作用元件,结果显示该启动子含有14个TATA box和18个CAAT box启动子核心元件,除此以外,在启动子序列多个区域分布有多种与BpZFP4诱导表达相关的顺式调控元件,它们是6种光响应相关元件,包括AT1-motif、Box4、G-Box、IBOXCORE、INRNTPSADB、TCT-motif;14种激素响应相关元件,如脱落酸响应元件ABRE、生长素和水杨酸响应元件As-1、水杨酸响应元件TCA-element和WBOXATNPR1、MeJA响应元件CGTCA-motif和TGACG-motif、乙烯响应元件ERE、光及水杨酸响应元件GT1CONSENSUS、赤霉素及ABA响应元件PYRIMIDINEBOXHVEPB1、赤霉素响应元件GARE2OSREP1、GAREAT、MYBGAHV、PYRIMIDINEBOXOSRAMY1A和WRKY71OS;15种与防御和逆境响应相关元件包括低温诱导响应LTR、盐和病原物响应元件GT1GMSCAM4、厌氧诱导必须的顺式调控元件ARE、缺氧特殊诱导类似的增强顺式作用元件GT-motif、脱水胁迫响应元件ACGTATERD1、MYB1AT、MYBCORE和MYCCONSENSUSAT、抗病响应元件BIHD1OS、损伤响应元件WBOXNTERF3以及参与防御和胁迫反应的顺式作用元件CACGTG motif、TC-rich repeats、DOFCOREZM、As-1和SEBFCONSSTPR10A等(表2)。这些元件的存在,表明BpZFP4基因的表达可能被识别这些元件的转录因子所调控,从而在植物生长发育、响应激素信号分子的刺激以及逆境胁迫等过程中发挥作用。
2.3 BpZFP4启动子元件缺失突变分析
为了分析非生物胁迫和ABA响应相关元件在BpZFP4启动子中的作用,寻找存在的关键功能区域,根据顺式作用元件的功能及分布区域将启动子分成四段不同长度的缺失片段(图2a),分别命名为pZF-1360,pZF-1096,pZF-682,pZF-396,其中数字代表该片段相对于翻译起始位点的位置(ATG中的A为+1)(表1)。以上述启动子缺失片段定向替换植物表达载体pCAMBIA1301上GUS基因前的CaMV35S启动子片段,构建获得含有启动子不同缺失长度片段融合GUS报告基因的瞬时表达载体,其构建策略如图2b所示。
2.4 BpZFP4启动子5′-缺失片段的表达载体构建
以携带BpZFP4全长启动子的T载体质粒为模板,通过PCR扩增获得四条不同长度的启动子缺失目的条带,与预期大小一致(图3a),将其纯化回收进行XbaⅠ和BglⅡ双酶切,与pCAMBIA1301载体片段进行重组反应,新的重组质粒利用载体序列引物1301-GUS-F或1301-GUS-R(表1)与缺失片段扩增引物经菌落PCR验证(图3b),证明四条启动子缺失片段已克隆到pCAMBIA1301载体上。采用液氮冻融法,分别将表达载体转入根癌农杆菌GV3101感受态细胞中,经菌落PCR鉴定,获得阳性克隆,完成工程菌制备。
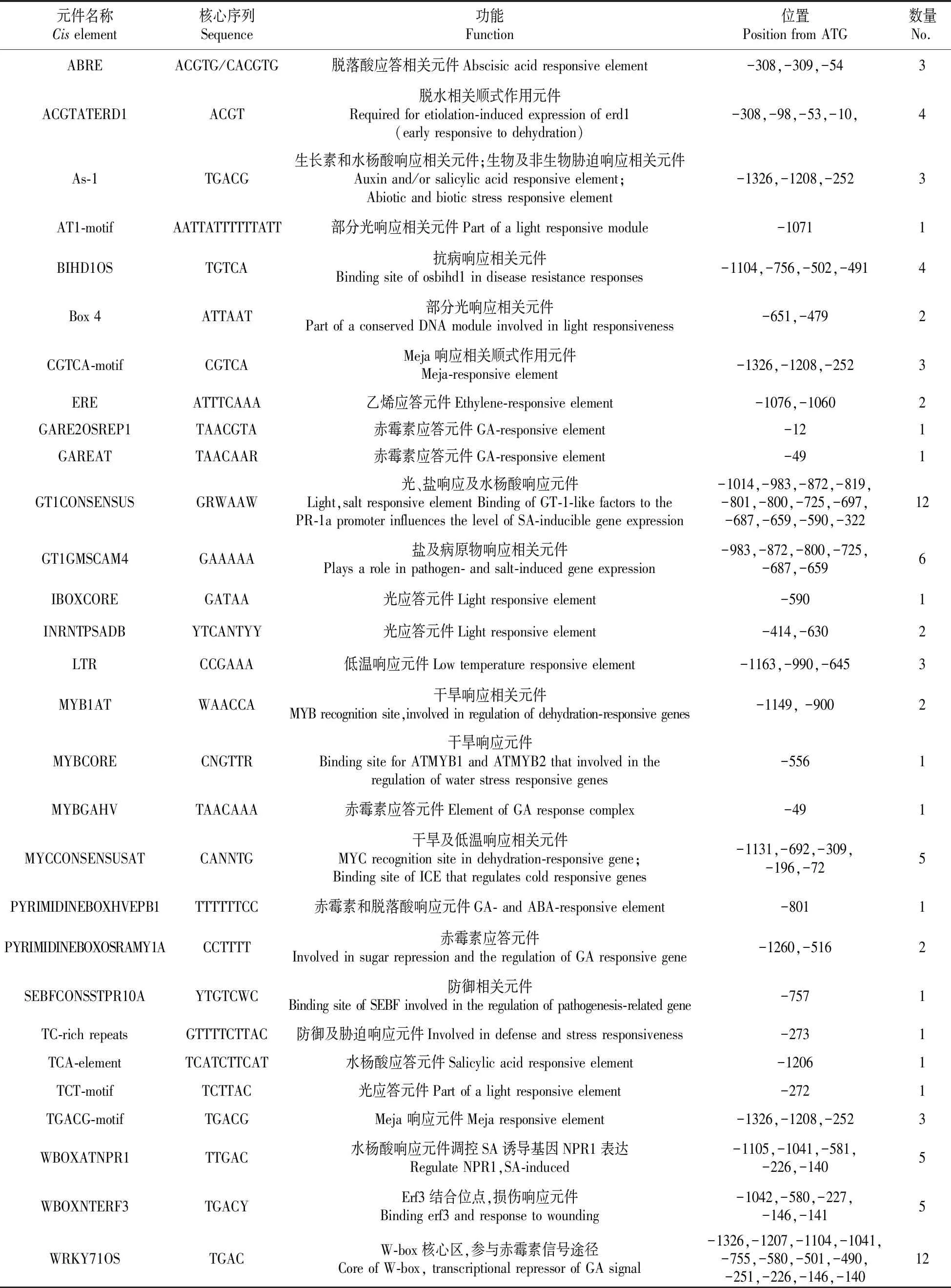
表2 BpZFP4启动子顺式作用元件功能预测
注:碱基序列:R=G/A,W=A/T,N=A/T/C/G
Note:Base sequence:R=G/A,W=A/T,N=A/T/C/G
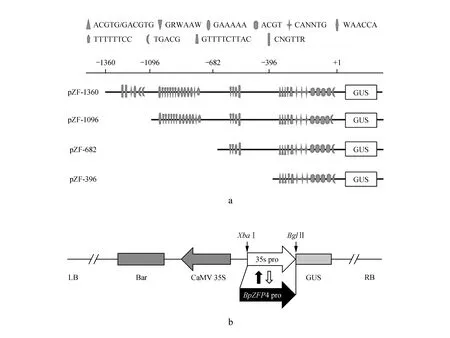
图2 BpZFP4启动子5′-缺失突变分析 a.BpZFP4启动子主要干旱、盐、ABA响应相关元件分布示意图;b.BpZFP4基因启动子缺失片段与GUS基因融合示意图Fig.2 Deletion analysis of the BpZFP4 gene promoter in transgenic tobacco plants a. Nucleotide sequence and distribution map of cis-acting elements of the main cis-elements in BpZFP4 promoter; b. Schematic representation of BpZFP4 promoter::GUS vector constructs
图3 BpZFP4启动子融合GUS重组载体构建 a.BpZFP4不同长度启动子缺失片段PCR产物(M. DNA Marker DL2000;2~5. pZF-1360,pZF-1098,pZF-682,pZF-396);b.BpZFP4启动子不同片段的重组质粒交叉PCR验证(M. DNA Marker DL2000;2~5.四条不同长度缺失片段重组质粒交叉PCR产物)Fig.3 PCR amplification of BpZFP4 full length promoter a. (M.DL2000 DNA Marker; 2-5. pZF-1360,pZF-1098,pZF-682,pZF-396); b.The four different length recombinant vectors were verified by plasmid PCR(M.DL2000 DNA Marker; 2-5.BpZFP4 four different length promoter fragment)
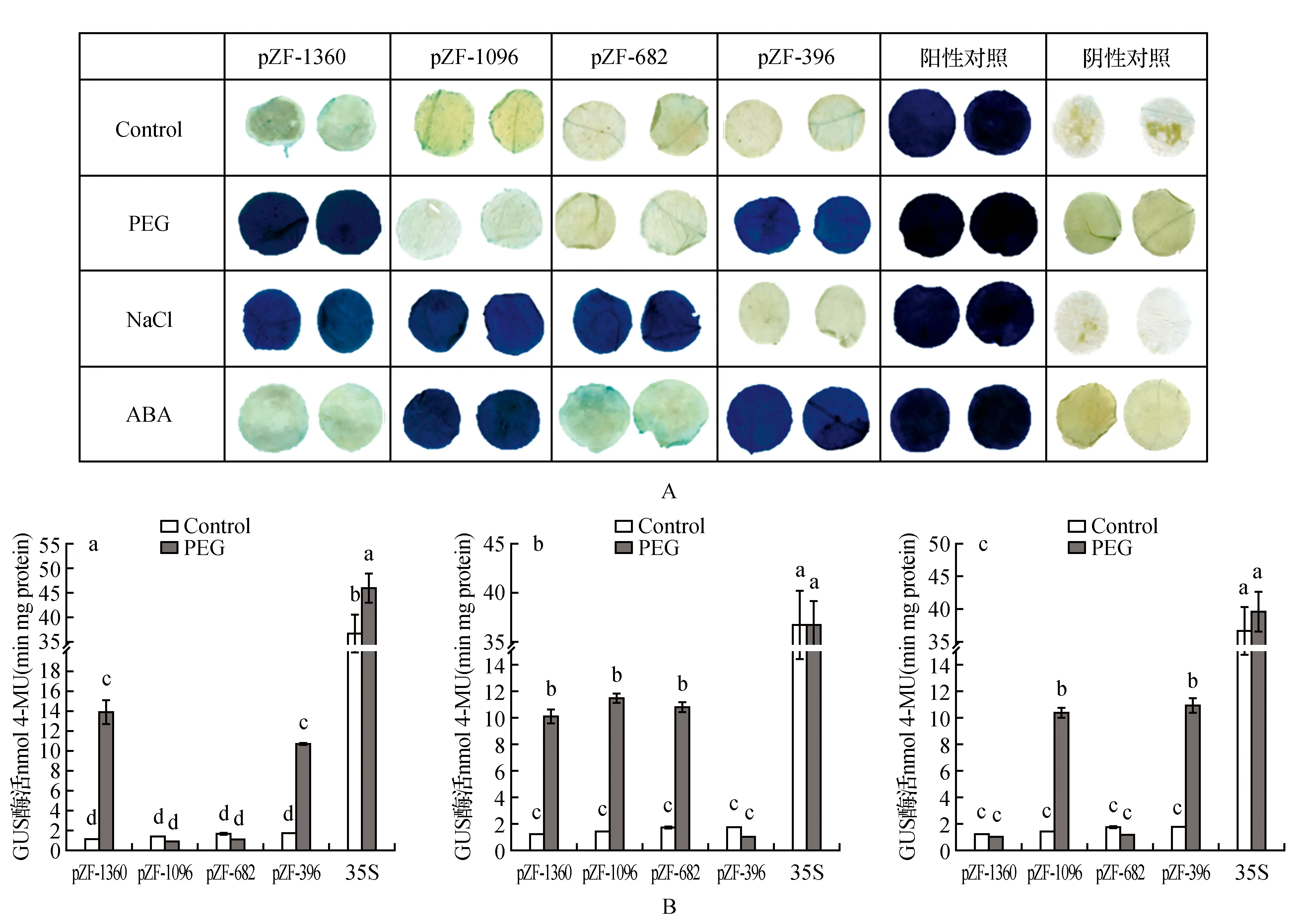
图4 BpZFP4启动子不同缺失片段对非生物胁迫和激素胁迫响应分析 A. 18%(w/v) PEG 6000,200 mmol·L-1 NaCl 和100 mmol·L-1 ABA胁迫下转基因烟草叶盘GUS组织化学染色分析;B. 18%(w/v) PEG 6000,200 mmol·L-1 NaCl和100 mmol·L-1 ABA胁迫下转基因烟草GUS活性染色分析,所有数据为3次重复。Fig.4 Analysis of BpZFP4 promoter deletion constructs in tobacco plants under drought,salt and ABA treatments A. GUS histochemical staining of four deletions constructs in tobacco plants under 18%(w/v) PEG6000,200 mmol·L-1 NaCl and 100 mmol·L-1 ABA treatments; B. GUS activity of different deletion constructs in tobacco plants under 18%(w/v) PEG6000(a),200 mmol·L-1 NaCl(b) and 100 mmol·L-1 ABA(c) treatments(Values represent the means±SD from three repeats)
2.5 BpZFP4启动子不同缺失片段对非生物胁迫和激素胁迫响应分析
利用注射法分别将含有BpZFP4启动子5′缺失片段重组质粒的农杆菌浸染烟草叶片,以带有CaMV35S的pCAMBIA1301载体质粒作为阳性对照;并以去除35S启动子片段的pCAMBIA1301载体质粒作为阴性对照,对浸染后的叶盘分别进行200 mmol·L-1NaCl、18% PEG6000及100 mmol·L-1ABA胁迫处理,以未胁迫处理的叶片为对照组。
GUS组织化学染色分析结果显示(图4A),阴性对照的烟草叶盘未被染上蓝色,而阳性对照的叶盘被染成了明显的深蓝色。在经过PEG胁迫处理的启动子系列缺失表达实验组中,转入pZF-1360、pZF-396载体质粒的叶盘在未做胁迫处理下染色较浅,而将浸染后的叶片用PEG处理24h后,染色效果明显加深,说明pZF-1360和pZF-396片段在干旱胁迫条件下能够显著诱导GUS报告基因的表达。观察受NaCl处理的启动子缺失片段的GUS染色结果,可以发现转入pZF-396缺失结构的叶盘在胁迫前后染色结果没有明显的区别,而转pZF-1360、pZF-1096和pZF-682质粒的叶盘均被染成蓝色,且染色比未做胁迫处理的叶盘更深,表明这三个启动子缺失片段均响应盐胁迫,驱动GUS基因在植株中的表达。在ABA处理后,转入pZF-1096和pZF-396质粒的叶盘染色比对照深,说明GUS的表达受到ABA胁迫的诱导,而转入pZF-1360和pZF-682片段却没有表现出这种诱导效果。
通过以上GUS组织化学染色,我们初步明确了BpZFP4启动子受干旱、盐及ABA胁迫诱导,属于逆境胁迫诱导型启动子。为了进一步明确该启动子中与逆境响应相关的区域,在进行GUS组织化学染色分析的同时,我们对不同长度5′端缺失启动子片段的转基因烟草叶片进行了三种胁迫处理和GUS酶活性测定,结果如图4B所示,在PEG胁迫处理条件下,转入pZF-1360和pZF-396片段的叶盘中GUS酶活性均有显著的提高,分别是未胁迫处理叶盘中GUS酶活的11.44和6.05倍,而转入pZF-1096和pZF-682片段的叶片中在诱导前后的酶活性无明显变化(图4B:a),这与上述的染色结果相一致。综合染色和酶活分析的结果可以看出,启动子的-1 360~-1 096 bp和-396~-1 bp区域具有明显的干旱诱导特性,进一步结合顺式作用元件的分布位置分析,发现在-1 360~-1 096 bp区域中存在MYB1AT和MYCCONSENSUSAT以及在-396~-1 bp区域中含有ACGTATERD1,ABRELATERD1和MYCCONSENSUSAT等与干旱诱导相关的顺式作用元件。虽然-1 096~-396 bp区域中也同样存在MYB1AT,MYBCORE和MYCCONSENSUSAT等干旱响应相关元件,但是GUS活性增加不明显,说明在该区域可能存在有负调控元件。用同样的方法我们对BpZFP4基因启动子片段在NaCl胁迫下的GUS酶活进行了分析,发现在未胁迫情况下,转入四个缺失片段的叶盘中GUS酶活均约为1左右,而在NaCl胁迫之后,转pZF-1360,pZF-1096和pZF-682的GUS酶活比正常情况下分别上升了8.30,8.09和6.18倍,而转pZF-396片段的GUS酶活与正常情况下没有显著的差异(图4B:b)。这可能是由于位于-396~-682 bp和-682~-1 096 bp区域的GT1CONSENSUS和GT1GMSCAM4两个顺式作用元件响应了盐胁迫,使GUS表达量明显增加。在-1 096~-1 360 bp区域内虽然并不包含有盐响应相关元件,但可能存在并未明确功能的顺式作用元件,所以pZF-1360片段也响应了盐胁迫。在ABA胁迫处理的实验组中,转入pZF-1096和pZF-396片段的叶盘中受到ABA诱导后GUS酶活明显地增强,分别是对照组的7.3和6.19倍,而转pZF-1360和pZF-682片段与对照组没有明显变化(图4B:c)。序列分析发现在-396~-1区域有三个ABRE元件,它们可能参与了ABA胁迫的响应。
3 讨论
启动子是一段能与RNA聚合酶及转录因子发生特异性结合、决定基因转录起始的DNA序列,位于基因的上游[16]。启动子中包含的顺式作用元件可以与反式作用因子相互作用,使生物能根据需要或环境的改变,在特定的时间与位置表达目的基因。根据启动子的作用方式和功能的不同,可将其分为3种类型:组成型启动子、诱导型启动子和组织特异型启动子[17~18]。组成型启动子可使目的基因在转基因植物中非组织特异性和非诱导性高水平表达,具稳定性和持续性。如花椰菜花叶病毒CaMV35S启动子[19],而诱导型启动子可以根据需要在植物体特定发育阶段和组织器官中通过外界信号诱导目的基因表达[20],如泛素核糖体蛋白融合基因ubi3启动子在受到损伤后才能启动下游基因表达[21];组织特异性启动子可以调控基因只在某些特定的器官或组织部位表达,并表现出发育上的时空特异性。如白桦4CL基因启动子调控GUS基因在茎中表达;小黑杨ICE1基因启动子调控GUS基因在花和根中表达;而花生AhNCED1基因启动子调控GUS基因在叶片中表达[22~24]。近年来,随着对植物转基因研究的深入,对转基因植物生物安全性要求的提高,使用诱导型启动子和组织特异型启动子培育抗逆作物新品种在很多情况下成为最佳选择。
本研究利用染色体步移技术,成功克隆获得白桦BpZFP4基因启动子片段,进一步以生物信息学预测分析和GUS报告基因在烟草中瞬时表达的手段对BpZFP4基因启动子响应逆境胁迫的顺式作用元件及其所在区域和功能进行了分析。揭示了-1 360~-1 096 bp和-396~-1 bp区域为干旱诱导响应的正调控区,在该区域中发现有MYB1AT、MYCCONSENSUSAT等与干旱诱导相关的顺式作用元件。这与Abe等关于拟南芥干旱响应基因rd22启动子中MYB1AT和MYCCONSENSUSAT元件能够被MYB或MYC识别,增强了靶基因在干旱和ABA胁迫下表达的结果一致[25~26]。MYCCONSENSUSAT还是低温胁迫基因的识别位点,拟南芥CBF/DREB1和玉米ZmCBF3基因的转录是通过ICE1识别该位点起始的[27~28],预示了BpZFP4对胁迫响应的多样性。此外,在高盐响应的正调控区-1 360~-396 bp中,存在有6个GT1GMSCAM4元件。前人在对大豆SCaM-4[29]、豌豆PsSEOF1[30]、甜瓜CmLOX08[31]等基因启动子逆境响应元件及其功能分析中报道,GT1GMSCAM4元件在盐胁迫条件下能够显著诱导GUS报告基因的表达。因此GT1GMSCAM4可能对BpZFP4基因在盐胁迫下的转录起到调控作用。
ABA是一种重要的逆境植物激素,在许多逆境下能够增加积累,并通过整合多种胁迫信号,调控下游应激相关基因的表达[32]。植物对胁迫信号应答的途径分为依赖于ABA和不依赖于ABA受体两种类型[33],转录因子通过不同的ABREs、DRE/CRTs或者MYB和MYC识别motifs激活应激反应[26,34]。BpZFP4基因启动子的pZF-1096和pZF-396片段响应ABA胁迫,GUS基因的表达获得显著增强,分析发现,在-396~-1区域分布有三个ABRE元件。根据这些分析结果,我们可以推测BpZFP4启动子中的ABREs元件可能在响应外源ABA处理中发挥作用,但是BpZFP4基因是否通过依赖ABA途径对非生物胁迫作出响应还需要进一步的研究。
本研究发现BpZFP4启动子序列中含有多个干旱、高盐及ABA响应相关的顺式作用元件,其中一些元件对启动子受逆境胁迫和激素的诱导起着重要的作用,这对进一步深入地了解逆境胁迫下白桦BpZFP4基因的表达调控和指导林木转基因育种提供了新的依据。

