酒精性肝硬化并发单核细胞增生李斯特菌感染致腹膜炎1例
马 丽,黄 玲
(南京中医药大学附属南京医院/南京市第二医院检验科,江苏南京 210003)
单核细胞增生李斯特菌(LM)是一种人畜共患病的病原菌,广泛分布于自然界及动物源性食品中(肉、奶制品、海产品等),对外界环境适应能力较强,多见于夏末秋初,人类感染LM主要通过食物传播途径,且多为散发性感染[1]。肝炎患者由于肝功能受损严重,机体免疫防御功能低下,容易诱发各种感染,导致肝肾综合征、肝性脑病、上消化道出血以及感染性休克等多种严重并发症,甚至发生多脏器功能衰竭,预后差,病死率高。目前已有酒精性肝硬化并发细菌性腹膜炎的报道[2],但多为革兰阴性杆菌感染,而肝硬化合并LM引起的腹膜炎在临床上鲜有报道。本文对本院于2018年3月收治的1例LM引起的酒精性肝硬化并发腹膜炎的病例总结报道如下。
1 病历资料
患者,男,76岁,因“发热伴四肢抽搐半天”于2018年3月入院。入院半天前无诱因出现发热,无意识丧失,能自主复述摔倒发生过程。既往有酒精性肝硬化1年余,腹部膨隆,全身多处色素沉着。入院查体:腹部稍膨隆,全腹无压痛及反跳痛,移动性浊音可疑阳性,肠鸣音正常,约4次/分,双下肢轻度水肿。血常规示WBC 10.94×109/L,红细胞3.88×1012/L,血小板135×109/L,中性粒细胞百分比86.7%;C-反应蛋白101.40 mg/L;降钙素原(PCT)18.10 ng/mL;腹水常规示黄色,微浑,李凡他试验阳性,白细胞数0.95×109/L,多核占70%,单核占30%。腹水生化示总蛋白4.7 g/L,乳酸脱氢酶46 IU/L,葡萄糖14.4 mmol/L,氯106 mmol/L,腺苷脱氨酶0.3 U/L。血生化提示肝功能为清蛋白20.1 g/L,球蛋白31.4 g/L,清球蛋白比值0.64。
2 细菌培养及鉴定
入院时行无菌操作腹腔穿刺抽取患者腹水8~10 mL,注入血培养瓶,采用BACT/ALERT 3D 240型血培养仪(购自法国梅里埃公司)培养,18 h时机器提示阳性结果;无菌注射器抽取培养液分别转种哥伦比亚血琼脂(BA)培养皿、巧克力琼脂培养皿及沙保罗培养皿的同时培养液涂片革兰染色镜检,镜下疑革兰阳性小杆菌;35 ℃有氧培养24 h后可见光滑,灰白色,半透明,湿润菌落,直径约为0.5~2 mm,刮开菌落可见有狭窄的β溶血环,随时间延长菌落略大,溶血环趋于明显,触酶阳性,氧化酶阴性,菌落涂片示革兰阳性小杆菌,直或稍弯有的呈V字形,成对排列,见图1。挑取纯培养菌落,用MicroScan WalkAway40细菌鉴定仪(购自德国西门子公司)进行菌株鉴定,结果提示为李斯特菌属,生化反应符合,鉴定符合率97%。25 ℃半固体培养48 h,典型倒伞样动力,见图2,而35 ℃培养时半固体动力阴性。用金黄色葡萄球菌标准菌株ATCC 25923作为质控菌株进行CAMP实验,结果发现血琼脂平板上两种细菌相交处呈长方形加强溶血区域,见图3。
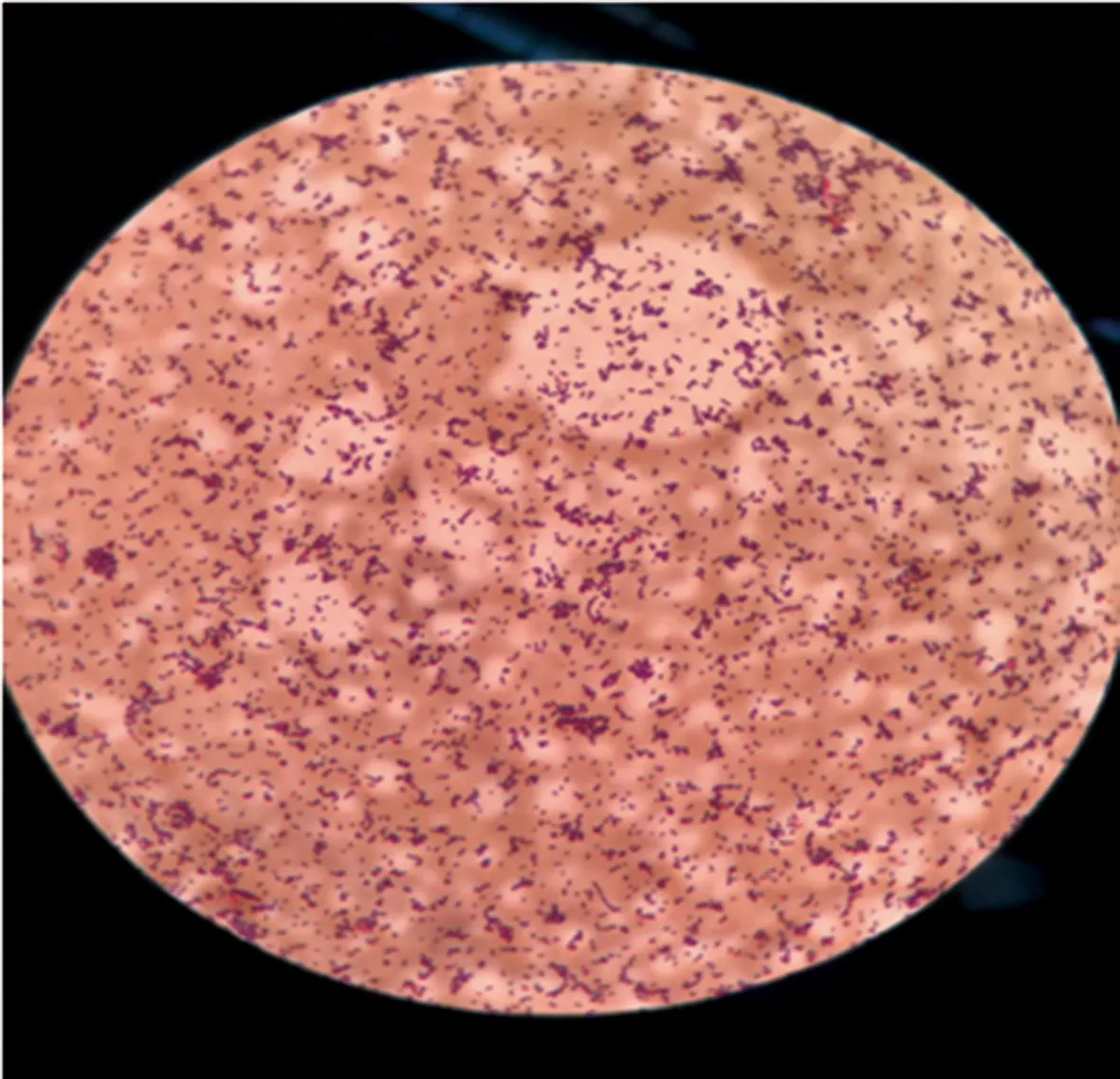
注:革兰阳性小杆菌呈直、稍弯或V字形,部分成对排列
图1菌落涂片革兰染色×1 000倍镜下分析结果

注:25 ℃半固体培养48 h时,LM呈典型倒伞样动力
图2细菌动力实验(半固体培养基)
入院后结合临床表现和辅助检查初步诊断为自发性腹膜炎引起持续高热,遂予以头孢哌酮舒巴坦抗感染治疗,并加用呋塞米利尿,减少腹腔积液,之后患者仍有大量腹水,持续高热,行腹腔引流导管植入,并行腹水引流。入院3 d,患者经头孢哌酮舒巴坦抗感染治疗后,病情未见好转。腹水培养鉴定为产单核细胞李斯特菌,由于此菌引起肝硬化并自发性腹膜炎的临床病例罕见,故临床经验调整抗菌药物为比阿培南联合利奈唑胺治疗,同时再次行腹水培养,病情依旧未见好转,当培养结果依旧是单核李斯特菌而未见其他微生物,考虑为单纯性李斯特菌感染,临床用药调整为氨苄青霉素。后患者体温逐渐下降,生命体征逐渐良好。再次血常规、腹水常规,腹水多次培养为阴性,患者情况好转,转入普通病房巩固治疗。见表1。

表1 相关检查结果

注:ATCC 25923金葡与待测菌相交处加强溶血区域呈长方形
图3 37℃孵育24 h CAMP实验检测结果
3 讨 论
肝硬化患者处于免疫抑制和激活并存的免疫紊乱状态,易于感染和出现炎性反应,而且这种免疫和炎性损伤容易被不断放大,形成恶性循环[3],本例患者具有肝硬化病史,全身多处色素沉着,其血清总蛋白、清蛋白水平较低,清球比下降,血清免疫球蛋白M、免疫球蛋白A、免疫球蛋白G、血清补体减少,且存在低钠血症等均可导致患者的免疫功能受损,符合LM感染的高危人群特征。肝硬化患者由于代谢紊乱、免疫球蛋白合成减少、粒细胞吞噬功能和单核-吞噬细胞系统功能减弱,补体缺损和血清调理作用下降,肠道菌群移位,容易合并细菌感染,致病菌常以革兰阴性菌多见,主要为大肠埃希菌、肺炎克雷伯菌、肺炎链球菌及肠球菌等[4]。本例患者入院时腹部膨隆,有移动性浊音,液波震颤阳性,腹水常规李凡他阳性,多核细胞增加,血常规中性粒细胞百分比高,C-反应蛋白及PCT水平明显升高,初期诊断自发性腹膜炎,用头孢哌酮舒巴坦经验抗菌治疗,患者病情加重,迅速恶化。分析原因可能为LM对头孢菌素天然耐药,临床上治疗首选抗菌药物为氨苄西林,可以单独或联合氨基糖苷类使用;本病例对大多数抗菌药物均敏感,提示耐药的LM菌株已经出现,临床上应加强对该菌株的药敏监测。
肝硬化患者并发腹膜炎并不少见,但由LM引起腹膜炎的病例报道较为少见,而由LM引起的肝硬化患者自发性腹膜炎的报道则极为罕见,目前国内仅见1例报道[5]。连凯等[6]统计了2002-2012年人和动物LM感染的流行病学数据,发现LM感染病例涉及27个省,其中动物感染报道次数123次,人感染报道病例84例,感染类型以中枢神经系统感染最多(72%)。而本研究自2000年以来,亦只发现了1例LM感染患者,表明LM感染是一种罕见的疾病。然而,随着饮食习惯的改变(生冷食品保存技术普遍应用、饮食习惯西式化)、老年人口的增加、合并免疫缺陷基础疾病病例的增多,国内关于LM引发血流感染的报道也逐渐增多[7-8]。应重视单增LM感染这一潜在风险,该病致死率和致残率高,但是目前进行早期快速诊断还没有很好的办法,又因LM感染的临床表现不特异,与其他细菌所致的自发性细菌性腹膜炎相比,LM合并腹膜炎在临床表现上除了高热,腹水外观多呈血性外,并无其他特异性,且即便检出也容易被误认为污染杂菌(如类白喉杆菌)而丢弃,不易引起临床医师重视,早期经验性应用抗菌药物时也常不能覆盖,导致治疗延误,所以预防此菌的感染很重要。此外,对于免疫缺陷者、孕妇、儿童及老人等人群,出现反复发热提示感染,常规经验用药后无好转甚至加重,培养到有动力的杆菌,而不符合革兰阴性杆菌鉴定时,应考虑到LM的可能,做到早诊断、早治疗、早转归。

