生物诱导法诱导降香檀结香的研究
汪金玉, 蔡丹燕, 林励, 李静, 李智
(1.广州中医药大学,广东广州 510006;2.茂名市食品药品检验所,广东茂名 525399)
豆科黄檀属植物降香Dalbergia odorifera T.Chen(中国植物志),《中华人民共和国药典》(简称《中国药典》)亦称降香檀,别名降香黄檀、海南黄花梨、花梨木等,主要分布于我国海南省,广东各地也有批量引种[1-3]。降香是我国国家标准5属8类34种最珍贵红木的品种之一[4],其茎干和根部干燥心材为名贵中药材降香,在藏医学和传统医学中使用已有上千年的历史,现为《中国药典》收载的唯一降香基原。目前,国内外对降香檀的研究主要集中在栽培种植[5,6]、化学成分分析及药效等方面[7-16],鲜见为解决降香资源的可持续开发及利用问题进行的研究。降香药用部位为心材(即结香),其生长周期较长,一般需10年左右才能初步结香,30年以上才能成材。自然生长的降香,在自然伤害条件下,包括雷击、蚁穴和昆虫啃食等,会在伤口附近产生少量降香心材类物质,但产量很低。我国野生降香檀基本采伐殆尽,虽然已有一定的人工种植面积,但由于生产技术落后,尤其是结香技术尚未能取得重大突破,迄今市场上尚鲜见家种降香檀产出的优质降香药材[17]。国内也有个别团队对缩短降香结香技术进行研究[18-20],并取得一定成果,方法包括水分胁迫、诱导液诱导、真菌诱导等等,但这些方法普遍存在所产心材量低、不能达到整体结香、产量低等缺陷。因此,研究高产、高效及高质量的人工诱导降香整体结香的方法仍是亟待解决的难题。本研究将对团队自主研发的生物诱导剂与目前常用的诱导结香液青鲜素、双氧水、乙酸、甲酸、噻苯隆等进行对比,以探寻较优的诱导降香结香液,本研究对于推动降香产业的发展及保护降香珍稀药用资源具有重要意义,现将研究结果报道如下。
1 材料与方法
1.1仪器安捷伦6780气相色谱—质谱(GC-MS)(美国安捷伦公司);XT220A型分析天平(d=0.000 01 g,瑞士Precisa公司);BP211D型分析天平(d=0.000 1 g,德国Sartorius公司);DFY-200型粉碎机(浙江温岭大德中药机械有限公司);1 000 mL植物绿化输液袋;妙达MOSTA/18V电钻(广东妙达工具有限公司);日本ARS爱丽斯G-18L折叠锯等。
1.2试剂生物诱导剂为本室自创的降香诱导结香液,已获国家发明专利(专利授权号:ZL201510074009.1)。青鲜素、双氧水、乙酸、甲酸、噻苯隆、乙醚、无水硫酸钠均为分析纯。
1.3试药降香对照药材(购自中国食品药品检定研究院,批号:120952-201108);降香檀挥发油对照品(购于广东省药品检验所,批号:111579-200201);降香结香材料为广东省茂名高州市降香檀基地(110°36′46″E,21°42′34″N,海拔150~162 m),实验材料为试验区4年生降香黄檀,经广州中医药大学中药学院林励研究员鉴定,其原植物为豆科黄檀属降香黄檀Dalbergia odorifera,以上凭证标本保存于广州中医药大学中药学院实验中心。
1.4实验方法
1.4.1 实验树体的选择 选取原则:4年生降香檀树,树干直径大于7 cm(离地1.20 m处),树体笔直、外观健康,无虫蛀、无霉变,分叉合理,见光度较好,主干无结香痕迹。按顺序进行编号处理,每组3个重复。分别记录各树的茎高、胸径、树的情况(受光、长势等)及试验点小环境,评估试验前树的总体情况,拍照并绘制分布图。
1.4.2 诱导方法 生物诱导剂、青鲜素、双氧水、乙酸、甲酸、噻苯隆均用去离子水按体积比浓度配置到8%。在距离地面高度0.8~1.2 m处,垂直树体方向用电钻对称开直径约0.5 cm的小孔,孔深约7 cm,试药通过输液袋输送给树体吸收,待吸收完全后,拔出插头即可。每株给药100 mL,其中空白对照组仅打孔不给药,阴性对照组给予去离子水。
1.4.3 观察指标 树的总体生长状况:观察记录诱导后树干、枝条、树叶生长情况,观察期分别为诱导后1周、2个月、4个月、6个月。处理部位变化情况:钻孔观察记录诱导后2个月、4个月及6个月心材形成情况,包括心材长度、心材直径、心材颜色及气味等。
1.4.4 心材挥发油质量检测 取生物诱导法组心材(诱导后6个月及12个月时),依照《中国药典》2015年版第四部通则2000中药其他方法项下2204挥发油测定法,提取其中挥发油,计算挥发油含量,并按气相色谱—质谱(GC-MS)法比较分析挥发油的组分。
GC-MS色谱条件为HP-5石英毛细管柱;进样口温度250℃;接口温度280℃;载气:氦气;流速:1 mL·min-1;分流比50∶1;进样量:1μL。升温程序:柱温60℃,保持2 min,以10℃·min-1升至115℃,保持2 min,再以1℃·min-1升至135℃,保持2 min,最后以10℃·min-1升至280℃,保持2 min。
2 结果与分析
2.1降香实验树生长情况经观察发现,不同诱导处理的各组降香植株生长状况组内基本一致,组间则存在一定差异。空白对照组、阴性对照组及双氧水组在6个月内生长基本无明显变化,青鲜素组、甲酸组及乙酸组在观察期内总体生长正常,树叶少量变黄及脱落,约4个月时恢复正常。噻苯隆组1周内树叶大量脱落,随后长出新芽。生物诱导组亦于1周时出现少量树叶脱落,2个月时发现偶有内含白色菌丝的细小分枝枯死,且有新芽和新枝长出,提示植株已进入修复生长阶段,4个月时始现植株树皮局部爆裂现象。各组具体生长情况见表1。由表1可知,生物诱导法对降香植株生长有显著影响。

表1 不同处理降香树生长情况表Table 1 The growth situation of the plants given by different treatments (n=3)
表2 不同诱导组心材长度变化情况Table 2 The changes of heartwood length in different induction groups (s,n=3)

表2 不同诱导组心材长度变化情况Table 2 The changes of heartwood length in different induction groups (s,n=3)
①P<0.05,②P<0.01,与空白组比较;③P<0.01,与生物诱导剂组比较
组别空白对照组阴性对照组青鲜素组甲酸组双氧水组乙酸组噻苯隆组生物诱导剂组6个月0.00±0.00③0.00±0.00③5.33±5.03③16.33±5.13②③0.00±0.00③21.33±4.732③48.00±11.27②③157.67±25.42②1周0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 2个月0.00±0.00③0.00±0.00③0.00±0.00③0.00±0.00③0.00±0.00③1.67±2.89③8.00±3.00①③46.00±11.00②4个月0.00±0.00③0.00±0.00③4.33±4.04③10.67±2.31②③0.00±0.00③11.00±2.65②③20.67±3.06②③90.00±13.45②
2.2降香实验树心材形成情况空白对照组、阴性对照组及双氧水组在诱导后2、4、6、12个月中均未形成红色心材类物质,无香味;青鲜素组、甲酸组及乙酸组多在诱导后2个月时,诱导孔周围有紫褐色渗出物,6个月时凿开观察,所形成心材类物质长度6~25 cm不等,直径约1.2~2.5 cm,颜色淡红,香气淡;噻苯隆组及生物诱导法组形成心材类物质较多,均于诱导后1周诱导孔周围即出现紫褐色渗出物,2个月时便有心材形成,6个月后凿开观察,心材呈紫红色,香气浓,其中噻苯隆组心材平均长度约20 cm,直径约1.5 cm,生物诱导法组心材平均长度达158 cm,直径约4.6 cm。各组心材形成情况见表2、3,图1、2。
由组间分析比较结果可知,诱导后4个月起,甲酸组、醋酸组、噻苯隆组及生物诱导剂组,4组所形成的心材长度及直径与空白对照组均存在显著性差异(P<0.01)。该4组中甲酸组、醋酸组的长度和直径,以及噻苯隆组的长度,与生物诱导剂组均存在显著性差异(P<0.01)。噻苯隆组的直径与生物诱导剂组差异性不显著。
上述结果表明,相对于其他各组,生物诱导剂组降香植株心材长度和直径均具有明显优势,成材量较大,且成材时间较早。
2.3生物诱导剂组心材挥发油质量分析分别取生物诱导剂诱导后6个月及12个月的心材,行“1.4.4”项下检测方法,结果诱导后6个月样品的挥发油含量为1.92%,诱导后12个月样品的挥发油含量为3.85%,均符合《中国药典》规定的不低于1%的要求。
按“1.4.4”项下色谱条件,对降香油对照品进行GC-MS分析,以NIST Mass Spectral Database检索及人工解析其化学结构,从中分离并鉴定了11个萜类成分,分别为香叶基丙酮、反式-β-金合欢烯、金合欢醇、环氧化没药烯、a-檀香醇、异香橙环氧化物、环氧化蛇麻烯、反式-橙花叔醇、β-甜没药烯、石竹烯氧化物及甜没药醇,见图3。其中以环氧化蛇麻烯、反式-橙花叔醇及β-甜没药烯3个成分为主要组分。
同样,按“1.4.4”项下色谱条件,对生物诱导剂诱导后6个月和12个月的心材,以及对照药材中的挥发性成分进行GC-MS分析,通过仪器自带RTE积分器,以峰面积归一化法计算求得各成分在各样品中的相对百分含量,结果见表4。
表3 不同诱导组心材直径变化情况表Table 3 The changes of heartwood diameter in different induction groups (s,n=3)

表3 不同诱导组心材直径变化情况表Table 3 The changes of heartwood diameter in different induction groups (s,n=3)
①P<0.01,与空白组比较;②P<0.05,③P<0.01,与生物诱导剂组比较
组别空白对照组阴性对照组青鲜素组甲酸组双氧水组乙酸组噻苯隆组生物诱导剂组1周0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 2个月0.00±0.00③0.00±0.00③0.00±0.00③0.00±0.00③0.00±0.00③0.17±0.29③1.00±0.20①②2.27±0.68①6个月0.00±0.00③0.00±0.00③1.13±1.10②1.60±0.40①③0.00±0.00③2.10±0.36①②3.47±0.31①4.63±0.97①4个月0.00±0.00③0.00±0.00③1.00±1.00③1.30±0.17①③0.00±0.00③1.17±0.12①③2.23±0.25①③3.53±0.31①

图1 不同诱导组心材长度对比Figure 1 Comparison of the heartwood length in different induction groups

图2 不同诱导组心材直径对比Figure 2 Contrast of the heartwood diameter in different induction groups
3 讨论
经外界干预后降香檀植株生长情况与心材形成密切相关,能在短期内形成心材者,都曾不同程度地出现树叶枯黄、脱落,生物诱导剂组甚至可出现细枝枯死、树皮爆裂等现象,短期内可显著影响植株生长,且该组植株心材产量及质量均显著优于其他试验组。
实验中,各不同诱导组所形成心材的长度和直径,组内虽存在一定的差异,但整体趋势趋于一致,唯独青鲜素组出现了较大的偏离现象,其原因可能系因树的个体差异,或青鲜素诱导法所存在的不稳定性。这些结果均在表2和表3的统计数据中得以体现。
表4结果显示,3种样品中均主要含环氧化蛇麻烯、反式-橙花叔醇及β-甜没药烯。生物诱导法诱导降香檀6个月的心材挥发油含反式-橙花叔醇高达50.295%,但此时β-甜没药烯及环氧化蛇麻烯含量仍较低,继续生长6个月后,此两种成分均显著升高,而反式-橙花叔醇相对降低。与对照药材相对比,3种主要成分总相对百分含量并无明显差异。降香植株经生物诱导法诱导后6个月和12个月所形成的心材含油量均已达到国家药典标准,其油中组分结构与对照药材相似。
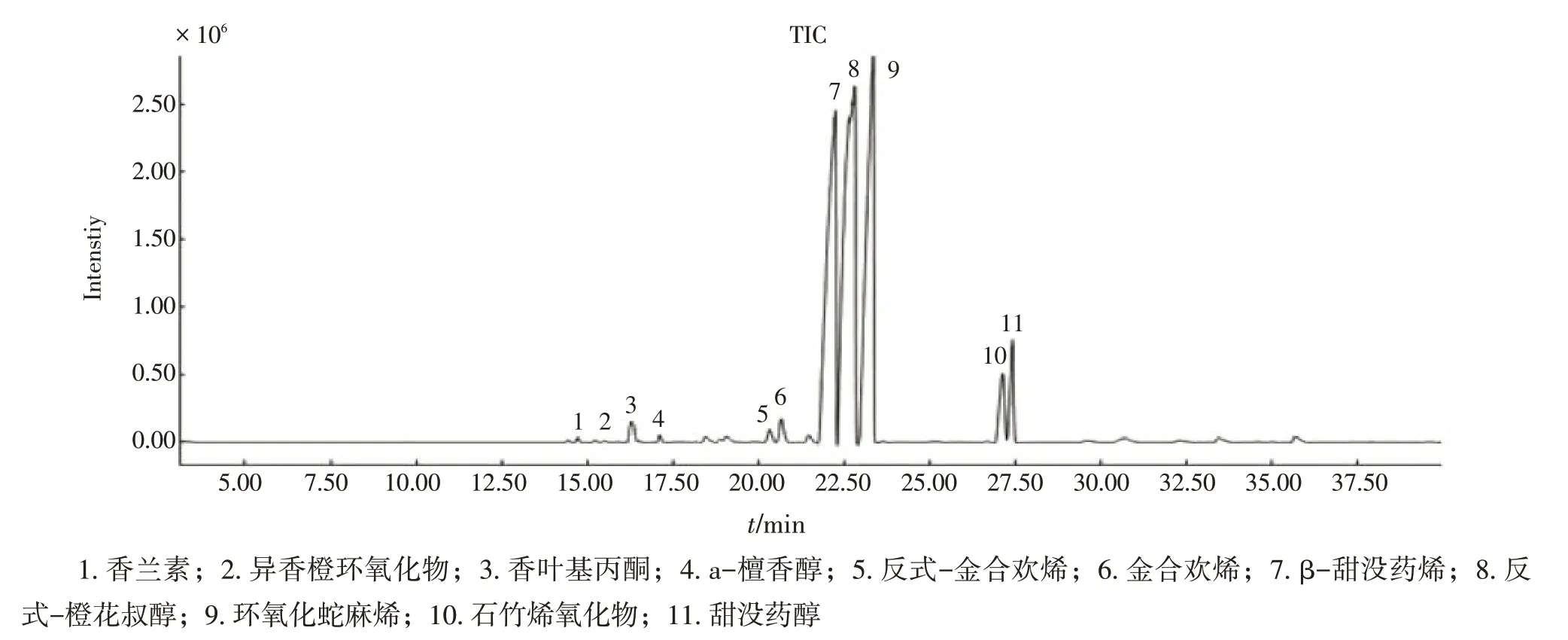
图3 降香油对照品总离子流图Figure 3 Totalion chromatorgram of controlsample of volatile oils from Dalbergia odorifera

表4 各样品挥发油主要组分相对百分含量分析表Table 4 The relative percentage of main components in volatile oils from samples
挥发油成分是降香主要化学成分,其主要含萜烯类物质,其中以橙花叔醇成分为鉴定降香的标志性成分。本研究检测了生物诱导剂诱导后6个月、12个月所形成心材的挥发油含量,并就其挥发油中主要组分种类及相对百分含量,与对照药材进行了比较。诱导后2个月、4个月时,因恐影响树木生长,不便大量采样,而导致样品量不足,故未能检测该时间下的心材质量。
本研究结果表明,与青鲜素、双氧水、乙酸、甲酸、噻苯隆等常用诱导结香液相比,生物诱导剂诱导处理能使降香植株快速形成质量较佳的心材,且所形成心材的区域显著大于其它组,心材物质呈红褐色、质硬、纹理清晰、香气浓烈、油性足,挥发油含量符合《中国药典》要求,值得对生物诱导剂开展进一步深入研究。

