从Kiss1、GPR54 mRNA表达水平探讨过度瘦身对大鼠生殖功能的影响及左归丸的干预作用
高洒洒, 崔晓萍
(1.陕西中医药大学第一临床医学院2016级中医妇科硕士研究生,陕西咸阳 712046;2.陕西中医药大学第一临床医学院中医系,陕西咸阳 712046)
在临床上,我们经常可以看到许多月经量少、月经后期,甚至闭经的患者均处于过度消瘦的状态,询问病史之后,发现其中绝大多数女性经常性进行节食、运动,甚或服用药物以追求减肥。给予相关检查,亦发现这些女性往往都处于卵巢功能下降甚至卵巢早衰的状态,在本该生育的年龄却没有该有的生殖功能,从而引起月经异常,不能生育。现代研究[1]显示,70%的人群处于亚健康状态,其中偏瘦人群占到80%。女性体质量的变化对生殖功能的影响呈现两极化的分布状态,即体质量极高或极低都会使生殖能力下降[2]。临床上大多数消瘦女性月经稀发、月经后期、闭经,甚则不孕[3],一般有2方面原因:一方面,因雌激素受体表达于正常成人的脂肪细胞[4],雌激素与脂肪细胞中的特异性受体结合发生作用[5]。脂肪分为类脂和中性脂肪,类脂分为磷脂和胆固醇,胆固醇是合成甾体激素的前体。过度消耗脂肪使雌激素合成减少,同时导致雌激素与雌激素受体(ER)结合减少,可以导致女性月经量少、月经后期、闭经甚至不孕等症[6]。另一方面,西医学认为女性发育成熟阶段,身高与体质量有一定的比例,若在短期内体质量下降超过正常范围,则会使促性腺激素释放激素(GnRH)的合成与分泌减少,抑制促性腺激素,使性腺功能退减,导致闭经等[7],最终使下丘脑—垂体—卵巢性腺轴(HPOA)失调,导致女性生殖内分泌功能水平下降[7,8]。
目前关于过度瘦身对女性生殖危害的机理尚缺乏具体研究。本研究拟通过运用“半量饮食+过度运动+左旋肉碱”的综合方法造成大鼠过度瘦身模型,将不同时段大鼠下丘脑人吻素1(Kiss1)、G蛋白偶联受体54(GPR54)mRNA表达及血清性激素水平等为切入点,论证过度瘦身对生殖功能的影响,揭示女性盲目追求“骨感美”的错误倾向。同时,对造成过度瘦身状态的大鼠用左归丸进行干预,观察以上各项指标表达的差异,以阐明中医“精血同源”“肾主生殖”“肾生髓充脑”的科学内涵,为中医“补肾促生殖”提供科学依据,为恢复和提升生殖功能提供有效的中医药疗法方案,现将研究结果报道如下。
1 材料与方法
1.1实验动物选用SPF级健康雌性12周龄SD大鼠150只,体质量(250±20)g,购于西安交通大学实验动物中心。动物质量合格证号:SCXK(陕)2018-001。单笼饲养于陕西中医药大学中心实验室,室温20~25℃,相对湿度40%~55%,光照12 h,通风良好,自来水供饮。适应性喂养1周期间,每日上午用电子天平给予定量标准颗粒饲料喂食,测量每只大鼠的正常饮食量(精确到0.1 g),隔日更换垫料并清洗鼠笼。
1.2实验药物左归丸,由北京同仁堂股份有限公司同仁堂制药厂生产,批号:Z11020735;左旋肉碱,由上海麦克林公司生产,批号:L804703。每种药物用量根据人和大鼠体表面积换算的等效剂量比率表计算。左归丸给药剂量为1.62 g·kg-1·d-1,用去离子水配成混悬液。左旋肉碱给药剂量为600 mg·kg-1·d-1,采用等容积不等浓度药液给药,灌胃容积6 mL/kg,用去离子水配左旋肉碱水溶液质量浓度0.1 g/mL。每周末测量大鼠体质量1次,均根据体质量变化调整大鼠给药量。
1.3实验试剂与仪器大鼠促卵泡激素(FSH)酶联免疫吸附分析(ELISA)检测试剂盒(上海优选生物科技有限公司,批号:YX-061908R);大鼠促黄体激素(LH)ELISA检测试剂盒(上海优选生物科技有限公司,批号:YX-120800R);大鼠雌二醇(E2)ELISA检测试剂盒(上海优选生物科技有限公司,批号:YX-050000R);First Strand cDNA synthesis Kit(美国Invitrogen公司,批号:K1622);Quantity Nova SYBR Green PCR Kit(德国Qiagen公司,批号:208052);随机引物(美国Invitrogen公司)。CX21光学显微镜(日本Olympus公司);LDZ4-1.2离心机(北京医用离心机厂);MP-120-2电子天平(上海第二天平仪器厂);低温冰箱(日本Sanyo公司);荧光定量PCR仪(瑞士Roche公司)。
1.4动物分组为了探讨不同瘦身程度对生殖功能损害的差异,分为A组和B组两大组,具体分组如下:150只大鼠适应性喂养1周,每日08:00时应用阴道脱落细胞涂片连续观察10 d,建立大鼠动情周期档案。将动情周期规律的大鼠纳入实验,从中随机抽取10只作为空白A组,10只作为空白B组。剩余大鼠进行跑台运动训练,跑台坡度为0°,每天20 min,第1天跑速为18 m/min,其后跑速每天增加2 m/min,共训练6 d(最终跑速为28 m/min),休息1 d。运动中采用声音刺激或毛刷机械刺激鼠尾部,以使鼠保持持续性运动,在整个运动过程中,未使用电刺激。连续刺激或休息时间过长仍不能维持原强度运动的大鼠不纳入实验。选择能够适应跑台运动训练的60只大鼠随机分为模型A组、模型B组,恢复饮食A组、恢复饮食B组,恢复饮食+左归丸A组、恢复饮食+左归丸B组。
1.5动物造模瘦身方案选择“半量饮食+过度运动+左旋肉碱”的方法。(1)A组分为空白A组、模型A组、恢复饮食A组、恢复饮食+左归丸A组,每组各10只大鼠。第1~4周,除空白A组外其余各组需执行左旋肉碱灌胃、跑台运动(跑台坡度为0°,跑速为28 m/min,20 min/d,运动6 d,休息1 d)、50%日常摄食量。第5~8周恢复饮食A组、恢复饮食+左归丸A组恢复饮食,停止左旋肉碱及跑台运动,同时恢复饮食+左归丸A组给予左归丸干预。(2)B组分为空白B组、模型B组、恢复饮食B组、恢复饮食+左归丸B组,每组各10只大鼠。第1~8周,除空白B组外其余各组需执行左旋肉碱灌胃、跑台运动(同造模A组)、50%日常摄食量。第9~12周恢复饮食B组、恢复饮食+左归丸B组恢复饮食,停止左旋肉碱及跑台运动,同时恢复饮食+左归丸B组给予左归丸干预。
1.6给药方法(1)A组:空白A组(第1~4周,每日08:00时生理盐水灌胃6 mL);模型A组、恢复饮食A组、恢复饮食+左归丸A组(第1~4周,半量饮食+每日运动前半小时左旋肉碱灌胃600 mg/kg,1次/d);恢复饮食A组、恢复饮食+左归丸A组(第5~8周,停止半量饮食、左旋肉碱、过度运动,恢复饮食A组生理盐水灌胃5 mL,恢复饮食+左归丸A组给予左归丸灌胃1.62 g·kg-1·d-1)。(2)B组:空白B组(第1~8周,每日08:00时生理盐水灌胃6 mL);模型B组、恢复饮食B组、恢复饮食+左归丸B组(第1~8周,半量饮食+每日运动前半小时左旋肉碱灌胃600 mg/kg,1次/d);恢复饮食B组、恢复饮食+左归丸B组(第9~12周,停止半量饮食、左旋肉碱、过度运动,恢复饮食B组生理盐水灌胃5 mL,恢复饮食+左归丸B组左归丸灌胃1.62 g·kg-1·d-1)。
1.7观察指标与方法
1.7.1 大鼠一般状态及体质量观察 每日08:00、12:00、18:00时详细观察并记录每只大鼠造模及用药前后饮食状况、毛色光泽、精神状态、活动度、大小便等情况。于大鼠运动休息日08:00时用电子天平称取并记录大鼠空腹体质量,对比瘦身前后、瘦身后恢复饮食以及药物干预后大鼠的空腹体质量变化。
1.7.2 大鼠阴道上皮脱落细胞涂片观察 固定大鼠,暴露其下腹部,将制作的纤细棉签用生理盐水湿润后轻轻插入大鼠阴道约0.5 cm,顺时针转动1周后取出阴道脱落细胞。将取出的带有大鼠阴道脱落细胞的棉签在载玻片上逆时针转动1周,制成涂片,编号并自然晾干。晾干的涂片于95%乙醇固定10 min→苏木素染色5 min→自来水冲洗→1%盐酸分化5 s→自来水冲洗→1%伊红染色2 min→自来水冲洗。经70%乙醇→80%乙醇→90%乙醇→100%乙醇梯度脱水→二甲苯Ⅰ透明5 min→二甲苯Ⅱ透明5 min→自然晾干,光镜下观察。实验期间每日08:00时行大鼠阴道上皮脱落细胞涂片观察,在普通光学显微镜下观察各细胞形态及数目以确定大鼠所处的动情周期阶段。光镜下观察成熟角化细胞百分比,以每200个脱落细胞中成熟角化细胞的数目所占百分比计算角化细胞指数,比较同一动情时期的角化指数。
1.7.3 大鼠血清FSH、LH、E2含量测定 大鼠禁食禁饮12 h,电子天平测量并记录体质量,实验器材高温消毒干燥,10%水合氯醛(剂量0.3 mL/100 g)腹腔注射麻醉大鼠。麻醉生效后,首先固定头部以及四肢,下腹部剃毛并常规消毒,立即腹主动脉取血约5 mL,静置30 min后,以转速为3 000 r/min离心20 min后,用枪头吸取上清液,置于-20℃以下冰箱保存,送陕西中医药大学第一附属医院检验中心进行各项性激素的检测。
1.7.4 下丘脑Kiss1及GPR54 mRNA测定 大鼠采血后,迅速分离并摘取下丘脑组织,将其置入RNA保存液中,于-80℃冰箱冻存,用于荧光定量逆转录聚合酶链反应(qRT-PCR)法进行mRNA的检测。具体方法:(1)抽提总RNA,测吸光度[D(260)],并定量。(2)逆转录:①按下列顺序在200μL PCR管中加入下列反应物(体积为12μL):DEPC水(10-x)μL;随机引物/Oligo dT(50 pM/μL)2μL;RNA xμL(2μg);②放置于PCR仪中,65℃处理5 min;③立即冰浴,高速(高于5 000 g)离心5 s;④按下列顺序在PCR管加入下列反应物(加入之后总体积为20μL):RNA酶抑制剂(50 U/μL)1μL;5×buffer 4μL;dNTP MIX(10 mmol/L)2μL;RevertAid M-MuLV RT(200 U/μL)1μL;⑤混匀后,25℃,5 min,42℃,60 min(对于GC含量比较高的样本,可以将温度提高到45℃);⑥70℃,处理5 min;⑦高速(高于5 000 g)离心5 s。-20℃保存。(3)荧光定量PCR扩增:①序列与引物,序列参照Gene Bank数据库中各目的基因的序列。见表1。②PCR反应体系(10μL):H2O 1.5μL;2×SYBGEEN PCR mix-5μL;Primer(10 pM/μL)/Primer(10 pM/μL)1μL;Template(反转录产物,也即cDNA)2.5μL。③反应条件:95℃,2 min;95℃,5 s;60℃,10 s。45个循环。熔解曲线。实验结果说明:所有的数值先与内参做了△Ct,然后用第1个样品做相对含量(p)=2-△△Ct分析。
1.8统计方法应用SPSS 25.0统计软件进行数据分析。计量资料以均数±标准差()表示,多组比较采用单因素方差分析,组间比较采用独立样本t检验。造模以及后期干预后动情周期观察数据多组的比较采用卡方检验。以P<0.05为差异有统计学意义。
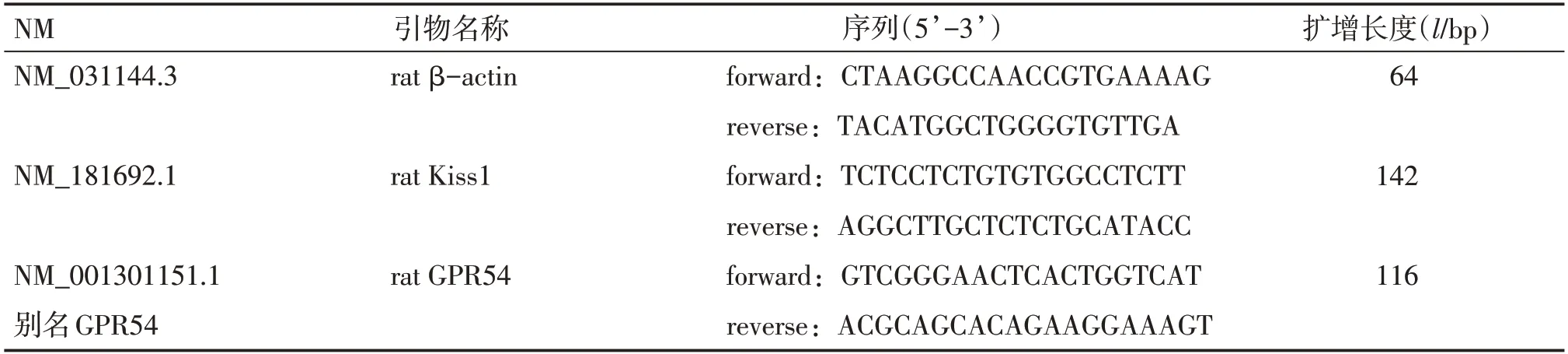
表1 PCR引物序列Table 1 PCR primer sequences
2 结果
2.1各组大鼠一般状态观察空白A、B组大鼠体态适中,毛发稠密,色泽正常,行动灵活,反应灵敏,大小便正常。模型A、B组大鼠体质量下降,眼窝凹陷,精神不振,活动减少,反应迟钝,烦躁不安,竖毛,拱背,易惊,怕人,体毛粗糙无光泽,心率加快,体温升高,对疼痛敏感等,且造模8周较造模4周大鼠一般状态更差。恢复饮食A、B组与恢复饮食+左归丸A、B组大鼠的一般状态较同组模型组改善,且造模8周大鼠一般状态恢复情况较造模4周大鼠恢复情况差。
2.2过度瘦身对大鼠体质量的影响及左归丸干预作用表2结果显示:造模前各组大鼠体质量比较,差异无统计学意义(P>0.05)。干预后,与同组空白组比较,模型A、B组大鼠体质量明显下降(P<0.01);与同组模型组比较,恢复饮食A、B组大鼠体质量均明显升高(P<0.01);与同组恢复饮食组比较,恢复饮食+左归丸A组大鼠体质量升高(P<0.05),恢复饮食+左归丸B组大鼠体质量无明显变化。
研究结果分析:通过“半量饮食+跑台运动+左旋肉碱”的方法可以导致大鼠体质量逐渐下降。造模4周时,大鼠体质量较原始值下降了17%,较空白组下降了26%。造模8周时,大鼠体质量较原始值下降了23%,较空白组下降了35%。即造模8周大鼠体质量较造模4周更低。给予恢复饮食后,造模4周大鼠体质量恢复至空白组的98%,左归丸干预后体质量恢复更明显;造模8周大鼠体质量恢复为空白组的83%,左归丸干预后体质量恢复不明显。造模8周大鼠体质量比造模4周恢复情况差,可能与生殖功能损害程度有关,亦可能与恢复饮食及恢复饮食+左归丸干预时长有关。
表2 过度瘦身对大鼠体质量的影响及左归丸干预作用Table 2 The effect of excessive weight loss on reproductive function of rats and the intervention actions of Pills (s,m/g)
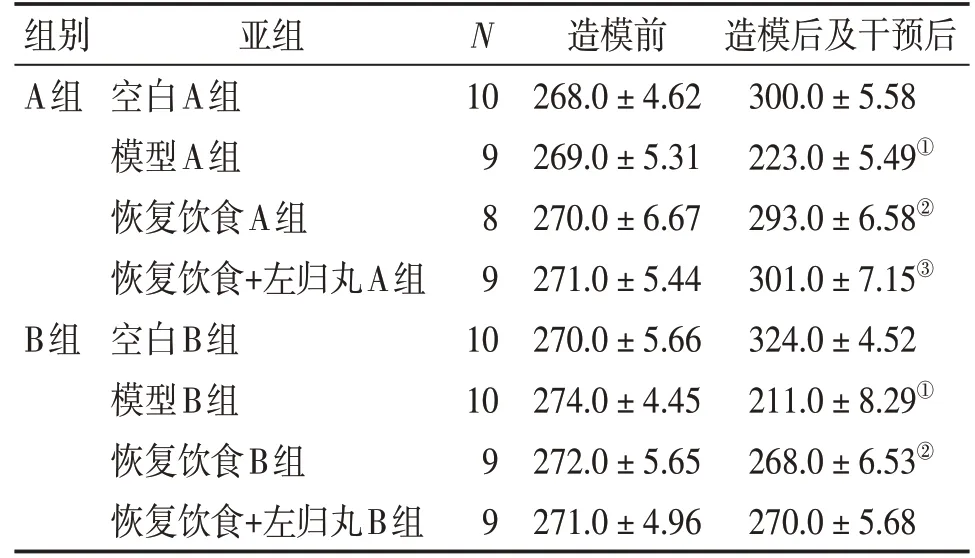
表2 过度瘦身对大鼠体质量的影响及左归丸干预作用Table 2 The effect of excessive weight loss on reproductive function of rats and the intervention actions of Pills (s,m/g)
①P<0.01,与同组空白组比较;②P<0.01,与同组模型组比较;③P<0.05,与同组恢复饮食组比较
造模后及干预后300.0±5.58 223.0±5.49①293.0±6.58②301.0±7.15③324.0±4.52 211.0±8.29①268.0±6.53②270.0±5.68组别A组N 10 9 8 9 B组亚组空白A组模型A组恢复饮食A组恢复饮食+左归丸A组空白B组模型B组恢复饮食B组恢复饮食+左归丸B组10 10 9 9造模前268.0±4.62 269.0±5.31 270.0±6.67 271.0±5.44 270.0±5.66 274.0±4.45 272.0±5.65 271.0±4.96
2.3过度瘦身对大鼠动情周期的影响及左归丸干预作用大鼠动情周期各期阴道上皮脱落细胞形态如图1所示。动情前期:大量上皮细胞,胞浆呈粒状,少量角化(无核)细胞,无白细胞;动情期:大量角化细胞,形状大而不规则,尚有少量上皮细胞;动情后期:大量多核白细胞,尚有融合的角化细胞;动情间期:大量多核白细胞,少量上皮细胞。
表3结果显示:恢复饮食A组动情周期规律的大鼠数量较模型A组升高(P<0.05);恢复饮食+左归丸A组动情周期规律的大鼠数量较模型A组明显升高(P<0.01)。其余各组之间动情周期规律比较,差异无统计学意义(P>0.05)。
2.4过度瘦身对大鼠血清FSH、LH、E2水平的影响及左归丸干预作用表4结果显示:与同组空白组比较,模型A、B组FSH、LH水平均明显升高,E2水平均明显下降(P<0.01)。与同组模型组比较,恢复饮食A、B组FSH、LH水平均明显下降,E2水平明显升高(P<0.01)。与同组恢复饮食组比较,恢复饮食+左归丸A组的FSH、LH明显下降(P<0.01),E2水平升高(P<0.05),恢复饮食+左归丸B组FSH、LH较前稍有降低,E2水平稍有提高,但差异无统计学意义(P>0.05)。A、B组对应组别之间比较,A组FSH、LH水平明显低于B组(P<0.01)。模型B组E2水平较模型A组降低,但差异无统计学意义(P>0.05);其余A、B组对应组别之间比较,B组E2水平明显低于A组(P<0.01)。
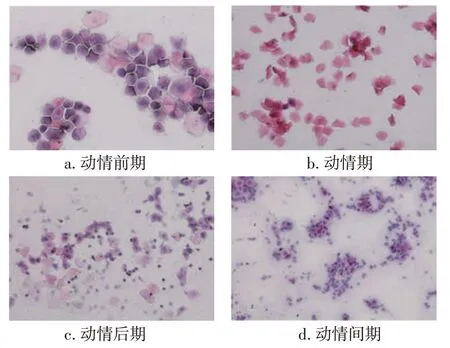
图1 大鼠阴道上皮脱落细胞涂片观察结果(×20)Figure 1 The smear result of exfoliative cells in vaginal epithelium(×20)
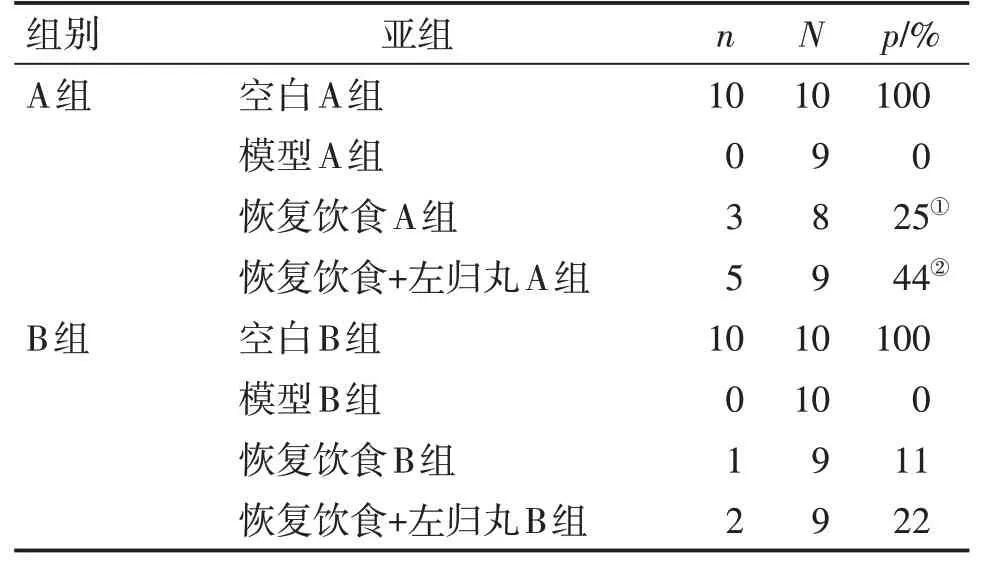
表3 过度瘦身对大鼠动情周期的影响及左归丸干预作用Table 3 The effect of excessive weight loss on regular estrus cycle of the rats and the intervention actions of Zuogui Pills
表4 过度瘦身对大鼠血清FSH、LH、E2水平的影响及左归丸干预作用Table 4 The effect of excessive weight loss on rat serum contents of FSH,LH and E2 and the intervention actions of Zuogui Pills
表4 过度瘦身对大鼠血清FSH、LH、E2水平的影响及左归丸干预作用Table 4 The effect of excessive weight loss on rat serum contents of FSH,LH and E2 and the intervention actions of Zuogui Pills
①P<0.01,与同组空白组比较;②P<0.01,与同组模型组比较;③P<0.05,④P<0.01,与同组恢复饮食组比较
组别A组N 10 9 8 9 B组E2[ρ/(pg·mL-1)]93.02±6.77 40.94±5.38①75.21±4.92②85.79±5.29③98.68±2.64 38.51±5.16①52.88±6.15②55.91±5.90亚组空白A组模型A组恢复饮食A组恢复饮食+左归丸A组空白B组模型B组恢复饮食B组恢复饮食+左归丸B组10 10 9 9 FSH[J/(mIU·mL-1)]16.14±1.54 30.34±1.29①24.06±1.68②20.27±1.05④15.94±1.13 41.23±1.27①39.45±1.44②39.12±1.39 LH[J/(mIU·mL-1)]13.01±1.08 20.25±1.67①17.02±1.74②15.21±1.13④13.37±1.25 23.09±1.56①19.89±1.66②19.73±1.41
研究结果表明:①过度瘦身模型可显著提高大鼠血清FSH、LH水平,同时降低E2水平,与临床上瘦身致卵巢功能下降患者出现高促性腺激素和低雌激素一致;②通过各期实验组内比较:给予恢复饮食、左归丸干预后,可在一定程度上使FSH、LH下降,E2升高;恢复饮食+左归丸干预较单纯恢复饮食对生殖功能恢复有明显优势;③通过两部分实验组间比较:给予恢复饮食、左归丸干预后,4周生殖功能恢复情况较8周有显著优势。
2.5过度瘦身对大鼠下丘脑Kiss1及GPR54 mRNA表达的影响及左归丸干预作用图2、3 Kiss1、GPR54 mRNA熔解曲线、扩增曲线表明扩增产物特异性良好。表5结果显示:模型A、B组大鼠Kiss1的表达水平较同组空白组显著降低(P<0.05或P<0.01);恢复饮食A组大鼠Kiss1的表达水平较模型A组显著上升(P<0.01);与恢复饮食A组比较,恢复饮食+左归丸A组大鼠Kiss1表达显著升高(P<0.01);恢复饮食B组大鼠Kiss1表达与模型B组比较,差异无统计学意义(P>0.05);恢复饮食+左归丸B组大鼠Kiss1表达水平与恢复饮食B组大鼠比较,差异无统计学意义(P>0.05)。造模8周各对应组与造模4周比较,Kiss1的表达水平均显著下降(P<0.01)。
图2 下丘脑Kiss1的荧光定量PCR熔解曲线(A)及扩增曲线(B)Figure 2 Fluorescence quantitative PCR melt curve and amplifying curve of Kiss1 in rat hypothalamus
图3 下丘脑GPR54 mRNA的荧光定量PCR熔解曲线(A)及扩增曲线(B)Figure 3 Fluorescence quantitative PCR melt curve and amplifying curve of GPR54 in rat hypothalamus
模型A、B组较同组空白组大鼠GPR54 mRNA表达显著降低(P<0.01);恢复饮食A组较模型A组大鼠GPR54 mRNA表达水平显著上升(P<0.01);与恢复饮食A组比较,恢复饮食+左归丸A组大鼠GPR54 mRNA的表达水平明显升高(P<0.01);恢复饮食B组大鼠GPR54 mRNA表达水平与模型B组比较,差异无统计学意义(P>0.05);与恢复饮食B组比较,恢复饮食+左归丸B组GPR54 mRNA的表达水平无明显变化(P>0.05)。B组各对应组大鼠GPR54 mRNA表达水平较A组明显下降(P<0.01)。
结果分析:①通过各实验组内比较:A、B模型组大鼠下丘脑Kiss1及GPR54 mRNA表达均较空白组明显下降,恢复饮食及恢复饮食+左归丸都可提高大鼠下丘脑Kiss1及GPR54 mRNA的表达量,尤以结合左归丸效果更佳。②通过两部分实验组间比较:造模8周Kiss1及GPR54 mRNA降低情况较造模4周显著;给予恢复饮食、左归丸干预后,造模8周Kiss1及GPR54mRNA升高情况较造模4周缓慢。恢复饮食+左归丸干预较单纯恢复饮食效果好。
表5 过度瘦身对大鼠下丘脑Kiss1、GPR54 mRNA表达的影响及左归丸干预作用Table 5 The effect of excessive weight loss on the mRNA expression levels of Kiss1 and GPR54 in rat hypothalamus and the intervention actions of Zuogui Pills (s,p)
表5 过度瘦身对大鼠下丘脑Kiss1、GPR54 mRNA表达的影响及左归丸干预作用Table 5 The effect of excessive weight loss on the mRNA expression levels of Kiss1 and GPR54 in rat hypothalamus and the intervention actions of Zuogui Pills (s,p)
①P<0.05,②P<0.01,与同组空白组比较;③P<0.01,与模型A组比较;④P<0.01,与恢复饮食A组比较;⑤P<0.01,与恢复饮食+左归丸A组比较
GPR54 mRNA 0.993 0.307②0.499③0.632④0.902 0.181②③0.182④0.183⑤组别A组N 10 9 8 9 B组亚组空白A组模型A组恢复饮食A组恢复饮食+左归丸A组空白B组模型B组恢复饮食B组恢复饮食+左归丸B组10 10 9 9 Kiss1 mRNA 1.002 0.42①0.55③0.58④0.955 0.278②③0.282④0.283⑤
3 讨论
3.1半量饮食+跑台运动+左旋肉碱灌胃造成大鼠过度消瘦状态左旋肉碱[9]是食物的组成成分,主要作用是参与体内脂肪代谢,作为载体来促进脂肪酸的β氧化,从而调节脂肪生物代谢[10]。20世纪70年代已有左旋肉碱用于治疗肥胖症的报道[11]。研究[12]说明,左旋肉碱能够提高运动对肥胖和超重者的促脂肪代谢作用,有效地增加运动的降重减脂效果。目前国内减肥药大多以左旋肉碱为主要成分,本研究选用“半量饮食+跑台运动+左旋肉碱”综合方法造成大鼠消瘦状态。结果显示,大鼠瘦身前后体质量变化明显,造模8周较造模4周体质量下降程度更大,且恢复饮食及药物干预后,造模8周较造模4周大鼠体质量恢复情况差。
3.2过度瘦身可导致生殖功能下降下丘脑、垂体与卵巢之间相互调节、相互影响,形成完整而又协调的神经内分泌系统,即HPOA[13],直接影响女性的生殖功能,其中任何一个环节发生功能失调或病变时都有可能导致女性排卵障碍、性激素分泌异常。当体内脂肪比重降至17%时,就会发生月经周期紊乱、性欲明显减退、不孕[14]。生活中越来越多的女性采用控制饮食或服用减肥药达到瘦身目的,通过影响神经内分泌通路和改变生殖激素代谢率导致HPOA功能紊乱,从而影响女性生殖功能[15]。系列研究[16-19]表明,过度瘦身导致的营养不良严重影响了HPOA功能。临床上常见神经性厌食症女性随着体质量的下降出现月经紊乱、不孕等疾病,体质量降至正常体质量70%以下时会出现下丘脑性闭经。下丘脑是HPOA的启动中心,由下丘脑弓状核神经细胞分泌的GnRH通过调节垂体释放促性腺激素,促性腺激素细胞分泌FSH和LH,进而作用于卵巢,促使卵巢卵泡生长和成熟,产生雌、孕激素,维持女性生理功能。Kisspeptin是由Kiss1基因编码[20]在2001年被发现的一种肽类激素。GPR54属G蛋白欧联受体[21],是Kisspeptin的受体。免疫组织化学检测证实Kisspeptin主要分布于大鼠下丘脑弓状核等部位[22]。研究[23]发现Kisspeptin与GPR54结合后能促进GnRH释放,同时Kisspeptin可以介导E2的正负反馈,调节GnRH的分泌及HPOA,最终达到调节女性生殖功能的作用。
本研究通过造成大鼠过度瘦身模型,模拟人的消瘦状态,通过观察大鼠一般状态、体质量、血清性激素含量、下丘脑Kiss1及GPR54 mRNA表达水平来评价大鼠实验前后的生殖功能变化,后期给予恢复饮食及左归丸干预,检测大鼠生殖功能有无变化。结果显示:当体质量较原始值下降17%,较空白组下降26%时,大鼠生殖功能已损害。当体质量较原始值下降23%,较空白组下降35%时,大鼠生殖功能损害程度更大,甚至呈卵巢早衰状态;模型大鼠血清FSH、LH水平显著升高,同时E2水平降低;模型组大鼠下丘脑Kiss1及GPR54 mRNA表达均明显下降。说明过度瘦身可以导致下丘脑功能明显下降,Kiss1及GPR54 mRNA表达水平下调,从而抑制垂体分泌及释放FSH、LH,进而导致卵巢功能降低。临床上我们常见到过度消瘦的女性月经异常,甚至闭经,其生殖功能低于本年龄阶段该有的水平。因此,本研究目的之一即是告诫女性不要盲目追求“骨感美”,从而影响自身健康,特别是对生殖功能的危害。
左归丸为补益肾精的经典方剂。有研究证实左归丸可以通过增加大鼠卵巢、子宫肌层血管数目及卵巢、子宫肌层血管密度和管腔内径,来提高卵巢局部血循和子宫血运[24]。朱玲等[25,26]发现,左归丸可以从免疫平衡调节、性腺轴调节、卵泡凋亡等方面改善生殖功能。本研究选用左归丸为干预中药,观察其对过度瘦身造成的阴血亏虚状态的影响。结果显示:给予恢复饮食后,造模4周大鼠体质量恢复为空白组的98%,卵巢功能恢复明显,且结合左归丸效果更佳;造模8周大鼠体质量恢复为空白组的83%,生殖功能恢复不明显,且结合左归丸效果不明显;恢复饮食可使模型大鼠体内FSH、LH水平下降,E2水平升高;恢复饮食及恢复饮食+左归丸都可提高模型大鼠下丘脑Kiss1及GPR54 mRNA的表达量,尤以结合左归丸效果更佳。给予恢复饮食及左归丸干预后,造模4周较造模8周大鼠卵巢功能恢复更明显,且结合左归丸效果更佳;造模8周大鼠卵巢功能恢复不明显,可能与卵巢受损程度有关,亦或与恢复饮食及药物干预时长有关。说明左归丸可以通过补肾填精逆转下降的生殖功能,证明了中医“精血同源、肾主生殖、肾生髓充脑”的科学内涵,可为中医逆转卵巢早衰的作用机制和恢复卵巢功能提供物质基础,为临床防治卵巢早衰提供有效方案,为中药抗卵巢早衰提供科学依据。
综上所述,当体质量较原始值下降17%时,大鼠生殖功能已明显损害。当体质量较原始值下降23%时,大鼠生殖功能损害程度更大,甚至呈卵巢早衰状态。早期阶段,给予恢复饮食及左归丸可以一定程度逆转卵巢功能。造模时间越长,大鼠卵巢功能越低下,干预后恢复程度越小。说明如果过度瘦身,即体质量丧失越多,卵巢功能则越低下。因此,强烈呼吁广大女性在爱美的同时,注意保护身体健康,尤其是要保护女性生殖功能,不要盲目地瘦身,追求骨感形体,最终导致生殖功能的损害。

