Fe掺杂g-C3N4光催化剂的制备及光催化性能研究
曹雪娟,单柏林,邓 梅,唐伯明
(1. 重庆交通大学 土木工程学院,重庆 400074;2. 重庆交通大学 材料科学与工程学院,重庆 400074)
0 引 言
随着经济快速发展,人类赖以生存的环境正遭受着越来越严重污染,氮氧化物(NOX)和硫化物在空气中的排放已经成为主要的环境问题。除火山喷发、有机物分解等自然过程外,机动车尾气排放占到60%以上,这些污染气体除了会引起酸雨、光化学烟雾等环境问题外,还严重威胁着人类的身体健康。氮氧化物(NOX)和硫化物可被紫外线分解,但分解速度慢,对污染物净化效果有限。因此需要寻找一种更为有效的汽车尾气降解净化方式[1-3]。
近年来,半导体光催化技术作为一种新兴的环保技术受到大量关注[4-5],越来越多的光催化剂被应用于道路中降解污染气体,但光催化剂自身低降解速率影响了其实际应用。自1989年发现氮化碳起,g-C3N4因其易制备、无害、具有较好稳定性及优异的可见光响应特性被广泛应用于光催化领域[6]。但g-C3N4的窄禁带宽度,可见光利用率低、光生载流子复合率高等缺点限制了其实际应用[7-8]。研究者常采用掺杂金属/非金属元素、调控g-C3N4半导体能带结构、软/硬模板法优化g-C3N4纳米结构、表面化学修饰g-C3N4等方法提高其光生载流子的分离效率以及抑制空穴电子对的复合[9-12]。金属离子掺杂是指利用物理或化学方式将过渡金属元素引入g-C3N4晶格,由于过渡金属元素外层电子不饱和,其可捕获g-C3N4导带中电子,降低空穴与电子复合概率,提高g-C3N4的光催化活性[13]。GE Lei等[14]采用溶剂法制备了掺Ag-C3N4,试验表明当Ag负载量为1%时,其光解水制氢速率为纯g-C3N4的11倍。ZHANG Weibin等[15]采用理论计算和试验研究方法对掺杂金属元素的Mn/g-C3N4模型进行分析,研究表明Mn掺入后可有效提高g-C3N4的光催化活性。
笔者以金属元素Fe对g-C3N4进行改性,将NO作为目标污染物对其进行降解,研究了Fe掺量对光催化活性的影响。结合微观试验,研究了Fe掺入对g-C3N4晶体结构和光学性质影响,最后采用分散液喷涂法将Fe-C3N4应用于沥青试件,并测试了其在路面上的光催化活性。
1 试验部分
1.1 主要试剂
主要试剂为:三聚氰胺、九水硝酸铁、正硅酸乙酯、乙醇、三乙胺均为分析纯试剂,水为超纯水。
1.2 表征方法
所制备得到的样品采用X 射线粉末衍射仪(丹东通达科技公司)分析物相,确定晶体结构,设定扫描速率10°/min,扫描角度10°~80°;用傅里叶红外光谱仪(布鲁克光谱仪器公司)分析样品原子间键合情况,设定扫描范围400~4 000 cm-1;用紫外-可见分光光度计(UV1800型)分析样品的光吸收性能,光谱扫描范围为200~800 nm,扫描速度设定200 nm/min;用荧光分光光度计(F-380型)分析样品光生-空穴电子复合情况,激发波长370 nm,扫描速率200 nm/min;用冷场发射扫描电镜(日本日立仪器公司)观察样品表面形貌;用Thermo 氮氧化物分析仪(美国 Thermo Fisher Scientific公司)记录光催化反应前后NO气体浓度。
1.3 光催化剂制备
1.3.1 g-C3N4制备
称取一定量的三聚氰胺放入坩埚中,将坩埚放入马弗炉中煅烧,550 ℃下煅烧3 h,设定升温速率为10 ℃/min。将所得淡黄色产物磨成粉末即得g-C3N4。
1.3.2 Fe-C3N4制备
取适量的三聚氰胺溶于去离子水,再加入不同摩尔含量比例的九水硝酸铁,搅拌均匀后放入85 ℃烘箱中干燥。将烘干后的混合物置于坩埚中放入马弗炉煅烧,在550 ℃下煅烧3 h,设定升温速率为10 ℃/min,冷却后取出,将所得产物研磨成粉即得到不同掺量下的x%Fe-C3N4光催化剂。
1.3.3 Fe-C3N4分散液制备
选用硅溶胶为分散介质,首先用正硅酸乙酯、三乙胺和乙醇制备硅溶胶,用去离子水稀释硅含量为0.5%。将Fe-C3N4加入到硅溶胶中500 r/min磁力搅拌10 min,再超声处理15 min制备出高分散性和稳定性分散液。其中Fe-C3N4的掺量为1%、1.5%、2%(以硅溶胶总量计)。最后利用喷枪将分散液喷涂于沥青试件(AC-13沥青马歇尔试件)表面。
1.4 光催化性能表征
笔者以汽车尾气中主要成分之一NO为目标污染物,用氮氧化物分析仪记录光催化反应前后NO的浓度,以评价光催化活性。试验装置由NO气瓶,金属卤化灯,气体质量流量计,光催化反应箱及Thermo氮氧化物分析仪组成。
取适量光催化剂放入烧杯中,加水搅拌溶解后超声分散15 min。将超声分散后的溶液平铺倒入表面皿后放入80 ℃烘箱中烘干,最后将被光催化剂覆盖的表面皿放入测试装置箱体中,打开NO气瓶通气,调节经过材料表面的NO浓度为1 000 ppb,通气速率稳定后,开灯,记录30 min内NO气体浓度变化情况。以光催化反应前后NO浓度来评价光催化剂的光催化活性,NO降解率计算如式(1):
(1)
式中:η为30 min的光催化降解率;C0为NO的初始浓度;C1为30 min后NO的最终浓度。
2 试验结果分析
2.1 光催化活性评价结果
图1为g-C3N4和不同掺量x%Fe-C3N4试样在开灯照射30 min内对NO气体降解情况。
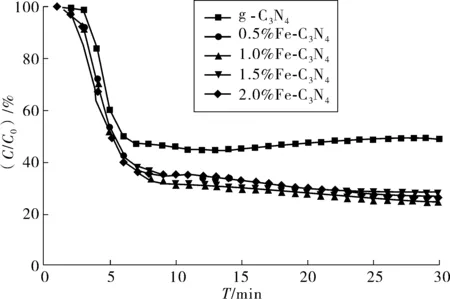
图1 g-C3N4和x%Fe-C3N4光催化剂对NO降解效果Fig. 1 NO degradation effect of photocatalyst g-C3N4 and Fe-C3N4
由图1可知:在相同测试条件下,Fe-C3N4对NO降解效率明显高于g-C3N4,且随Fe掺入量增加,其对NO降解率逐渐增大。当掺量为1%时,其对NO降解率达到最大值,为75.43%,当继续增大Fe掺量,其降解率反而降低,但其降解率仍大于纯g-C3N4(50.78%)。
g-C3N4光催化活性取决于其光生电子-空穴对的氧化还原反应,在反应过程中会产生强氧化性的羟基(·OH-),过氧根自由基(·O2-)和空穴(h+),当NO接触到这些强氧化离子时,会被氧化为硝酸根离子(NO3-),将污染物转换成易去除的硝酸盐[16-17]。因此,如何降低其光生电子-空穴对的复合概率是提升其光催化反应关键。
Fe3+属于过渡金属元素,其最外层电子结构为3s23p63d5,具有不饱和特性,在掺杂过程中g-C3N4导带中电子可被Fe3+捕获,这就降低了g-C3N4光生-空穴电子对的复合概率,使更多的光生-空穴电子对参与光催化反应,因此掺Fe后g-C3N4的光催化活性更好[18-19]。但当Fe掺量过多时,g-C3N4中捕获位之间的距离会降低,反而会成为空穴和电子复合中心,电子和空穴复合概率变大,此外当掺量过大时,还会使Fe3+难以掺入g-C3N4晶格中,会附着在晶体表面,占据活性位点,反而不利于光催化活性提高。
2.2 光学性能分析
图2为g-C3N4和1%Fe-C3N4光催化剂的紫外-漫反射光谱图。
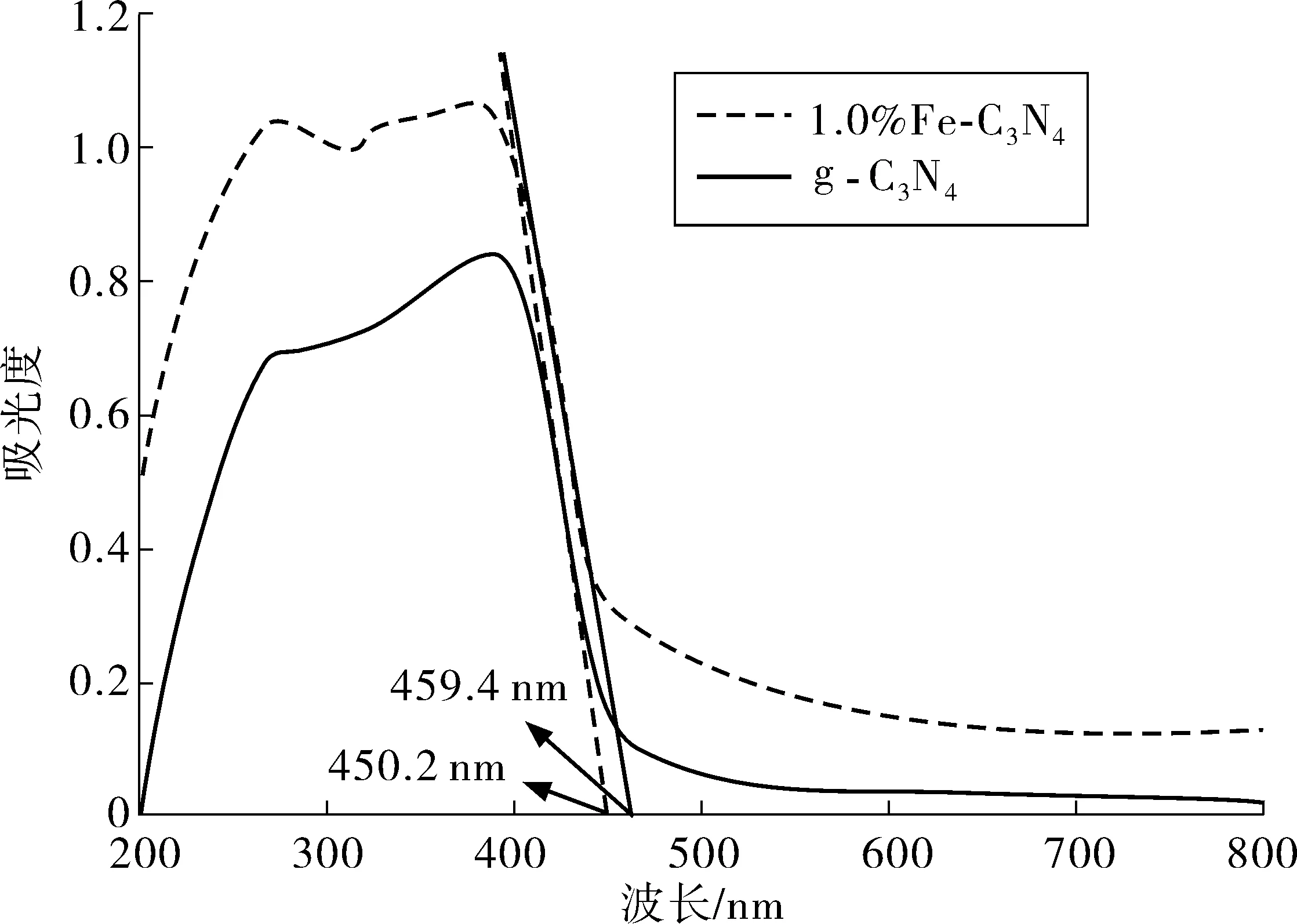
图2 g-C3N4和1%Fe-C3N4的UV-Vis光谱图Fig. 2 UV-Vis spectrogram of g-C3N4 and 1% Fe-C3N4
由图2可知:在可见光范围内(380~780 nm),Fe-C3N4对可见光吸收明显高于g-C3N4,Fe-C3N4出现了明显红移,这说明Fe掺入拓宽了g-C3N4吸收波长范围,采用截线法计算出g-C3N4和1%Fe-C3N4的吸收阈值λg,分别为450.2、459.4 nm。利用Eg=s1 240/λg计算出g-C3N4和1%Fe-C3N4的禁带宽度Eg,分别为2.75、2.70 eV,这说明Fe掺入后改变了能带结构,降低了g-C3N4带隙能,使其禁带宽度变窄[20]。根据能级理论推测,Fe掺入后在g-C3N4禁带中形成杂质能级,电子只需吸收能量较小的光子就可实现能级的间接跃迁,这样就可吸收波长较长的光子,从而拓宽了g-C3N4对可见光吸收,提高g-C3N4对可见光的利用率。
为探究Fe掺入对g-C3N4中光生载流子的复合和分离情况。选用激发波长为370 nm的荧光光源激发g-C3N4和Fe-C3N4。图3为g-C3N4和1%Fe-C3N4荧光发射光谱图。
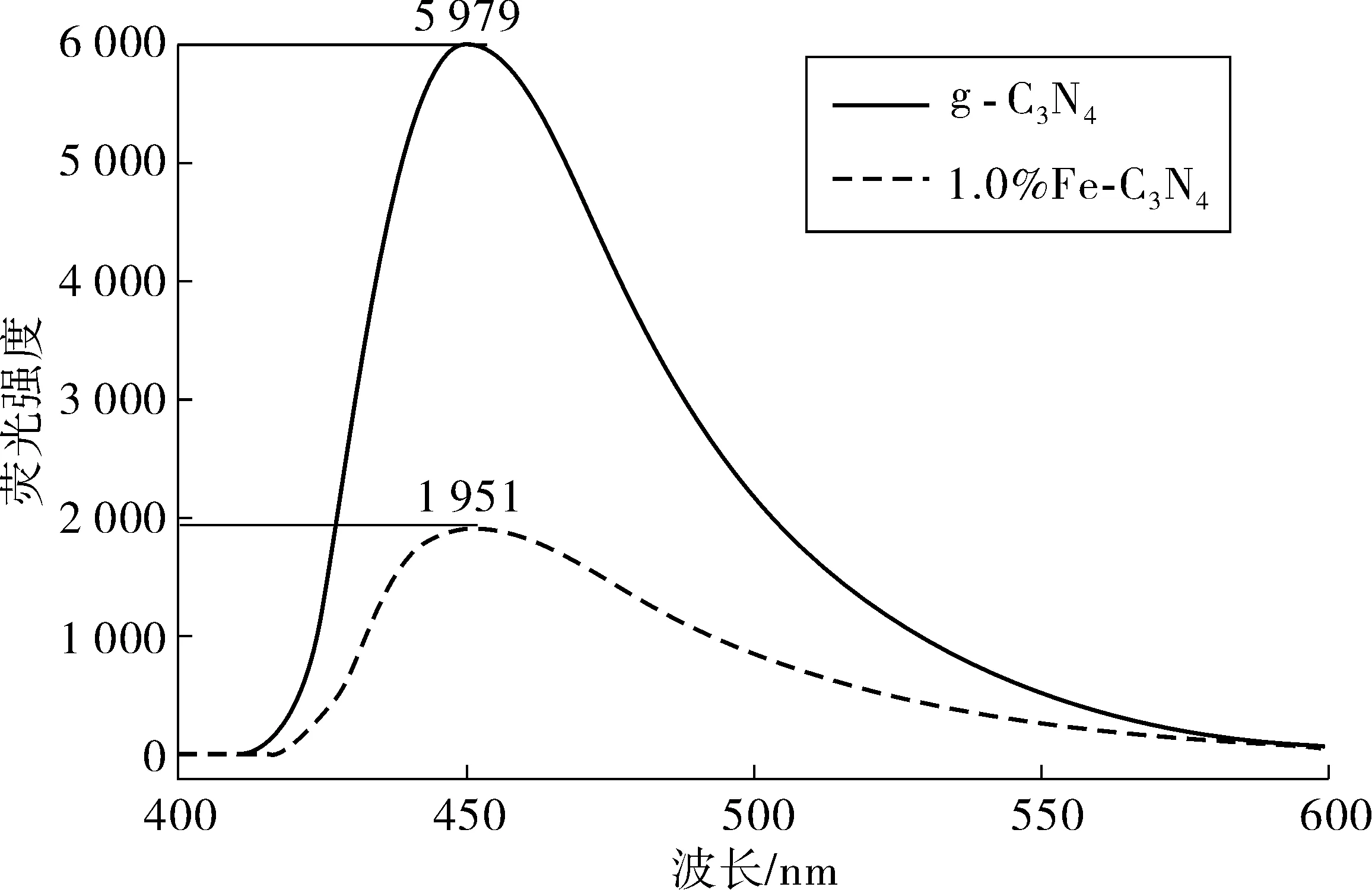
图3 g-C3N4和1%Fe-C3N4的PL光谱图Fig. 3 PL spectrogram of g-C3N4 and 1% Fe-C3N4
由图3可看出:g-C3N4和1%Fe-C3N4荧光光谱大致相同,但g-C3N4荧光强度要远大于1%Fe- C3N4,这说明在相同激发波长下,1%Fe-C3N4电子-空穴的复合速率要远小于g-C3N4,这表明Fe掺入后g-C3N4光生电子和空穴的复合概率被减弱。从图3中还可观察到:Fe掺入后没有出现新的波峰,这表明Fe掺杂并未引起新的荧光发光现象,只是影响了荧光光谱响应范围和宽度。
2.3 微观结构表征
图4为g-C3N4与不同掺量Fe-C3N4的XRD图谱。
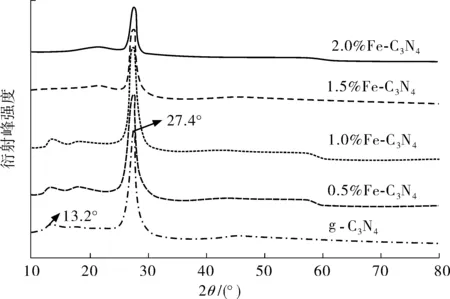
图4 g-C3N4和x%Fe-C3N4光催化剂的XRD图谱Fig. 4 XRD spectrogram of g-C3N4 and x% Fe-C3N4
由图4可知:Fe掺入后Fe-C3N4的特征衍射峰与g-C3N4特征衍射峰的位置大致相同,分别位于2θ=13.2°、27.4°处,这说明Fe掺杂没有改变g-C3N4类石墨层状的晶体结构[21]。随着Fe掺量增加,Fe-C3N4的两个衍射峰由尖锐变得逐渐温和,且强度也不断降低,表明样品晶粒结晶度随着Fe掺量增大而变小,推测是在煅烧过程中Fe的掺入使得g-C3N4产生不同程度缩聚,延缓了晶相转变过程,导致g-C3N4晶胞参数和晶面间距变小,增大了晶体比表面积,有利于g-C3N4光催化活性提升。
为分析Fe掺入对g-C3N4键合情况影响,笔者对g-C3N4与不同掺量Fe-C3N4进行了红外光谱表征,所得红外光谱图如图5。
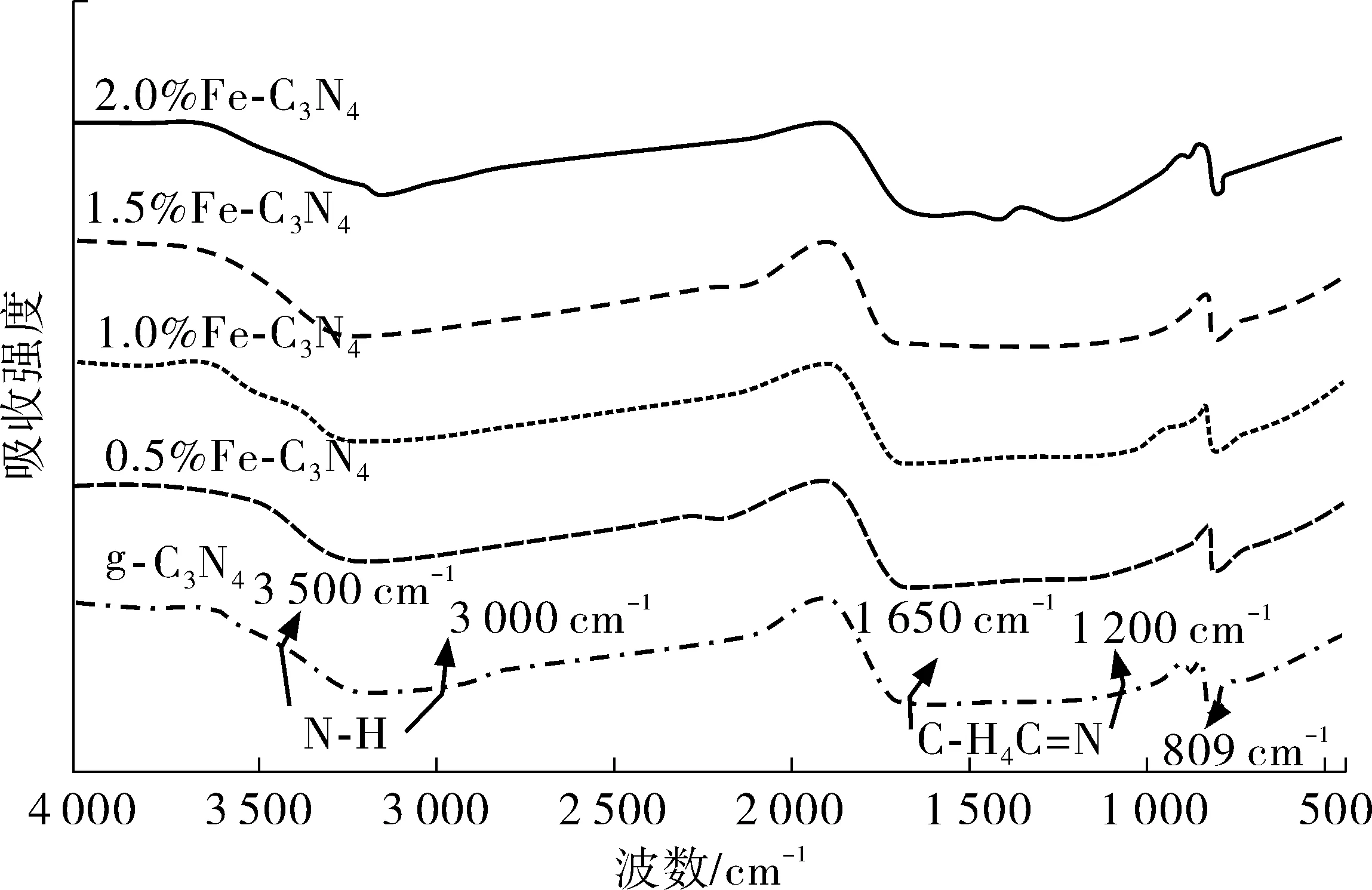
图5 g-C3N4和x%Fe-C3N4光催化剂的FT-IR图谱Fig. 5 FT-IR spectrogram of g-C3N4 and x% Fe-C3N4
由图5可知:纯g-C3N4吸收峰集中于3个区域,由文献[22-23]可知,分别是809 cm-1处三嗪环骨架的特征吸收峰,1 200~1 650 cm-1的C-H和C=N伸缩振动峰和3 000~3 500 cm-1N-H键伸缩振动吸收宽峰。Fe掺入后未出现新的特征峰,这表明Fe掺杂后未对g-C3N4键位产生影响,这与XRD图谱分析结果一致。
图6为g-C3N4和1%Fe-C3N4在相同放大倍数下的SEM图像。从图6(a)可看出:g-C3N4表现出不规则层状结构,多层结构堆叠在一起形成平板状颗粒,各部分间连结紧凑,出现明显的团聚现象;由图6(b)可看到:Fe-C3N4颗粒间分散性较好,晶粒层与层之间连结更为紧密,这说明Fe掺入后改善了g-C3N4团聚现象,有利于g-C3N4晶粒细化;同时由XRD分析可知:Fe掺入使g-C3N4结晶过程产生不同程度缩聚,其颗粒粒径减小,有利于晶粒比表面积增大,提升g-C3N4光催化活性[24-25]。
2.4 沥青基试件光催化性能评价
光催化剂在路面上的应用取决于与污染物和光源有效接触面积,为使光催化剂可更好的应用于路面,笔者采用制备光催化分散液将其喷洒于路面的方法研究其实际降解效率。图7为喷洒光催化剂分散液试件对NO气体降解效率。
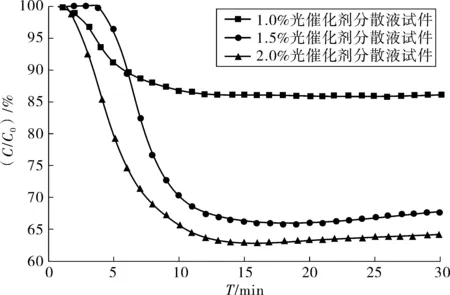
图7 光催化剂试件对NO降解效率Fig. 7 NO degradation efficiency of photocatalytic specimens
从图7可看出:随着分散液中光催化剂掺量增大,试件对NO降解效率越高。当掺量为1%时,试件对NO降解效率较低,这是分散液中的光催化剂含量较少,喷洒在沥青试件表面的光催化剂有效面积不足,导致其对NO降解效率较低,随着其掺量增加,光催化剂在分散液中含量也随之增大,更多的光催化剂被喷洒在沥青试件表面参与光催化反应。因为当分散液中光催化剂掺量为2%时,喷洒分散液的沥青试件对NO降解率达到最大值,为35.8%。
3 结 论
1)以金属元素对g-C3N4进行改性,采用水溶共混煅烧法制备Fe-C3N4,以对NO气体的降解效果作为评价指标。试验表明:在相同测试条件下,Fe-C3N4光催化性能明显优于纯g-C3N4,当Fe掺入量为1%,其光催化性能最优,在金属卤化灯照射30 min内对NO降解率可达75.43%,比纯g-C3N4提高了24.65%。
2)Fe掺杂改变了g-C3N4的能带结构,降低了带隙能,增大了对可见光吸收,使其吸收阈值红移约10 nm。Fe掺入后影响g-C3N4的晶相形成,抑制了晶相生长,增大了晶体比表面积。
3)采用分散液喷涂法将高活性光催化剂Fe-C3N4应用于沥青试件上,并测试了其在路面上的光催化活性。结果表明:当分散液中Fe-C3N4掺量为2%时,喷洒分散液的沥青试件对NO降解率最佳,为35.8%。

