烹饪方式对甘薯营养成分的影响
雷焕娜,李彦,曹忠娜,王春玲
(天津科技大学食品工程与生物科技学院,天津300457)
甘薯是一年生旋花科植物,其中中国甘薯常年种植约占全世界总产的80%左右,种植面积和总产量均居世界第一位[1]。
甘薯其含有丰富的淀粉、糖和纤维素等营养物质,同时也有很高的药用价值。《本草纲目》记载有甘薯能“补虚气、益气力、健脾胃和强肾阴”[2]。现代医学表明甘薯具有降糖、止血、消炎、防癌、通便等功效[3]。因此,甘薯被称为“长寿食物”,在国际上掀起了甘薯热。
甘薯是重要的粮、菜、饲料兼用作物[4]。目前,我国对甘薯的研究大部分停留在对部分品种甘薯的营养成分研究,但未对烹调过后的甘薯进行营养成分研究。随着生活水平提升,人们不但要求味道好,还要求烹饪后可以保存更多的营养物质。不同的烹饪方式对食物营养成分的作用和影响都是不同的,不合理的方式会造成食物中的营养成分流失。我国甘薯资源丰富,为了充分利用甘薯,保证甘薯的营养价值得到充分利用,研究不同烹饪方式对黄肉甘薯的营养成分影响,以此寻找最佳烹饪方式。
1 材料与方法
1.1 材料与试剂
甘薯(龙薯 9 号 24):市售。
无水乙醇、盐酸、碳酸钠、无水葡萄糖、硫酸铜、硫酸钾、浓硫酸(以上均为分析纯):天津市北洋第一化工厂;没食子酸标准品、抗坏血酸、木瓜蛋白酶(80 万U/g)、α-淀粉酶(3 700 U/g)、叠氮化钠、苯甲酸、糖化酶(活性≥10 万单位/g)、葡萄糖氧化酶(10 kU/32.7 mg)、过氧化物酶(233 U/mg~300 U/mg)(分析纯)、4-氨基安替比林、马来酸、福林酚、甲基红、溴甲酚绿(以上均为分析纯):北京索莱宝科技有限公司;氢氧化钠(分析纯)、硼酸(分析纯)、无水乙醇(优级纯)、氢氧化钾(分析纯)、石油醚(分析纯)(沸程 30 ℃~60 ℃)、无水硫酸钠(分析纯):天津市福晨化学试剂厂;二氯甲烷、三氯甲烷、乙腈、甲醇(色谱纯):博欧特(天津)化工贸易有限公司;α-胰淀粉酶 (700 U/mg~1 400 U/mg)(分析纯)、β-胡萝卜素标准品(色谱纯):美国Sigma-Aldrich公司;2,6-二叔基-4-甲基苯酚 (butylated hydroxytoluene,BHT)、正已烷、冰乙酸(分析纯):天津市化学试剂一厂;无水氯化钙、磷酸二氢钾、对羟基苯甲酸(分析纯):天津市光复精细化工研究所。
1.2 设备与仪器
DHG-9246A 型电热鼓风干燥箱:上海百典实验仪器设备有限公司;HNY-850 水浴摇床:天津市欧诺仪器仪表有限公司;L550 离心机、Vortex Genius3 涡旋震荡器、DF-101S 磁力搅拌器、MULTISKAN GO 酶标仪:美国Thermo 公司;FE20/EL20 型pH 试剂:梅特勒-托利多仪器(上海)有限公司;RE-52 旋转蒸发仪:上海亚荣生化仪器厂;LC-20A 型高效液相色谱仪:日本岛津公司;KON-O8D 定氮仪:北京森信实验仪器有限公司。
1.3 方法
1.3.1 烹饪处理
取一根长度适中的黄心甘薯,将其切成4 段,约5 cm,分别做空白、蒸、煮、微波4 种处理。空白:不做任何处理,即生甘薯;蒸:用水蒸35 min;煮:用水煮35 min;微波:用微波炉微波5 min[5]。将处理好的甘薯冷却、切块、-20 ℃冷冻,在真空冷冻干燥机中干燥24 h、磨粉、备用。
1.3.2 还原糖含量测定
采用 3,5-二硝基水杨酸法(3,5-dinitrosalicylic acid,DNS)测定[6-8]。以葡萄糖作为标准物质,分别取葡萄糖溶液(1 mg/mL)0、0.2、0.4、0.6、0.8、1 mL 于 15 mL的试管中,用蒸馏水补足至1.0 mL,分别准确加入DNS 2 mL,沸水浴加热2 min,流水冷却,用水补足到15 mL 刻度,在540 nm 波长下测定吸光度,以吸光度为纵坐标,葡萄糖浓度为横坐标制作标准曲线,计算回归方程。
称取甘薯样品冻干粉0.5 g 加入5 mL 水,80 ℃水浴提取30 min,其间摇动数次。提取后在12 000 r/min下离心15 min 取上清液,稀释40 倍备用。取稀释液1.0 mL 于15 mL 的试管中,分别准确加入DNS 2 mL,沸水浴加热2 min,流水冷却,用水补足到15 mL 刻度,在540 nm 波长下测定吸光度,通过回归方程算得葡萄糖含量。
1.3.3 总酚含量测定
采用福林-酚比色法[9-11],以没食子酸作为标准物质。准确称取20 mg 没食子酸粉末,使用蒸馏水定容至100 mL 的容量瓶中待用。于8 只25 mL 的磨口试管中分别加入 0.0、0.05、0.1、0.2、0.4、0.6、0.8、1.0 mL 的没食子酸的标准的溶液,加蒸馏水定容至1 mL,再加入福林-酚试剂(2 mol/L)0.5 mL,混匀,暗处放置 5 min 后加入2.0 mL 20%Na2CO3溶液,加蒸馏水定容至25 mL,充分混匀后25 ℃放置1 h,使用紫外—可见分度计检测760 nm 处的吸光度,以吸光度为纵坐标,没食子酸浓度为横坐标制作标准曲线,计算回归方程。
将0.5 g 甘薯粉与10 mL 60 %(体积分数,含有0.01 %盐酸)乙醇混合,80 ℃提取90 min,混合液5 000 r/min 离心15 min,取1 mL 提取上清液,加入福林-酚试剂(2 mol/L)0.5 mL,混匀,暗处放置 5 min 后加入2.0 mL 20%Na2CO3溶液,加蒸馏水定容至25 mL,充分混匀后25 ℃放置1 h,使用紫外—可见分度计检测760 nm 处的吸光度。通过回归方程及稀释倍数计算样品溶液中多酚的浓度,再换算出样品的最终含量。
1.3.4 抗性淀粉测定
采用AOAC200202 法测定抗性淀粉[12]。
1.3.5 慢消化淀粉和快消化淀粉的测定
采取改良后的体外模拟消化法:称取500 mg 甘薯粉,放入37 ℃温水浴锅中至温度升到37 ℃,加入乙酸钠缓冲液(0.2 mol/L,pH=5.2)15 mL,加入 5 mL(300 U/mL 胰α-淀粉酶和40 U/mL 糖化酶)的混酶液,在37 ℃下160 r/min 振荡消化水解。水解0、20 min 和120 min 后,分别取出0.5 mL 水解液于离心管中,加入20 mL 66%乙醇,静置后离心,取1 mL 离心后的上清液用3,5-二硝基水杨酸法测定葡萄糖的含量。计算0、20 min 和 120min 后上清液中葡萄糖的含量[5,13-19]。
慢消化淀粉(slow-digesting starch,SDS)、快消化淀粉(fast digesting starch,RDS)含量的计算公式如下:
SDS/%=(m120-m20)×0.9×100/mTS
RDS/%=(m20-m0)×0.9×100/mTS
式中:m0为水解 0 min 后葡萄糖质量,mg;m20为水解 20 min 后葡萄糖质量,mg;m120为水解 120 min 后葡萄糖质量,mg;mTS为样品中总质量,mg。
1.3.6 蛋白质
采用凯氏定氮法测定蛋白质含量[20]。
1.3.7 β-胡萝卜素
利用高效液相[21-26],采用C18柱(柱长 250 mm,内径4.6 mm,粒径 5 μm)以三氯甲烷 ∶乙腈 ∶甲醇=3 ∶2 ∶85含抗坏血酸0.4 g/L 为流动相,以流速为2 mL/min,在450 nm 下检测。
制备β-胡萝卜素标准曲线;称取β-胡萝卜素标准品50 mg,加入0.25 gBHT 用二氯甲烷溶解,定容至100 mL。从中准确提取10 mL,定容至50 mL。从中分别取 0.5、1、2、3、4、10 mL 在定容至 100 mL,得到 0.5、1、2、3、4、10 μg/mL 的标准液。以标准液浓度为横坐标,峰面积为纵坐标绘制标准曲线,计算回归方程。
本月的一件行业大事,就是中国农资传媒在“全国农资百佳优秀经销商”颁奖中,对“懂农业,爱农村,爱农民”这样农资精英的表彰。活动前期先在全国范围“寻找懂爱的农资人”。为什么要寻找“懂爱”的人?为什么要表彰懂爱的人?只因为对“三农”工作,不爱,干不好!对农资工作,不懂,爱不好!
提取β-胡萝卜素:0.1 g 甘薯粉至500 mL 锥形瓶里,加入 1 g 抗坏血酸,15 mL 45 ℃~50 ℃的温水,0.5 g木瓜蛋白酶和0.5 g α-淀粉酶混匀后,置于55 ℃恒温水浴震荡30 min 后,再加入75 mL 无水乙醇,于60 ℃水浴震荡30 min。加入25 mL KOH 盖上瓶塞置(53±2)℃恒温振荡水浴中皂化30 min。加入200 mL 石油醚室温下震荡24 h,转入500 mL 分液漏斗,静置分层,将有机相用水洗至中性后,通过无水硫酸钠过滤脱水,滤液收入蒸发瓶在(40±2)℃减压浓缩,近干。用氮气吹干,加入2.5 mL 二氯甲烷充分溶解,备用。通过回归方程算得试样中β-胡萝卜素含量。
2 结果与分析
2.1 还原糖含量
葡萄糖标准曲线见图1。

图1 葡萄糖标准曲线Fig.1 Glucose standard curve
根据图1 可得出回归方程为Y=0.665 8X+0.054 4,R2=0.999 1,其中X 为葡萄糖标准液质量浓度(mg/mL),Y 为吸光值。结果表明,葡萄糖质量浓度在0.00~1.00 mg/mL 范围内与吸光值线性关系良好。并根据该方法测定烹饪后的黄肉甘薯中还原糖的含量,以葡萄糖的相当值表示。
烹饪方式对黄肉甘薯的还原糖下降率的影响图见图2。

图2 烹饪方式对黄肉甘薯还原糖下降率的影响Fig.2 Effect of cooking method on the reduction rate of reducing sugar in yellow sweet,potato
由图2 可知,相比于空白,烹饪方式对黄肉甘薯的还原糖下降率有极显著影响(P<0.01),蒸会使还原糖含量下降而煮和微波都会使还原糖含量上升。煮、微波还原糖会上升可能由于在烹饪过程中淀粉水解产生还原糖导致,而煮制时上升略小是由于部分还原糖溶于水而损失。蒸制时下降可能由于还原糖与氨化物的α-氨基酸发生美拉德反应,消耗了还原糖,但淀粉转化的还原糖不足以抵消。
2.2 总酚含量
没食子酸标准曲线见图3。

图3 没食子酸标准曲线Fig.3 Gallic acid standard curve
根据图3 可知回归方程为Y=0.001 X+0.055 2,R2=0.999 2,其中X 为没食子酸标准液质量浓度(μg/mL),Y为吸光值。结果表明,没食子酸质量浓度在0.00~1.00 μg/mL 范围内与吸光值线性关系良好,并根据该方法测定烹饪后的黄肉甘薯中多酚的含量,以没食子酸的相当值表示。
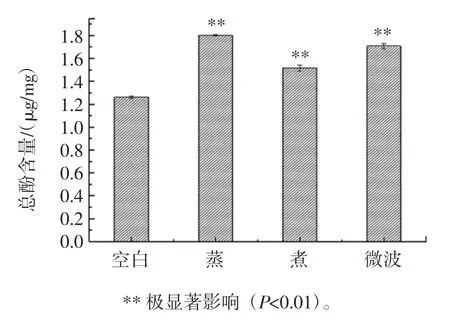
图4 烹饪方式对黄肉甘薯总酚上升率的影响Fig.4 Effect of cooking method on the rising rate of total phenol in sweet potato
由图4 可知,相比于空白烹饪方式对黄肉甘薯的总酚含量有极显著影响(P<0.01),蒸、煮和微波都会使总酚含量明显上升,其黄肉甘薯总酚含量上升有可能是烹饪过程中导致黄肉甘薯细胞壁破裂,释放出更多的酚类物质导致,而煮制黄肉甘薯总酚上升率相比其他要小,是由于细胞中的物质多溶于水,导致煮制过程中酚类物质溶液水中而损失。
2.3 抗性淀粉含量
烹饪方式对黄肉甘薯的抗性淀粉含量影响图见图5。
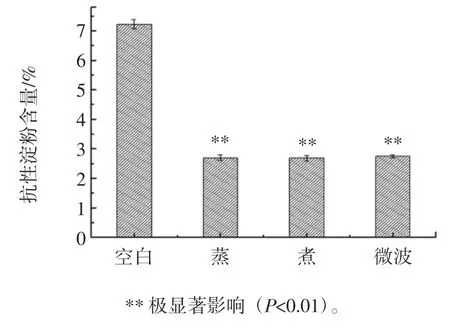
图5 烹饪方式对黄肉甘薯抗性淀粉含量的影响Fig.5 Effect of cooking method on resistant starch content of yellow meat sweet potato
由图5 可知,相比于空白烹饪方式对黄肉甘薯的抗性淀粉含量均有极显著影响(P<0.01),蒸、煮和微波都会使抗性淀粉含量下降。抗性淀粉的损失可能是由于淀粉结构发生改变,从而使α-淀粉酶容易进入淀粉颗粒内部,导致抗性淀粉的抗消耗能力减弱。
2.4 快消化淀粉含量和慢消化淀粉含量
烹饪方式对黄肉甘薯的慢消化含量影响图见图6。

图6 烹饪方式对黄肉甘薯慢消化淀粉含量的影响Fig.6 Effect of cooking method on slow-digested starch content of yellow sweet potato
由图6 可知,相比于空白烹饪方式对黄肉甘薯的慢消化含量有影响,蒸、煮和微波都会使慢消化淀粉含量下降。煮和微波对黄肉甘薯的慢消化淀粉下降具有即显著性影响(P<0.01),蒸对其含量变化影响并不显著。慢消化淀粉的损失可能是在烹饪过程中,慢消化淀粉转化为快消化淀粉,而煮和微波几乎全部转化为快消化淀粉。
烹饪方式对黄肉甘薯的快消化淀粉含量的影响图见图7。

图7 烹饪方式对黄肉甘薯快消化淀粉含量的影响Fig.7 Effect of cooking method on fast-digested starch content of yellow sweet potato
由图7 可知,相比于空白,烹饪方式对黄肉甘薯的快消化淀粉含量有影响,蒸、煮和微波都会使快消化淀粉含量上升且具有极显著影响(P<0.01)。快消化淀粉的上升可能是在烹饪过程中,慢消化淀粉转化为快消化淀粉。煮制时快消化淀粉会上升的比较多,主要是因为煮会使淀粉完全糊化,提高淀粉的消耗速率。
2.5 蛋白质含量
烹饪方式对黄肉甘薯的蛋白质含量的影响见图8。
由图8 可知,相比于空白烹饪方式对黄肉甘薯的蛋白质含量有影响,煮和微波会使蛋白质含量下降且具有极显著影响(P<0.01),蒸对其含量变化影响并不显著。其煮黄肉甘薯蛋白质含量下降有可能是黄肉甘薯中的水溶性蛋白质在煮的过程中流失导致的;微波黄肉甘薯蛋白质含量下降有可能是高温条件下蛋白质降解导致。

图8 烹饪方式对黄肉甘薯蛋白质含量的影响Fig.8 Effect of cooking methods on protein content of yellow sweet potato
2.6 β-胡萝卜素含量
β-胡萝卜素标准曲线见图9。

图9 β-胡萝卜素标准曲线Fig.9 β-carotene standard curve
根据图9 可得回归方程为Y=10 045X+2 495.5,R2=0.995 2,其中X 为β-胡萝卜素标准液质量浓度(μg/mL),Y 为吸光值。结果表明,β-胡萝卜素质量浓度在0.00~1.00 μg/mL 范围内与吸光值线性关系良好,并根据该方法测定鲜切黄肉甘薯中β-胡萝卜素的含量。
烹饪方式对黄肉甘薯的β-胡萝卜素含量的影响见图10。
由图10 可知,相比于空白烹饪方式对黄肉甘薯的β-胡萝卜素含量有影响,煮和微波均对β-胡萝卜素有极显著影响(P<0.01),煮和微波都会使β-胡萝卜素含量上升。蒸会使β-胡萝卜素含量下降但不具有显著性。蒸制导致β-胡萝卜素下降可能是由于β-胡萝卜素在蒸的过程中氧化分解所致。而煮和微波导致β-胡萝卜素上升可能是其加热方式使类胡萝卜素-蛋白质复合物之间的键断裂,增加了类胡萝卜素的溶出率,使类胡萝卜素含量增加,从而β-胡萝卜素含量增加[27]。

图10 烹饪方式对黄肉甘薯β-胡萝卜素上升率的影响Fig.10 Effect of cooking method on the rate of increase of βcarotene in yellow sweet potato
3 结论
通过测定还原糖、总酚、蛋白质、β-胡萝卜素、抗性淀粉、快消化淀粉、慢消化淀粉等营养指标,来考察黄肉甘薯的营养充分保留程度。结果表明,煮和微波对甘薯的营养成分有极显著性影响,会使蛋白质、抗性淀粉、慢消化淀粉含量下降,快消化淀粉、总酚、还原糖、β-胡萝卜素含量上升。而蒸对甘薯的个别营养成分有显著影响,会使抗性淀粉、还原糖含量下降,快消化淀粉、总酚含量上升。说明煮和微波更有利于营养吸收,微波更佳。

