环境PM2.5对慢性阻塞性肺疾病的致病机制研究
陈敏燕,黄依璐,樊 劼,寿逸凯,朱骁拯,卢 哲,胡 宇,王欢欢
(杭州师范大学 医学院,浙江 杭州 310036)
细颗粒物(PM2.5)是大气中直径小于或等于2.5 μm的由空气中酸、有机化学物质、金属物质、土壤、尘埃颗粒等固体和液体颗粒组成的复杂混合物,可在大气中保持数天或数周,并可在空中进行远程转运[1]。PM2.5可随呼吸进入肺泡并沉积,甚至渗透至血液而蔓及全身,引起机体相应的病理生理改变[2]。研究表明[3],长期暴露于PM2.5环境会增加人群呼吸系统、心血管系统等疾病的风险和死亡率。最新的全球疾病负担(global burden of disease,GBD)分析继续将空气污染确定为导致死亡和残疾的重要风险因素之一[4]。近年来,环境PM2.5对慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)的影响引发了全球的关注。
1 PM2.5污染与COPD相关流行病学研究
据世界卫生组织(WHO)统计,目前全世界大约有6亿人患有COPD,预计至2020年COPD将位居全球第3大致死和第5致残的疾病[5]。COPD是遗传与环境因素相互作用引起的慢性疾病,与长期或短时间暴露于有害颗粒或有害气体有关[6]。环境空气污染可能是引发或加剧COPD发展的潜在危险因素[7]。
流行病学研究显示了环境PM2.5暴露与 COPD疾病发展之间的关系。上海地区101例慢性阻塞性肺疾病急性加重(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)患者的调查研究显示,PM2.5质量浓度与AECOPD之间存在剂量—反应关系,且呈季节性差异[8]。Wu等[9]反复测定北京23名稳定的COPD患者呼吸气道炎症的生物标志物,结果表明短期暴露于高污染空气环境会增加COPD患者的呼吸道炎症和呼吸道症状,包括喉咙痛、咳嗽、咳痰、喘息和呼吸困难。Guo等[10]的一项大规模纵向队列研究结果表明,环境PM2.5暴露与成人肺功能下降有关,并且会加速COPD的发展。
流行病学研究显示,暴露于大气PM2.5污染可增加人群COPD死亡风险。印度的一项研究表明[11],暴露于环境PM2.5引发的特定疾病(仅限于COPD、中风、缺血性心脏病和肺癌)造成的过早死亡中,COPD占54.5%。Pinault等[12]在加拿大的一项前瞻性队列研究中表明PM2.5浓度与COPD的死亡率呈正相关,即使暴露于相对较低浓度的环境PM2.5(平均值6.3 μg/m3),也可观察到COPD死亡风险的增加。
2 环境PM2.5污染引起COPD的致病机制
研究发现[13-14],大气颗粒物可随呼吸经呼吸道深入肺泡进行积累和扩散,干扰肺的气体交换,出现通气功能障碍,其中PM2.5以及直径更小的颗粒可穿透肺泡壁,破坏肺泡血—气屏障进入血液循环,引起肺部或全身系统的炎症反应、氧化应激、免疫细胞失衡、表观遗传改变等,导致肺组织结构改变,气道狭窄和破坏,肺实质的损伤,最终引起气流受限和粘膜纤毛功能障碍。
2.1 气道炎症反应 PM2.5引起的慢性炎症反应是其诱导COPD的一个重要机制,PM2.5可通过多种途径引发机体气道炎症反应,见图1。环境PM2.5可靶向诱导肺泡上皮细胞、巨噬细胞和成纤维细胞分化,促进各种炎症细胞因子释放,聚集起来的细胞因子又可激活多种炎症细胞,炎症细胞与细胞因子反复相互作用,协同导致慢性炎症和COPD呼吸道结构变化,最终导致肺功能逐步恶化[15-16]。巨噬细胞是机体重要的固有免疫细胞,在细颗粒物的刺激下可被迅速活化,并分化为不同功能亚群。经典激活的M1型巨噬细胞,又称促炎细胞,具有强大的吞噬杀菌功能,主要分泌白细胞介素-6(interleukin-6,IL-6)、白细胞介素-8(interleukin- 8,IL-8)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促炎细胞因子;经旁路激活的M2型巨噬细胞,又称抑炎细胞,具有抑制炎症、调节免疫平衡的功能[17]。M1和M2巨噬细胞的平衡对宿主稳态至关重要,而细颗粒物的刺激则会打破平衡。暴露于环境PM2.5增强氧自由基(reactive oxygen species,ROS)依赖的促炎细胞因子粒细胞巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF),IL-6,IL-1β,TNF-α的表达,并进一步增强脂多糖(lipopolysaccharides,LPS)诱导的M1极化,损害M2极化,促进机体炎症反应发生,从而对机体造成损伤。另外,短时间暴露于PM2.5可显著损伤线粒体的功能[18]。
核转录因子-κB(nuclear factor κB,NF-κB)是机体中重要的细胞转录因子,在环境细颗粒物刺激下,可诱导NF-κB信号通路的激活,产生炎性损伤[16]。研究发现,PM2.5能激活COPD患者的巨噬细胞、中性粒细胞等炎症细胞以及促进患者支气管肺泡灌洗液中的细胞因子释放。黏附于PM2.5上的微生物成分(LPS等)刺激上皮细胞膜后,可增加Toll样受体4 (TLR4)的表达,激活NF-κB蛋白并通过LPS/MyD88信号通路释放炎性细胞因子[19]。NF-κB对于气道中炎性细胞因子的表达具有重要的调节作用,可增加炎症介质如IL-1β,IL-6,GM-CSF和IL-8等的表达和释放,促进气道慢性炎症和COPD的发展[20]。这些炎性因子的释放对巨噬细胞的极化也有影响。一项动物研究发现[21],暴露于PM2.5环境后,COPD大鼠肺组织中单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)和血管紧张素II(angiotensin II,AngII)以及NF-κB蛋白的表达较健康大鼠显著增加。IL-6、TNF-α等炎症细胞因子和趋化因子MCP-1均参与COPD的炎症反应[22]。
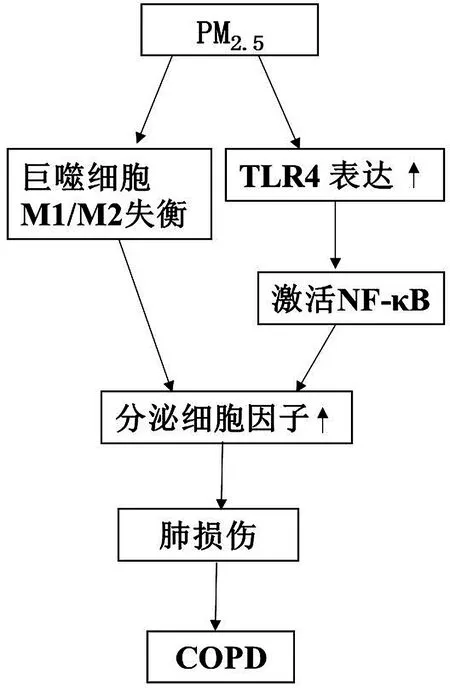
图1 PM2.5诱导COPD气道炎症反应机制
2.2 氧化应激 PM2.5具有自由基活性,PM2.5表面特有的化学特征及其所携带的金属成分、有机成分等能够刺激肺泡巨噬细胞产生自由基,损伤呼吸道上皮细胞,造成细胞膜屏障功能障碍[23]。PM2.5进入机体后通过释放大量生物活性较强的ROS诱导氧化应激并改变细胞通透性,导致多种呼吸系统疾病的发生、发展[24]。Liu等[25]研究证实PM2.5的有机成分可以激活和增强细胞内ROS的水平、细胞间黏附分子(intercellular cell adhesion molecule-1,ICAM-1)的表达和单核细胞的粘附作用,并通过肺上皮细胞IL-6/AKT/STAT3/NF-κB信号通路刺激炎症细胞因子IL-6等的产生,对肺上皮细胞造成氧化损伤;证明ICAM-1和IL-6可作为COPD的生物标志物。
在环境PM2.5诱导COPD氧化应激过程中,涉及多种氧化及抗氧化信号通路。核因子E2相关因子2(nuclear factor-like 2-related factor,Nrf2)氧化应激通路中,PM2.5诱导的ROS可作为信号分子,触发Nrf2进入细胞核而改变抗氧化酶的转录,继而破坏体内氧化与抗氧化之间的平衡,使过度活化的 ROS 攻击细胞内的生物大分子,最终导致COPD相关基因和蛋白质水平的改变[15,26]。另有研究表明[27-28],在PM2.5表面的有机物多环芳烃介导下,PM2.5可通过芳烃受体途径诱导严重的氧化应激,造成细胞损害。Yang等[29]实验结果表明,吸附在PM2.5表面的多环芳烃等有机化合物可激活多环芳烃受体(polycyclic aromatic hydrocarbons Recipient,AHR),并通过消耗紧密连接蛋白(zonula occludens-1,ZO-1)和α-1抗胰蛋白酶(α1-antitrypsin,AAT)破坏肺部上皮屏障功能,增加DNA损伤和促炎细胞因子的释放,增加COPD患病的风险。

图2 PM2.5诱导COPD的氧化应激机制
2.3 免疫失衡 COPD是一种异质性的综合征,与肺脏对有害颗粒和气体的异常免疫反应有关[30]。研究发现[31],调节性T(Tregs)细胞是COPD发病过程中免疫反应的抑制因子,可使免疫抑制功能明显下降,失去对炎性细胞的抑制作用,引起辅助性T细胞(Th1)/辅助性T细胞(Th2)失衡或辅助性T细胞(Th17)过度表达,这种免疫反应可导致COPD慢性炎症的持续和扩展,加速气道重塑并导致肺功能降低。
环境PM2.5表面的挥发性有机化合物(volatile organic compounds,VOCs)可穿过呼吸道上皮细胞进入人体,抑制树突状细胞的抗原呈递功能。Th2/Th17免疫失衡,细胞因子分泌紊乱,从而增加机体细胞突变、畸形、癌变的几率[15,32]。Tregs由不同的亚群组成,可分为具有抑制作用的CD25++CD45RA+静息状态Tregs(resting Tregs,rTregs)细胞和CD25+++CD45RA-活动状态Tregs(activated Tregs,aTregs)细胞,以及不具有抑制作用、但能分泌细胞因子的CD25++CD45RA-(Fr III)细胞[33]。Hou等[34]研究发现,COPD患者外周血中rTregs和aTregs的比例低于健康者,而Fr III细胞的比例高于健康者并产生IL-17和γ-干扰素(interferon-γ,IFN-γ),提示抗炎亚群和促炎亚群之间的不平衡以及具有免疫抑制活性的Tregs亚群比例的下降可能在COPD进展中发挥重要作用。Gu等[35]的动物实验证实,COPD小鼠表现出Th1和Th17免疫失衡,而PM2.5加重了COPD小鼠的Th1/Th2和Th17/Treg免疫失衡。PM2.5通过激活Notch信号通路调节T细胞分化并参与COPD发病机制中的免疫失衡[36]。Yang等[37]的研究结果也表明,机体长期暴露在PM2.5中能引起炎性反应加剧或延长,引起Th17 /Treg失衡以及相关细胞因子紊乱,降解呼吸道和肺部的细胞外基质(extracellular matrix,ECM)的作用增强,诱导细胞过度凋亡,造成COPD 患者气道组织破坏和肺气肿形成。
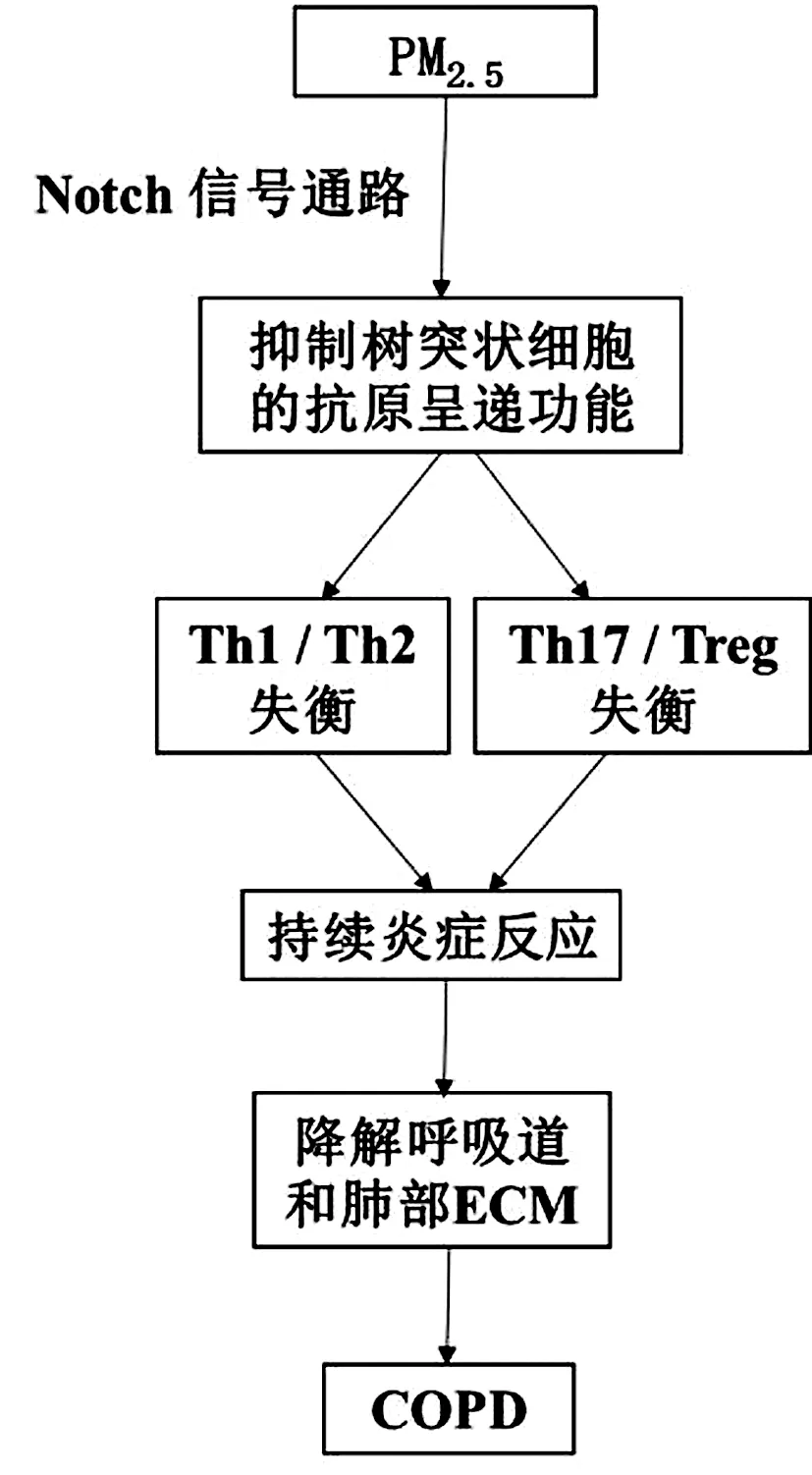
图3 PM2.5诱导COPD免疫失衡机制
3 结语
大量流行病学研究表明,PM2.5的暴露与COPD 的发生呈一定的相关性,而相关的体外细胞培养和动物实验等方法的研究也取得了一定进展。目前,环境PM2.5对COPD的致病机制研究主要包括炎症反应、氧化应激、免疫失衡等,其中炎症反应和氧化应激是目前认可的环境PM2.5致COPD的重要机制。进一步深入开展环境PM2.5对COPD致病机理的研究可为 COPD 的临床治疗以及人群预防提供科学参考。

