梁山慈竹BABY BOOM基因的克隆与表达分析
王丽丽,唐 一,黄 艳,曹 颖,胡尚连
(1.西南科技大学 植物细胞工程实验室,四川 绵阳621010;2.四川省生物质资源利用与改性工程技术研究中心,四川 绵阳621010)
竹是重要的非木本纤维资源,被广泛应用于制浆造纸、生物乙醇发酵以及板材制造等行业[1]。中国是世界上竹类资源最丰富的国家,竹林种类、面积和蓄积均居世界前列。目前,中国已形成了世界规模最大的竹产品加工制造产业,据国家林业局调查报告显示,2018年,我国竹产业产值达2 456亿元。然而,大部分竹产业还停留在竹的初级利用阶段,随着产业升级,对优质竹纤维的需求逐渐增大,但鉴于竹开花难、开花即死亡等生物学特点,传统的遗传育种方式改良竹纤维对于竹而言无法实现。随着生物技术的发展,分子生物学的不断进步以及基因组时代的来临,利用基因工程手段开发创造新的竹种质资源成为了近年来的研究热点。
体细胞胚胎是植物离体再生的高效方式及遗传转化的理想受体,近年的研究发现,形态发生调控基因BABY BOOM(BBM)是一类特殊的转录因子,能够启动下游相关基因的响应从而启动了体细胞胚胎的发生。很多学者将BBM基因看作是胚胎特有的基因或胚胎发生的标志基因之一,该基因是启动和调控体细胞胚胎发生发育的开关[2]。该基因对于植物体细胞胚的诱导等研究主要集中在杨树、拟南芥等双子叶植物上[3-4];例如在辣椒中超量表达油菜BBM基因可以将仅0.03%的遗传转化效率提高提高至1%[5];同样的,在禾本科水稻、玉米等也有部分报道,研究认为将其单独超量表达可以将高玉米的转化率从1.7%提高到34%,不同基因型提高的转化率各不相同[6]。然而,该基因在竹中尚未被克隆,且对竹类植物离体再生以及遗传转化等方面的研究也未见报道。因此,本研究拟克隆慈竹BBM基因,对其进行生物信息学分析、组织表达分析以及相关激素处理后其表达模式分析等,为后续进一步通过该转录因子提高该基因在竹中的遗传转化效率而奠定基础。
1 材料与方法
1.1 植物材料及处理
采集梁山慈竹(Dendrocalamus farinosus)的笋(高30 cm,分为笋箨、笋基部和笋尖3个部分)、侧芽、未展开叶和展开叶6个不同部位组织作为基因克隆和组织表达分析的试验材料。材料经液氮速冻后保存于-80℃超低温冰箱中保存。植物材料取自西南科技大学龙山教学实验基地。
激素诱导表达采用盆栽梁山慈竹实生苗,叶面喷施ABA(10 mg·L-1)、IAA(0.25 mg·L-1)NAA(0.1 mg·L-1)和MeJA(0.1 mmol·L-1),每个处理3株以上,对照则喷施自来水的,分别在处理时间0、1、2、4、6、10 h取枝条顶部第3片展开叶提取RNA,用于DfBBM基因表达量分析。
1.2 试验方法
1.2.1 DfBBM基因克隆 从梁山慈竹转录组数据库中筛选出1个BBM基因,使用NCBI\\Primer-Blast在线软件设计全长引物(表1),以梁山慈竹笋的cDNA为模板,进行PCR扩增(扩增条件为95℃预变性3min,95℃变性30 s,58℃退火30 s,72℃延伸2 min,30个循环,72℃延伸5 min,4℃保存。PCR产物连接T载体后导入感受态大肠杆菌DH5α。经蓝白斑筛选,选择阳性重组质粒挑斑摇菌送华大基因测序。
1.2.2 DfBBM生物信息学分析 使用在线工具Conserved,ExPaSy中的ProtParam软件理化性质分析,用NCBI在线工具Conserved[7]对其保守结构域分析,用ExPaSy工具中的SOPMA软件和SWISS-MODEL对BBM蛋白序列进行二级和三级结构分析,使用http://www.dabi.temple.edu/disphos/进行磷酸化位点的预测,使用http://www.cbs.dtu.dk/services/NetNGlyc/进行N型糖基化位点预测;使用http://www.cbs.dtu.dk/services/YinOYang/进行真核生物O型糖基化位点预测。用Mega7.0软件,使用最大似然法构建系统进化树。

表1 梁山慈竹DfBBM 基因克隆和Real-time PCR分析所用引物Tab.1 Primers used in DfBBM gene cloning and real-time PCR analysis in D.farinosus
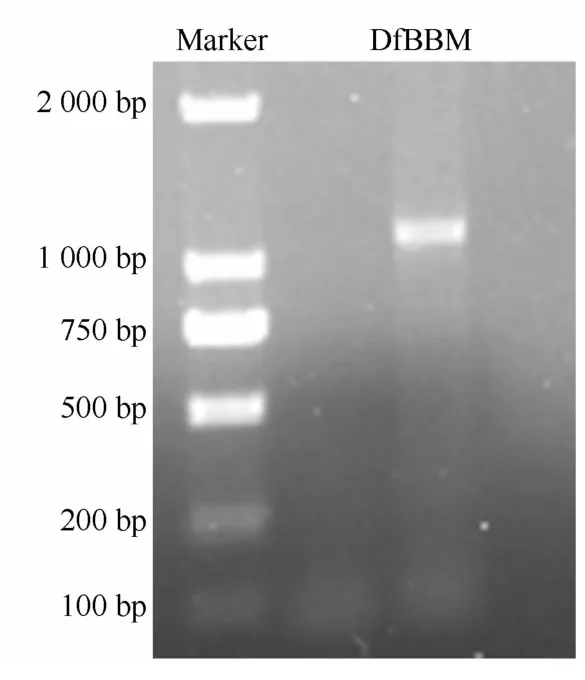
图1 梁山慈竹DfBBM 基因克隆Fig.1 Cloning of DfBBM gene
1.2.3 DfBBM组织表达分析 以梁山慈竹Tublin基因作为内标,用NCBI\\Primer-Blast在线软件设计RT-PCR引物。使用SuperReal PreMix Plus(SYBR Green)试剂盒(TIANGEN)20μL体系说明加样后,在IQ5 Multicolor RT-PCR自动扩增仪上按照三部法进行PCR反应。反应完成后分析溶解曲线,确认无引物二聚体和非特异扩增。每个样品作3次重复,采用2-△△Ct法[8]计算不同组织部位的基因表达量。
2 结果与分析
2.1 梁山慈竹DfBBM 基因的克隆及鉴定
以梁山慈竹笋的cDNA为模板进行克隆,获得一条约1 100 bp的片段(图1)。测序结果显示,获得的DfBBM基因的开放阅读框长度为1 101 bp,编码366个氨基酸(图2)。

图2 DfBBM 基因的核苷酸序列与氨基酸序列Fig.2 Nucleotide and amino acid sequences of DfBBM
2.2 梁山慈竹DfBBM 进化树分析
以DfBBM的氨基酸序列为探针,通过NCBIBlast P程序检索与DfBBM同源性较高的其他植物BBM序列:ZmBBM1(NP_001147535.1),ZmBBM2(ACG29578.1),PtBBM(XM_002316143),AtBBM(NM_121749.2),OsBBM1(AAX95437.1),RcBBM(EEF47356.1),RcBBM1(KC429673),RcBBM2(KC429674),BnBBM2(AF317905.1),BnBBM1(NM_121749.2),AtPLT1(NP_188720.2),AtPLT2(NP_175530.2),GmPLT2(NP_001234943.1),AeBBM1(XP_020174447.1),EtBBM(AQK38189.1)。使用MEGA7.0软件构建系统发育进化树(建树模型JTT+T)。如图3所示,DfBBM与玉米的BBM2以及山羊草和旱麦草的BBM基因在一个分支上。
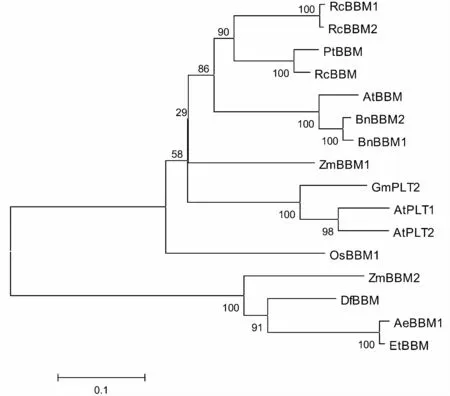
图3 DfBBM 基因系统发育树Fig.3 Phylogenetic tree of DfBBM genes from different plant species
2.3 DfBBM 基因的蛋白保守基序分析
对DfBBM 蛋白功能结构域分析,发现DfBBM 含有AP2结构域,DfBBM,ZmBBM2,AeBBM1和EtBBM的AP2结构域的氨基酸序列比对分析发现都含有2个AP2结构域(图4)。利用MEME[9]在线工具对梁山慈竹、野生稻和水稻基因编码的蛋白序列进行识别分析(图5)。可 以 看 出BBM 和ZmBBM2,AeBBM1,EtBBM之间含有8个保守基序,这可能有助于研究DfBBM和其他物种BBM基因的相似功能。蛋白质二级结构预测表明,蛋白以无规则卷曲为主,含有31.15%的α-螺旋,8.2%的β-转角,15.03%的延伸链和45.63%的无规则卷曲。从图6可以看出蛋白质三级结构主要以β转角为主。梁山慈竹BBM基因理化性质如表2所示,DfBBM基因编码的酸性残基多于碱性残基。蛋白的亲疏水性预测结果,推测DfBBM基因编码的蛋白为亲水性蛋白。从图7和图8看出DfBBM氨基酸序列可能存在26个磷酸化丝氨酸位点。DfBBM氨基酸序列可能有1个N型糖基化位点,6个O型糖基化位点。

图4 DfBBM,Zm BBM 2,AeBBM 1和EtBBM 的AP2结构域的氨基酸序列比对Fig.4 Amino acid sequence alignment of AP2 domains of DfBBM,ZmBBM2,AeBBM1 and EtBBM

图5 DfBBM 蛋白保守基序分析Fig.5 The conserved motif analysis of DfBBM protein

表2 梁山慈竹DfBBM 理化性质分析Tab.1 Physical and chemical properties of the protein encoded by DfBBM

图6 BBM 蛋白质三级结构预测Fig.6 BBM protein tertiary structure prediction
2.4 DfBBM 基因组织表达分析
通过实时荧光定量qRT-PCR检测发现,DfBBM基因在展开叶中表达量最高,在笋尖的表达量高于笋基、箨和侧芽,未展开叶中的表达量最低(图9)。对梁山慈竹施加ABA、IAA、NAA和MeJA激素,发现在ABA、IAA和MeJA激素处理下,DfBBM 基因表达量都明显升高,在NAA激素处理下,表达量明显下降(图10)。
3 讨论

图7 DfBBM 磷酸化位点预测(“S”代表丝氨酸磷酸化位点)Fig.7 Phosphorylation site prediction of DfBBM protein(“S”stands for serine phosphorylation site)

图8 DfBBM 糖基化位点预测Fig.8 Glycosylation site prediction of DfBBM

图9 DfBBM 基因在不同组织中的表达Fig.9 qRT-PCR analysis of DfBBM gene in different tissues
植物离体再生是现代植物育种和作物生物技术的重要工具,通过体细胞胚胎发生或器官发生途径再生通常取决于外植体类型以及培养基中添加的植物生长调节剂,特别是植物生长调节剂的浓度和比例等往往是离体再生成功与否的关键[10]。然而,不同植物个体差异以及遗传背景相差很大,因此通过外源添加植物激素诱导不同物种离体再生经常无法成功。人们对于离体再生过程中的遗传基础差异知之甚少,然而在植物体细胞胚或者不定芽形成过程中部分基因已经被证实参与其中[11-14]。这些基因的大多数都是从拟南芥中克隆得到的,大部分编码转录因子且参与植物体内信号传导等过程,过量表达其中的某些基因可以代替外源激素的使用,促使植物离体再生。例如LEAFY COTYLEDON1[13], LEAFY COTYLEDON2[15],WUSCHEL[14]以及BBM转录因子等均能促进植物离体再生[16-17]。

图10 DfBBM 基因在ABA、IAA、NAA和M eJA激素处理下的表达Fig.10 Relative transcript levels of DfBBM in response to ABA、IAA、NAA and MeJA
BBM基因最初是由油菜(Brassica napus)未成熟的花粉粒诱导产生的体胚分离而来,属于AP2/ERF转录因子家族基因之一[16]。在油菜、拟南芥等模式植物中表达能形成体胚等结构,同时可使外植体再生而不需要额外添加外源激素,研究者认为该基因在体胚发生过程中能促进细胞扩增和形态的发生[16],是胚胎特有的基因或胚胎发生的标志基因之一。BBM AP2/ERF转录因子诱导拟南芥和油菜的胚胎细胞发育。BBM在体外和种子胚胎发生的早期阶段以及在幼苗根分生组织中表达[18-19]。异位BBM在拟南芥中的表达可以诱导幼苗和外植体自发的体细胞胚胎发生和芽的发育,其在老组织如叶片中的表达可以诱导多效形态学改变。这些观察结果提示BBM在促进细胞增殖过程中的发育依赖作用。Li等[20]为了了解LkBBM转录调控的分子机制,从落叶松基因组中总共获得了4个2117 bp侧翼片段,发现了几个重要的顺式作用元件,ROOTMOTIFTAPOX1元素(根特异性的元素),MYB1AT,MYBCORE,MYBPZM和MYBST1元素(元素参与MYB识别),ARFAT,AUXREPSIAA4和SURECOREATSULTR11元素(元素参与生长素响应),ARR1AT元素(元素参与细胞分裂素反应),CAREOSREP1,GARE1OSREP1,ATCCAOSAMY和PYRIMIDINEBOXHVEPB1元素(元素参与赤霉素响应能力),MYB1AT和DPBFCOREDCDC3元素(参与脱落酸反应的元素)。因此我们认为BBM在行使功能时可能与各个激素密切相关,因此我们用ABA、IAA、NAA和MeJA激素对梁山慈竹进行处理,发现其对这几种激素都有不同程度的响应,其中对NAA激素处理与其他激素处理响应不同,DfBBM基因表达量明显下降。这表明DfBBM的侧翼可能也具有与ABA、IAA、NAA和MeJA激素相关的顺式作用元件,需要接下来对DfBBM基因侧翼序列进行克隆测序验证。
本研究克隆了梁山慈竹BBM基因,蛋白功能域预测分析表明DfBBM基因含有AP2结构域,DfBBM的三级结构预测发现与乙烯反应性转录因子ERF096模型高度相似。研究发现ERF家族的基因编码转录调控因子,在植物发育和生理过程中具有多种功能。MtSERF1是AP2/EREBP家族转录因子的一员,Mantiri等[21]发现利用RNA干涉技术将该基因沉默后,转基因苜蓿体细胞胚胎发生频率大大降低。Horstman A等[22]发现BBM可以转录调控LEC1和LEC2,FUSCA3(FUS3)和ABI INSENSITIVE3(ABI3)等基因。杜邦先锋联合巴斯夫和陶氏益农公司在玉米中发现了两个对转化效率影响的基因BBM和WUS2,超表达这两个基因可提高转化效率到25-50%[23]。进化树分析发现DfBBM基因与玉米BBM基因聚为一簇,序列高度相似,保守结构域分析发现DfBBM和ZmBBM2之间含有8个保守基序,这可能有助于DfBBM和ZmBBM2的相似功能。综上推测DfBBM基因可能在细胞分裂、分化、增殖及胚胎发育方面有重要作用,如果超表达DfBBM能够提高转化效率,这将有助于解决目前竹子遗传转化效率较低的难题。

