紫花前胡素经Nox1/Akt信号通路对口腔鳞癌细胞增殖及侵袭的抑制作用
王 慧 ,邵义熊 ,阮自琴 ,毛 敏
(1.湖北省十堰市妇幼保健院口腔科,湖北 十堰 442000; 2.湖北医药学院附属太和医院口腔科,湖北 十堰 442000)
口腔鳞状细胞癌(简称口腔鳞癌)是常见的头颈部肿瘤,患者5年生存率仅为53%[1-2]。咀嚼槟榔、吸烟、饮酒等会持续产生氧化应激产物。过量的氧化应激产物产生会介导DNA损伤和/或脂质过氧化,这些均已被证实能加快口腔鳞癌的发展[3-4]。研究表明,口腔鳞癌患者唾液中的氧化应激标志物[如8-羟基-2′-脱氧鸟苷和丙二醛(MDA)]水平高于健康人群,而抗氧化剂维生素C和维生素 E水平则较低[5]。还原型辅酶Ⅱ(NADPH)氧化酶(Nox/Duox)家族是产生氧化应激产物的酶家族,可在癌症的进程中发挥重要作用。上调Nox1表达和随后生成的氧化应激产物可促进癌细胞增殖[6-7]。紫花前胡素为紫花前胡的醇提物,有祛痰解痉、抗血小板聚集和抗炎作用,并可抑制癌细胞的生长和代谢[8-9]。本研究中探讨了紫花前胡素通过Nox1/Akt信号通路抑制口腔鳞癌细胞增殖及侵袭的作用,为口腔鳞癌的治疗提供参考。现报道如下。
1 材料与方法
1.1 仪器、试药与细胞
仪器:MilliCell室(美国 Millipore公司);SpectraMax M5型分光光度计(美国MolecularDevices公司);IX73型倒置显微镜(日本奥林巴斯公司);FACSCantoⅡ型流式细胞仪(美国BD公司);NanoDrop 2000型分光光度计(美国 Thermo Fisher Scientifc公司);Applied Biosystems 7500型实时荧光定量聚合酶链反应系统(qPCR,美国Applied Biosystems公司)。
试药:10%胎牛血清(FBS),DMEM培养基,均购自美国Thermo Fisher Scientific公司;四氮唑盐(MTT,德国Sigma-Aldrich 公司);4′,6-二脒基 -2-苯基吲哚(DAPI),0.5% 结晶紫,均购自美国 Sigma 公司;Matrigel基质(美国BD公司);RNA试剂盒、Ex Taq酶,均购自日本Takara公司。
细胞:口腔鳞癌SCC-25细胞,源自美国典型培养物保藏中心(ATCC)。
1.2 方法
细胞培养及分组:SCC-25组(A组)及紫花前胡素低、中、高剂量组(B1组、B2组、B3组)取 10 mL SCC-25细胞(密度为5×106/mL)置有10%胎牛血清的DMEM培养基中,各组分别加入紫花前胡素 0,20.0,40.0,80.0μg/mL,置 CO2培养箱(37℃,5%CO2,2%O2,93%N2)。以上各组每孔设6个平行样,培养72 h。
细胞增殖水平检测:采用四氮唑盐(MTT)比色法评估。取上述各组细胞,每孔中加入MTT溶液。孵育4 h后,加入裂解缓冲液(10%SDS 加入 0.01 mol/L HCl中)并孵育过夜。最后,使用分光光度计测定550 nm波长处的吸光度(OD),计算存活率及凋亡率。
细胞单克隆形成数目检测:取上述各组细胞,用胰蛋白酶处理,计数,并在密度为103细胞/孔的6孔板中用完全培养基重新接种8 d。每3 d更换培养基,以维持细胞生长。将菌落固定,并用0.5%结晶紫在室温下染色30 min。培养8 d后,在倒置显微镜下计数菌落数。
细胞体外侵袭试验:在MilliCell(直径12 mm,孔径8 μm)室上侧预涂Matrigel。在补充有0.1%血清的培养基中将1×105个上述各组细胞加入上部隔室中,并将该室置含有10%胎牛血清的培养基的24孔板中。在37℃下培养24 h后,擦去膜上侧的细胞,将下膜表面上的侵入细胞固定,并用DAPI染色。通过计数每个室10个高功率毡的穿膜孔数来量化侵入活动。
细胞凋亡水平:使用基于Annexin V(Axv)-FITC/PI双染色的流式细胞(FACS)分析。室温下在Axv-FITC和 PI(10 μg /mL)中温育 15 min,使用流式细胞仪测定荧光强度。
细胞Nox1 RNA及P-Akt RNA表达水平:采用逆转录-定量聚合酶链反应(RT-qPCR)法测定。从上述各组细胞中提取总RNA。以分光光度计测定RNA浓度。确保浓度比值水平为 2.60~2.80,PCR 系统上用SYBR预混物Ex Taq进行qPCR。GAPDH mRNA用于标准化 RNA 比对。引物序列如下,Nox1(5′-GCAACCAATGGATCTCCTCCT-3′和 5′-GGGGAGAAAAACACCCCGAA-3′),P-Akt(5′-TGACACGCTTCCCTGGATTG-3′和 5′-TCCGGGGACAGCATCAAATC-3′),GAPDH(5′-CTCTGCTCCTCCTGTTCGAC-3′和 5′-GCGCCCAATACGACCAAATC-3′)。热循环条件,40 个循环,在95℃下变性10s,在60℃下退火10s,在72℃下延伸15 s。数据用2-ΔΔCt法处理。平行测定3次。
细胞氧化应激水平:取上述各组细胞,5 000 r/min离心收集细胞,加入磷酸盐缓冲液(PBS)制成细胞悬液后,以酶联免疫吸附(ELISA)法测定培养液中超氧化物歧化酶(SOD)、MDA、谷胱甘肽过氧化物酶(GSH-Px)蛋白水平。
1.3 统计学处理
采用SPSS19.0统计学软件分析。计量资料以表示,采用单因素方差分析,多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
结果见表1至表4。

表1 各组SCC-25细胞OD值、存活率及凋亡率水平比较(n=6)
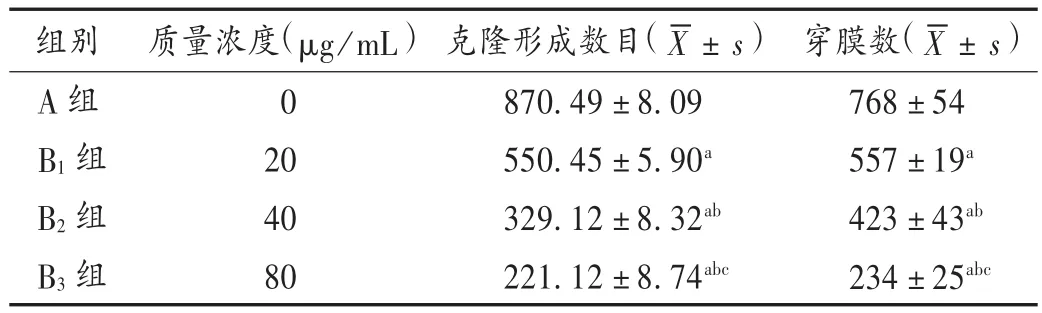
表2 各组SCC-25细胞克隆形成数目及穿膜数比较(n=6)

表3 各组SCC-25细胞Nox1及 P-Akt mRNA表达水平比较(n=6)

表4 各组SCC-25细胞氧化应激水平比较(n=3)
3 讨论
口腔鳞癌为常见恶性肿瘤,对放射治疗和化学疗法反应较差。紫花前胡素是一种天然的异丙基甲酚,具有镇痛、抗菌、抗炎、抗氧化和抗血管生成的作用[10]。肝癌细胞体外试验证实,紫花前胡素可通过一系列生物学途径抑制肝癌细胞的增殖,包括细胞周期调控、细胞凋亡、肿瘤发生、黏附和侵袭。此外,紫花前胡素对肺癌、乳腺癌和结肠癌细胞也具有一定抗增殖作用[11]。本研究结果显示,B1组、B2组、B3组的OD值、存活率、细胞克隆形成数目、穿膜数水平低于A组,凋亡率水平高于A组,这与上述文献结论相符合。同时提示,紫花前胡素能抑制口腔鳞癌细胞的增殖和侵袭,并促进其凋亡。
Nox/Duox家族由7名成员组成,被认为是氧化应激产物生成的主要来源,其在癌症发生、发展中起重要作用[12]。据报道,对Nox1活性的抑制可诱导许多癌细胞(包括胰腺癌、间皮瘤和肉瘤)凋亡。RT-PCR分析显示,Nox1 mRNA和Nox4 mRNA在肺癌细胞系的重要亚组中呈高度表达[12]。基因敲除Nox1,可显著抑制肺癌细胞活力。Nox1还能抑制p53(K382)的乙酰化,后者是SiRT1脱乙酰酶的靶标,并抑制了p53促凋亡转录活性[13]。近期研究发现,在卵巢细胞癌中,Nox1的敲低显著增强了顺铂诱导的细胞凋亡。这一新发现提示了Nox1可能是癌细胞治疗的一个重要潜在靶点[14]。本研究结果显示,B1组、B2组、B3组的Nox1mRNA表达水平低于A组。说明紫花前胡素能抑制Nox1的表达,进而降低口腔鳞癌细胞的活性。
Akt是细胞存活的调节因子,通过其磷酸化活化抑制凋亡,从而防止细胞死亡和延长细胞存活期[15-16]。选择性抑制剂作用于磷脂酰肌醇3-激酶(PI3K/Akt)对非小细胞肺癌、血液系统恶性肿瘤和头颈部鳞状细胞癌疗效较好[17]。本研究中发现,B1组、B2组、B3组的 Nox1 mRNA和P-Akt mRNA表达水平低于A组,提示紫花前胡素可通过抑制Nox1活性,降低Akt的磷酸化水平,进而加速口腔鳞癌细胞的凋亡。
由氧化应激产物水平分析结果可知,B1组、B2组、B3组的SOD和GSH-Px水平高于A组,MDA水平低于A组。提示紫花前胡素能明显降低氧化应激产物水平,进而抑制癌细胞的增殖及侵袭。这与上述文献的结果相符。
综上所述,紫花前胡素能抑制口腔鳞癌细胞增殖、侵袭,并促进其凋亡,其机制与紫花前胡素抑制Nox1活性并降低Akt的磷酸化水平,从而降低其氧化应激水平有关。但本研究中只探讨了紫花前胡素对Nox1 mRNA及Akt mRNA表达的影响,未探讨紫花前胡素对口腔鳞癌细胞Nox1/Akt信号通路上下游细胞因子表达的影响,这将在后续研究中进行。

