基层医院儿童抗生素相关性腹泻影响因素及肠道感染菌群特征性研究
王富海,余健全,罗家怡
(广东省佛山市高明区人民医院,广东 佛山 528500)
抗生素相关性腹泻(antibiotic associated diarrhea,AAD)是指患者在使用抗生素后导致的肠道菌群失调而引起的医源性腹泻,同时包括抗生素本身毒副作用所致的腹泻,是临床常见的药物不良反应[1]。自20世纪80年代以来,抗生素的滥用突出,导致抗生素相关性腹泻的发生率逐步上升。儿童是抵抗力低下人群,发生感染新疾病的风险较大。有数据显示,儿童在呼吸道感染,使用抗生素治疗后,AAD的发病率为30%~50%[2]。而几乎所有抗生素都能引起AAD。严重腹泻会导致儿童脱水和电解质紊乱,且时间过长会造成儿童营养不良、生长发育落甚至发生肠穿孔危及生命[3-4]。目前有关AAD发病危险因素研究较少。而人体肠道内微生物构成复杂的微生态系统,通过分析肠道菌群有利于为抗生素性腹泻提供新的治疗思路。本研究旨在分析本市儿童抗生素相关性腹泻的影响因素,以及腹泻的肠道菌群特征,为临床治疗提供科学依据。
1 对象与方法
1.1 研究对象
纳入2018年6月-2019年3月在入住我科的患儿93例,患者在住院期间均使用过抗生素,根据使用后是否出现抗生素相关性腹泻,分为AAD组和非AAD组。发生抗生素相关性腹泻的儿童共53例,其中男童28例,女童25例,平均年龄(3.12±1.05)岁,作为AAD组。未发生抗生素性相关腹泻的儿童共40例,平均年龄(5.79±1.82)岁,男童21例,女童19例,作为非AAD组。参考相关文献后,本次研究对AAD的判断标准为:(1)入院前无腹泻现象,在使用抗生素3天后发生腹泻;(2)患儿每天大便次数超过3次;(3)无明显白细胞增多现象;(4)患儿的粪便在实验室经过培养后,无细菌生长。排除基础疾病或其它原因所致腹泻。另纳入86例正常健康的儿童作为对照组,男童56例,女童30例,年龄2~12岁。观察和比较发生AAD的患儿与正常儿童的肠道菌群差异。
1.2 研究方法
1.2.1一般资料 收集儿童的一般资料,包括性别、年龄、身高、体重、发病前营养状态、白蛋白水平、总蛋白水平、白细胞含量、急性腹泻等相关指标。根据WHO 2006年儿童青少年体格发育参考标准评价儿童的营养状态,采用Z值评分法诊断儿童营养不良。Z评分的计算公式为:Z=(儿童测量数据-参考标准中位数)÷参考标准标准差[5]。
记录患儿抗生素使用时间、使用种类、是否频繁跟换(1周内跟换抗生素超过3类)以及腹泻类型(单纯腹泻、坏死型肠炎、伪膜肠炎)、腹泻粪便特征(糊状便、黏液便、脓血便等)
1.2.2肠道菌群特征 肠道菌群培养:入院后采集患儿粪便标本和分泌物进行细菌培养。菌株使用法国生物梅埃里公司BACT/ALERT120 全自动微生物分析仪进行鉴定,药敏实验严格按照美国临床实验室指标委员会(NCCLS)推荐的K-B法,明确感染的菌群状态。主要观察的菌为大肠埃希菌、双歧杆菌菌落并计数,并计算/双歧杆菌菌落/大肠埃希菌菌落比值(B/E),同时对肠道菌群进行药物敏感试验,常见的细菌菌谱有金黄色葡萄球菌、大肠埃希菌、鲍氏大肠杆菌等。
粪便图片检测:用无菌牙签沾取新鲜粪便直接涂抹在干净的载玻片上,大小为1.0 cm×2.0 cm左右,自然干燥后酒精火焰固定3次,革兰染色法染色。将A液滴加在涂片上,量以盖住粪便涂片为宜,加入等量B液与A液混合,1 min后冲洗干净。碘液媒染,1~2 min后倾去,流水冲洗。加入脱色液脱色30 s左右,洗净,滴加复染液,染色30 s左右,洗净,干燥。使用显微镜进行观察并分级。判断标准:1)肠道菌群基本正常:细菌总数属正常范围,革兰氏阳性菌多于革兰氏阴性菌,少量革兰氏阳性球菌和革兰氏阴性球菌,无明显酵母样菌(正常
对照组为参考)。2)I度肠道菌群失调:细菌总数处于正常范围内低值,革兰阳性杆菌略减少,革兰氏阴性杆菌稍增加。3)II度肠道菌群失调:细菌总数明显减少,革兰阴性杆菌明显增加,革兰阳性细菌明显减少,革兰阳性球菌增多,有少量类酵母样菌。4)III度肠道菌群失调:细菌总数显著减少,革兰氏阳性、阴性菌大部分消失,葡萄球菌或类酵母样菌占优势,或革兰阳性粗大杆菌成堆排列[6]。
1.3 统计学方法
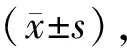
2 结果
2.1 不同组儿童肠道菌群特征
经观察和实验数据,正常儿童体内肠道内各类细菌和新总数比例正常。包括双歧杆菌、大肠杆菌、葡萄球菌、厌氧性细菌等,杆菌/球菌>3∶1,其中双歧杆菌和乳酸杆菌等益生菌在肠道菌群中占绝对优势,其次是大肠杆菌等共生菌,前者的数量约为后者的10~100倍。经检测,正常儿童的肠道中,双歧杆菌/大肠杆菌(B/E)的比值均>10。而患有抗生素相关性腹泻的儿童,粪便内细菌总数较少,且革兰氏阴性菌增多,革兰氏阳性杆菌相比正常值减少。双歧杆菌等益生菌数量明显减少。B/E均小于10,肠道内菌群均属于失调状态。AAD组与对照组肠道菌群间差异见表1。
2.2 AAD组儿童肠道菌群失调比例
经统计,发生AAD患儿中,菌群失调程度为Ⅰ度肠道菌群失调的20人,占比37.74%,Ⅱ度肠道菌群失调32人,占比60.38%,Ⅲ度肠道菌群失调仅1人,占比1.89%。
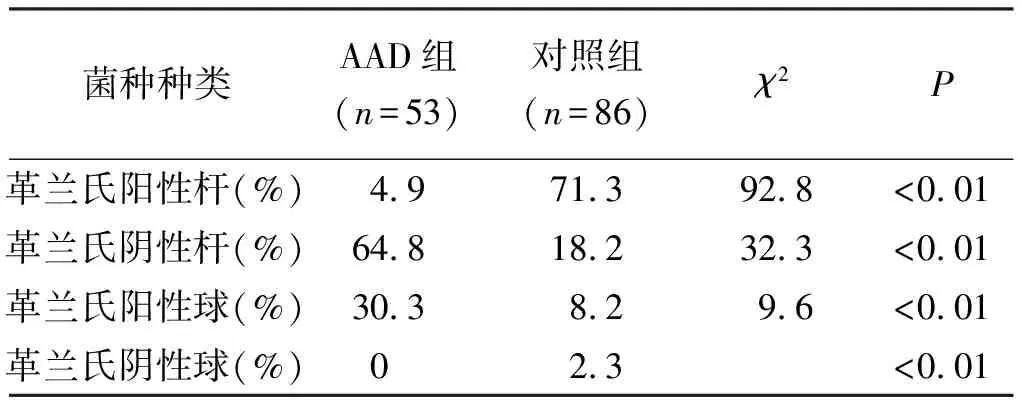
表1 不同组间肠道菌群差异
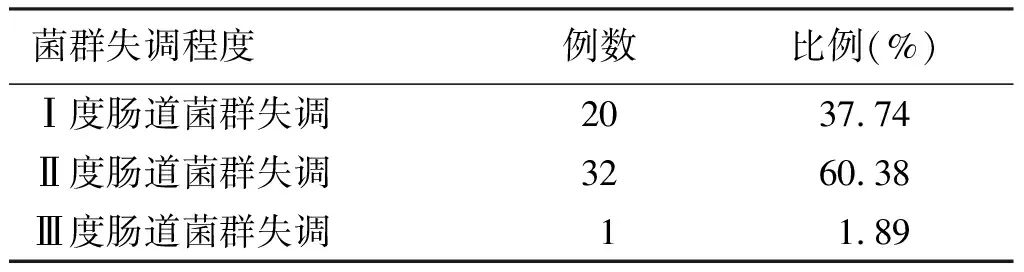
表2 AAD组儿童肠道菌群失调程度和比例
2.3 单因素分析
对AAD组和非AAD组的儿童抗生素使用的种类以及其它危险因素进行比较,结果显示,抗生素的使用种类,使用时间、更换频次以及儿童年龄和营养状况都可能是影响儿童抗生素相关性腹泻的危险因素(P<0.05)。
2.4 多因素ligistic回归分析
将在单因素分析中有统计学意义的数据纳入多因素logistic回归分析,结果显示儿童的年龄(OR=1.861,95%CI:1.803-1.920)、使用抗生素的时间长(OR=1.522,95%CI:1.501-1.543)、使用种类多(OR=2.077,95%CI:2.009-2.148)、使用青霉素和头孢类抗生素(OR=2.751,95%CI:2.735-2.767)以及营养不良(OR=1.699,95%CI:1.621-1.781)是患抗生素相关性腹泻的危险因素。
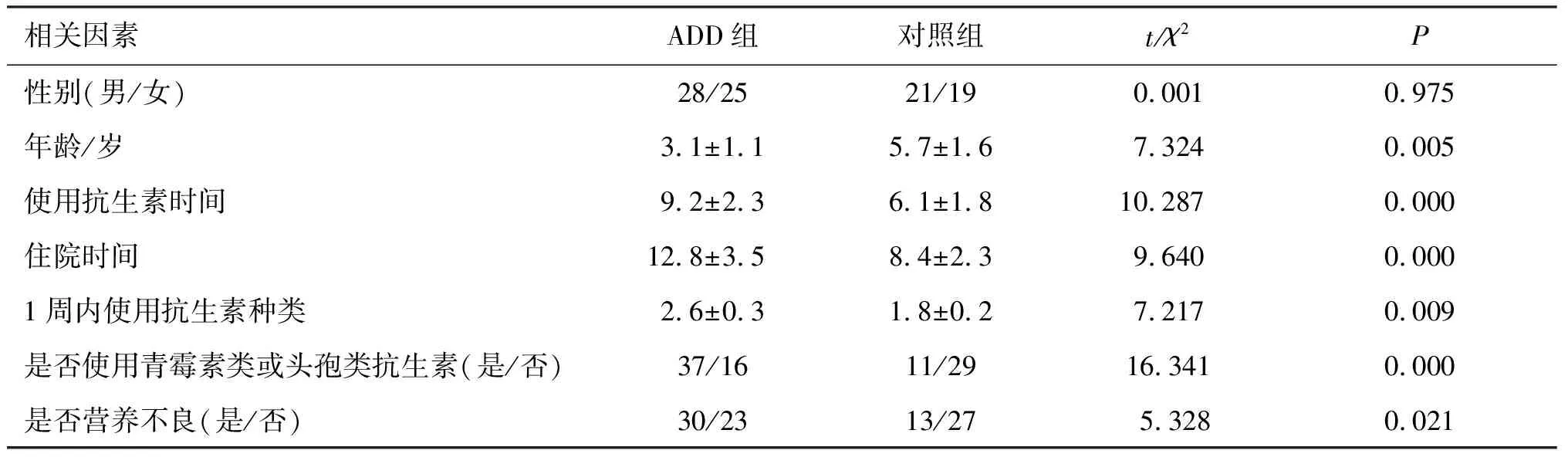
表3 儿童抗生素相关性腹泻危险因素的单因素分析
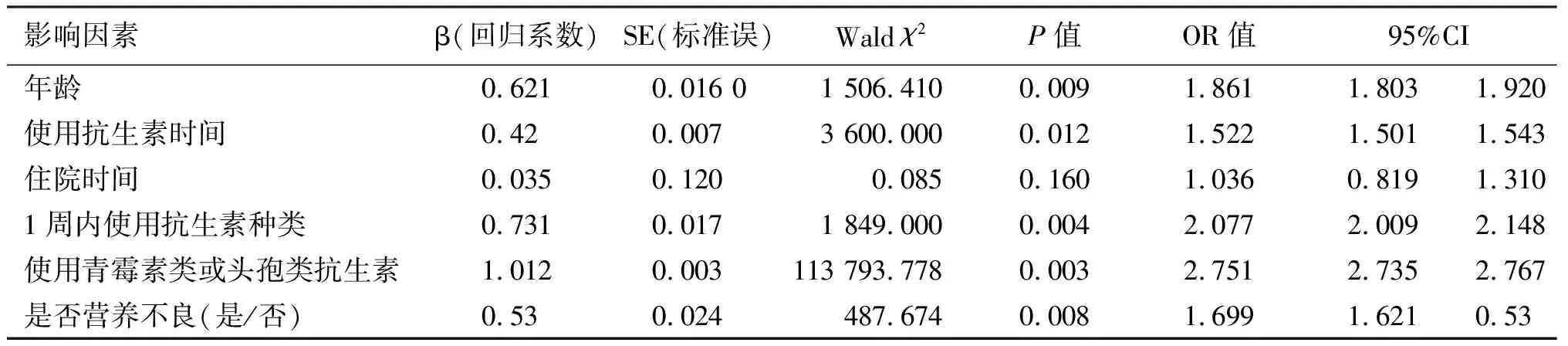
表4 抗生素相关性腹泻多因素logistic回归分析
3 讨论
抗生素相关性腹泻(AAD)是较为常见的药物不良反应,约5%~30%患者在抗生素治疗早期或结束后2个月内会发生AAD[7],其中幼童的发病率更高。AAD的临床症状轻重不一,病程持续时间不一,既可表现为非感染性腹泻,又可呈感染性腹泻甚至结肠炎。临床中出现的儿童AAD多为轻型或普通型的表现形式,严重型AAD并不常见,但是,对AAD的认识和处理不当会导致严重症状,因此,讨论和分析AAD的危险因素十分重要。本次希研究通过对患有AAD儿童和未发生此疾病的儿童进行对比,分析出AAD的危险因素并创新性的比较正常儿童与患病儿童之间的差异,分析肠道菌群对AAD有何影响。
目前多数学者认为AAD与胃肠道菌群紊乱,抗生素干扰糖和胆汁酸的代谢和抗生素的直接作用相关[8-9]。婴儿出身时免疫系统发育不完全,胃肠道处于无菌状态。待出生后进食,细菌才开始在肠道出现,肠道菌群逐渐建立。幼童由于年龄小,肠道内微生态平衡的稳定性较脆弱,容易受各种因素的影响,造成肠道菌群失调[10]。本次研究中发现,AAD患儿与健康的儿童相比,均有不同程度的肠道菌群失调。健康儿童中,双歧杆菌/大肠杆菌(B/E)的比值>10,而AAD患儿的B/E值小于正常标准,肠道内益生菌明显减少。在纳入研究的53,例患儿中,Ⅰ度失调20人,占比37.74%,Ⅱ度失调32人,占比60.38%,Ⅲ度失调仅1人,占比1.89%。抗生素造成肠道菌群失调的原因在于,在进入肠道后,抗生素类药物抑制菌群的生长,促使“正常组合”变成菌群失调的“异常组合”,造成比例失衡,因此科学的使用抗生素是避免儿童肠道菌群失调的关键。
学者Alam S.在对AAD研究后指出,2岁以内婴幼儿发生ADD的概率远高于其他年龄组[11]。而我们在研究中同样发现,儿童的年龄是AAD的危险因素之一(OR=1.861,95%CI:1.803-1.920),低龄的儿童更易发生AAD。原因是儿童时期,肠道微生态系统在动态性演变的过程中,外界因素极易对其造成干扰,且免疫系统较弱。因此,抗生素的使用对低龄儿童的影响更加严重。同时,营养不良的儿童可使患儿消化道黏膜萎缩,消化系统免疫力下降,消化酶活性下降[12],在治疗中也表现出易发生AAD,但目前这一因素相关研究较少,仍需进一步的分析确认。
在多因素logistic回归分析中,我们发现,抗生素的种类对AAD有重要的影响。有文献报道,除胃肠道外用的氨基糖苷类抗生素和万古霉素,几乎所有的抗菌类药物都可诱发AAD,以光谱青霉素类和头孢菌素类最常见[13]。这可能与儿童肠粘膜肌层的发育较差,肠壁薄,因此肠壁通透性高有关[14]。本次研究发现,使用过青霉素类和头孢菌素类的儿童,发生AAD的几率明显较高。光谱抗生素在使用后,不仅打破肠道内微生态平衡,使益生菌数量下降,还会导致肠道对糖的吸收降低,导致糖类聚集在肠道内配合有机酸,发生渗透性腹泻。且某些抗生素是胃动素受体激动剂,刺激胃窦和十二指肠收缩,加速肠道的蠕动速度,引起腹泻[15]。
使用抗生素的种类多(OR=2.077,95%CI:2.009-2.148),使用时间长(OR=1.522,95%CI:1.501-1.543)也是造成AAD的危险因素。陈园贵[15]在研究是发现,联合应用大于2种抗生素且使用时间大于七天,均能够增加AAD的发生率,说明抗生素应用时间过长易导致敏感菌受抑制,耐药菌或霉菌等过度繁殖,引起肠道性炎症。王玉瑛在报告中明确指出,小儿非肠道感染性疾病,在使用抗生素3体内后,59.73%患儿肠道菌群出现改变,10天后达到84.56%,而在应用抗生素15天后,100%患儿的肠道菌群发生变化[16]。何学琴等对抗生素使用种类进行详细的研究后发现,使用1种抗生素者无AAD发生,使用3种抗生素后AAD发生率为71.43%,使用4种抗生素后AAD发生比例高达82.61%[12]。因此在临床上应尽量减少抗生素的使用时长,并避免频繁更换抗生素种类。且目前多位学者发现,对肠道菌群失调的儿童补充微生态制剂如益生菌、益生原、合生元等,可以完善其肠道的微生态系统,减少AAD的发生率[17-18]。
综上,患有抗生素相关性腹泻的儿童肠道内双歧杆菌等益生菌减少,革兰氏阴性菌增加,双歧杆菌/大肠杆菌<10,有不同程度的肠道菌群失调。儿童的年龄、使用抗生素的时间长、使用种类多、使用青霉素和头孢类抗生素以及营养不良是患抗生素相关性腹泻的危险因素。在临床治疗中应谨慎使用抗生素,减少AAD的出现。

