雪上一枝蒿与金不换不同比例配伍的急性毒性研究
王 晶,李 梅,王大贵,黄先菊
(中南民族大学 药学院,湖北 武汉 430074)
雪上一枝蒿AconitumbrachypodumDiels为毛茛科乌头属药材,是短柄乌头的干燥块根,常被民间用来治疗各种疼痛和炎症相关性疾病[1,2],主要毒性成分为双酯类生物碱,服用时未经炮制或炮制不当极易中毒,严重者会引起昏迷甚至死亡,中毒表现主要为心、肝脏毒性和神经系统毒性症状[3,4]。现有的临床解毒方法并不能完全消除乌头类植物所导致的毒性,因此探索雪上一枝蒿的中毒机制,寻求其中毒的安全解救办法,提高安全治疗的窗口期,具有重大的现实和社会意义。
龙胆科黄秦艽属植物金不换VeratrillabailloniiFranch,又名滇黄芩、大苦参、黄龙胆等,以根入药,是云南地方习用中草药[5,6],云南省中药材标准于1974年和2005年版对此药材进行了收载[7],也是纳西族、白族和彝族等少数民族常用中药,具有保肝镇痛、清热解毒的功效[8-10],主要用来退烧、抗炎、治疗胃痉挛、肺热咳嗽、扁桃体炎、胃炎、肾炎、烧伤、跌打损伤等症[11],民间常用其治疗支气管炎、急慢性胃炎、肠炎、烧伤、胃脘胁痛等[12],长期以来被云南当地纳西族和傈僳族广泛使用。本课题组前期研究表明金不换可以中和雪上一枝蒿的急慢性中毒[13,14],二者配伍可能起到减毒增效/存效的作用。
本研究拟采用上下法(Up and Down法)与改良寇氏法分别测定雪上一枝蒿(CFA)与金不换(WVBF)合并与合煎配伍的急性毒性,以评价二者配伍前后的安全性。
1 实验材料
1.1 实验动物
雌雄各半的SPF级昆明小鼠,体重18~22 g,购于湖北省实验动物研究中心,实验动物使用许可证号:SYXK(鄂)2016-0089,实验动物质量合格证号:NO.42816300001233,实验动物设施使用证明编号:NO.00263059。饲养于SPF级小鼠实验室,动物饲养严格按照中南民族大学动物伦理委员会和国际NIH准则进行,实验室温度20~25 ℃,湿度40%~70%,光照或者黑暗条件下让老鼠自由进食。为避免食物干扰,老鼠在实验前12 h禁食不禁水。
1.2 药物与试剂
雪上一枝蒿购于云南大理吉芹中药材经营部,金不换购自云南大理药材市场周盛药材行,由中南民族大学刘新桥博士鉴定为正品。其他试剂均为分析纯。
雪上一枝蒿总生物碱和金不换合并合煎液的提取制备方法:将雪上一枝蒿的量固定为50 g,配伍组金不换分别为10 g、25 g、50 g、100 g和250 g,按5∶1、2∶1、1∶1、1∶2以及1∶5比例配伍,分别用5倍量75%乙醇回流提取30 min,4层纱布过滤,置于55 ℃下减压浓缩至浸膏,冷冻干燥一夜得到供试品,置于干燥器中保存。精密称取0.006 g上述各干燥物,加2 mL色谱级甲醇溶解后过0.45 μm滤膜,得到供试品溶液。
雪上一枝蒿和金不换合煎液高效液相色谱检测条件:WondaSil C18-WR色谱柱(4.6 mm×250 mm,5 μm,日本岛津),流动相甲醇-0.5%三乙胺(66∶34),柱温30 ℃,流速1.0 mL·min-1,检测波长240 nm,检测时间0~40 min,进样10 μL。在色谱图上依据对照品的保留时间,在样品溶液的色谱图上找到相应对照品的谱图峰。见图1。
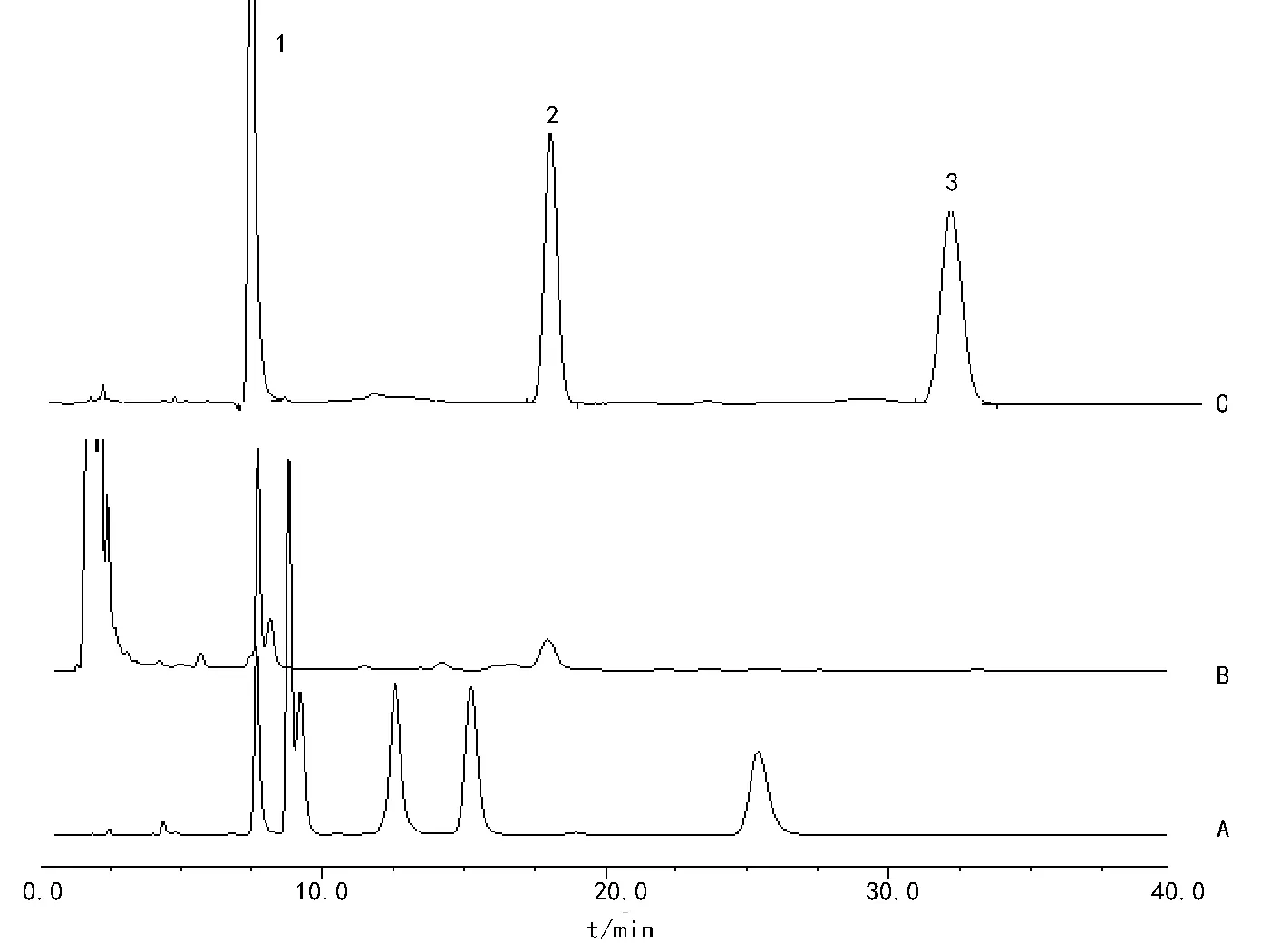
1-苯甲酰乌头原碱;2-新乌头碱;3-乌头碱
2 实验方法
2.1 改良寇氏法测雪上一枝蒿与金不换合煎配伍的LD50
2.1.1 预试验 小鼠适应性喂养3天,先腹腔给药找出每组的上、下限剂量Dmax和Dmin,即100%全死剂量和0%全活剂量(或阳性反应的剂量)[15]。测得雪上一枝蒿单煎液组小鼠的100%和0%致死剂量分别约为450 mg·kg-1和200 mg·kg-1,金不换单煎液组100%致死剂量约为4 400 mg·kg-1,0%致死剂量约为1 800 mg·kg-1,雪上枝蒿与金不换5∶1配伍组100%致死剂量约为860 mg·kg-1,0%致死剂量约为400 mg.kg-1,2:1配伍组100%和0%致死剂量分别为1 750和750 mg·kg-1,1∶1配伍组100%致死剂量约为2 100 mg·kg-1,0%致死剂量约为900 mg·kg-1,1∶2配伍组100%和0%致死剂量约为2 000和800 mg·kg-1,1∶5配伍组100%和0%致死剂量约为4 000和1 500 mg·kg-1。
2.1.2 正式试验 设定剂量间的等比比值i为0.80,上一剂量依次乘以i向下一剂量递减。取350只小鼠(雌雄各半),根据不同配伍将小鼠随机分为7组,即雪上一枝蒿和金不换两个单煎液组,及雪上一枝蒿-金不换 5∶1、2∶1、1∶1、1∶2、1∶5配伍组,根据浓度不同按每个浓度组10只小鼠的方式将每个药物组随机分为5小组,每组小鼠分别按上述等比数列浓度递减的受试溶液以 0.02 mL·kg-1药物剂量一次性腹腔注射。
2.2 上下法测雪上一枝蒿与金不换合并配伍的LD50
2.2.1 限度试验方法和结果 2 000 mg· kg-1剂量水平限度试验:先对1只小鼠进行给药,如果小鼠死亡,则进行主试验;如果小鼠存活,依次对另外4只小鼠进行给药,小鼠总数为5只。如果在试验后期死亡1只小鼠,而其他小鼠存活,则停止对其他小鼠给予受试物,观察全部动物,在相同的观察期内是否也出现死亡。记录试验期间所有死亡的动物,对试验结果作如下评判:有3只或3只以上动物死亡时,LD50小于2 000 mg· kg-1;有3只或3只以上动物存活时,LD50大于2 000 mg· kg-1;如果有3只动物死亡,则进行主试验[16]。本实验室前期研究表明,雪上一枝蒿对雄性动物的毒性更加明显,不同性别老鼠对其敏感性不一样,为了避免性别因素造成的干扰,只选择了雄性小鼠进行实验。
结果:按雪上一枝蒿-金不换比例为10∶1、5∶1、2∶1、1∶1、1∶2、1∶5、1∶10分别以2 000 mg/kg-1给药7只雄性小鼠,7只小鼠死亡,进行主试验。
2.2.2 主实验 默认sigma(级数因子)被固定为0.5,相邻高低剂量间的组距3.2,CFA与WVBF的配比如上,4个不同比例配伍的总剂量从以下序列中选择:1.75、5.5、17.5、55、175、550、2 000 mg· kg-1。若没有待测药物的估计致死量,则先从剂量175 mg· kg-1开始对第1只动物进行给药,如果动物没有死亡,则对第2只动物进行高一剂量给药;如果第1只动物出现死亡或处于将死状态,则对第2只动物给予低一剂量的给药。在此过程中每次仅对1只动物给予药物,时间至少间隔48 h再给另一只,并认真记录动物的活动。当满足停止实验标准之一时:①在最高剂量下连续出现3只动物存活;②6只动物中出现5只连续出现在高一剂量死亡、低一剂量存活的生死转换;③第1只动物出现转换后,至少保证有4只动物能够进入试验,而且其LD50估算值的范围超过临界值(2.5倍)[17]。
2.2.3 指标观察 对小鼠给予受试物后,详细记录每组不同剂量下,在1、12、24、48及72 h小鼠的中毒反应,并记录小鼠死亡数,计算每组小鼠的LD50及其可信限,对死亡小鼠进行大体解剖,肉眼观察并对心、肝、脾、肺、肾、胃等器官做病理分析。
2.3 寇氏法计算方法
记录各剂量组小鼠死亡数n,得出死亡率(P),按改良寇氏法公式计算各组LD50值。
2.4 HE染色
大体检查完毕,将每只动物心脏、肝脏、脾脏、肺、肾脏、胃切下,固定于10%甲醛溶液,常规制片,HE染色,镜下观察,做病理分析。
3 结果
3.1 雪上一枝蒿与金不换合煎配伍的急性毒性
雪上一支蒿单煎液腹腔给药后,小鼠出现短暂的兴奋状态,30~60 min后,小鼠陆续进入抑制状态,部分小鼠出现反胃呕吐、肌肉振颤等中毒症状,并且伴随抽搐,肢体瘫软,大小便失禁等,随着浓度的升高这种现象越明显,最高剂量组1 h内陆续出现死亡,根据12~72 h内死亡情况求得各配伍组小鼠死亡情况如表1。小鼠各组的半数致死量,标准误及95%的可信限结果如表2。其中雪上一枝蒿单煎液的毒性最大,金不换单煎液的毒性最小,并且随着金不换比例的增加毒性越来越低,由于每组药对中雪上一枝蒿的量是固定的,所以可知金不换对雪上一枝蒿的急性毒性具有解毒作用,解毒效果随金不换比例的增高而增强,但是配伍比例为1∶1的毒性稍小于1∶2,可信限有重合的部分,可能是因为动物个体差异所致,但不影响整体趋势。

表1 雪上一枝蒿及金不换各剂量组对小鼠急性毒性的影响
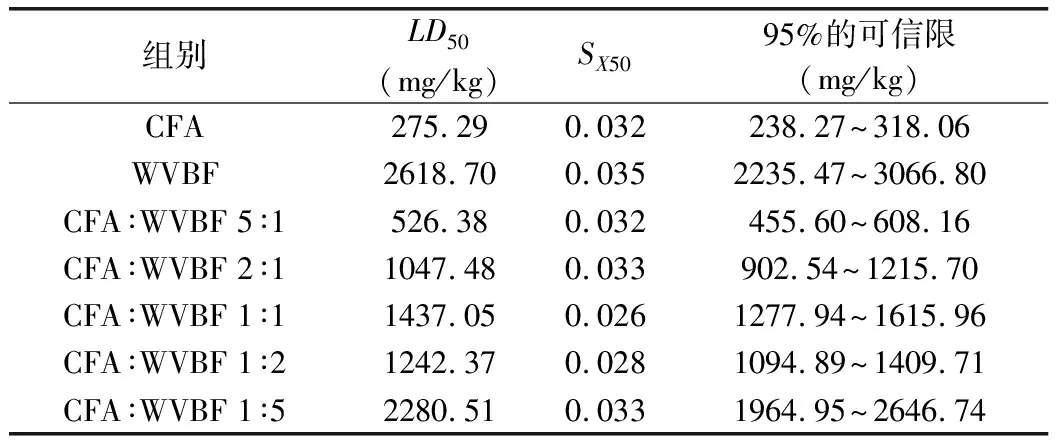
表2 LD50、lgLD50的标准误以及LD50的95%可信限计算结果
未死亡小鼠48 h内精神状态和活动能力逐渐恢复正常。对死亡小鼠进行大体解剖,脏器没有发现明显的异常病变,对5个配比组的心脏、肝脏、脾脏、肺、肾脏、胃做病理分析,病理结果:①心肌组织结构基本正常,心肌细胞排列整齐有序,无明显变性,组织无明显炎症;②肝脏组织整体结构正常或轻度异常,少量肝细胞可见水肿,胞浆疏松,如黑色箭头所示,组织无明显炎症细胞浸润;③脾组织整体结构基本正常,脾小结结构清晰,红髓白髓界限分明,无明显坏死,无明显中性细胞浸润;④肺组织结构不清晰或轻度异常,部分肺泡萎缩塌陷,肺泡壁增厚,肺实质化,如黑色箭头所示,部分肺泡融合扩张形成较大的囊腔,如红色箭头所示,组织无明显炎性细胞浸润;⑤肾组织整体结构轻度异常,部分肾小管刷状缘脱落,且管腔可见少量淡粉色蛋白液,如黑色箭头所示,部分肾小管上皮细胞水肿,胞浆空泡化,如红色箭头所示,部分肾小管管腔可见蛋白液,如黄色箭头所示,组织无明显炎症坏死变性;⑥胃组织整体结构基本正常,黏膜层结构正常,上皮细胞无明显坏死脱落,组织无明显炎症。具体如图2。

A.心;B.肝;C.脾;D.肺;E.肾;F.胃
3.2 雪上一枝蒿与金不换合并配伍的急性毒性
雪上一支蒿给药后的小鼠大部分30 min内呈现如下急性中毒症状:四处攀爬、来回走动,呼吸及运动急促、急躁、打闹等;30 min后逐渐归于平静,并且部分小鼠出现活动能力减弱,行为迟缓、气息薄弱、四肢不调、瘫软等现象。大多数小鼠在给药后12 h内出现异常反应;6 h后部分有异常反应的小鼠可逐渐恢复正常,之后每天观察,隔天记录体重,未出现中毒症状。
CFA-WVBF 5∶1、2∶1、1∶2、1∶5配伍组测算出的LD50分别为55.00、155.77、162.71、174.98 mg·kg-1,说明随着WVBF比例的增加,毒性逐渐下降,因此1∶5配伍组的减毒效果最好。不同比例下小鼠的死亡情况见表3。

表3 CFA-WVBF对小鼠急性毒性的影响
4 讨论
本研究上下法急性毒性试验结果表明,CFA-WVBF四个比例5∶1、2∶1、1∶2、1∶5的LD50依次增加,分别为55.00、155.77、162.71、174.98 mg·kg-1,均大于单独给CFA的LD50(37.991 mg/kg-1)[18],说明CFA与WVBF配伍使用能降低CFA的毒性,同时随着WVBF含量增多,减毒效果增强。
寇氏法急性毒性实验通过病理切片可观察到各组死亡小鼠的心、肝、脾、胃等脏器组织整体结构基本正常,肺和肾脏整体结构轻度异常,各脏器组织均无炎性细胞浸润,没有明显炎症,说明药物对小鼠急性毒性的脏器未造成明显影响。CFA-WVBF 5个配伍组(5∶1、2∶1、1∶1、1∶2、1∶5)测得的LD50分别为526.38、1 047.48、1 437.05、1 242.37和2 280.51 mg·kg。介于雪上一枝蒿(275.29 mg·kg)和金不换(2 618.70 mg·kg)两个单煎液的LD50之间,说明合煎配伍与雪上一枝蒿单煎液相比可以明显降低其诱导的急性毒性,并且金不换的比例越高解毒效果越好。
通过试验可以得出如下结论:雪上一枝蒿与金不换无论合并还是合煎配伍都降低了对小鼠的急性毒性,并且金不换比例越高解毒效果越好,为进一步确定两者配伍后的药效提供了依据。

