红楠炭疽病病原鉴定及其药剂筛选
宋慧云,段志豪,毛子翎,2,孙 思,2,王 军,2,单体江,2*
(1. 华南农业大学林学与风景园林学院,广东省森林植物种质创新与利用重点实验室,广东 广州 510642;2. 华南农业大学,广东省微生物信号与作物病害防控重点实验室,广东 广州 510642)
【研究意义】红楠(MachilusthunbergiiSieb. et Zucc.)属樟科((Lauraceae)润楠属(Machilus)常绿阔叶乔木,在我国大多生长在暖温带和亚热带地区[1]。红楠具有很高的观赏性,可用作木材和土壤保持树种[2]。近年来随着人类活动的增加以及火灾等影响,导致红楠栖息地遭到严重破坏,红楠数量日益锐减,濒临灭绝,目前被列为我国濒危树种[3]。【前人研究进展】近年来,对于红楠的研究主要集中于林间特征[4]、药用价值[5-6]、遗传多样性[3]及红楠生长相关因素[7]等。Gao等[4]使用模型有效地模拟和预测红楠的种内和种间竞争,结果表明当红楠的胸径低于20 cm时,应实现抚育管理,以提高黑松的生存及植被恢复。Su 等[8]从红楠叶中分离出具有体外细胞毒性和抗霉菌真菌活性的精油,并确定了活性源化合物是β-Eudesmol。Watanabe等证实红楠是异源二性的,由两种类型的原始两性花组成[9]。Liu等[10]证实红楠在低盐胁迫条件下,地上生物量略有增加,而地下生物量,根长和根表面积呈下降趋势;在高浓度盐胁迫下,地上生长受到限制,而地下生长则没有受到显著抑制。Li等[1]首次报道了红楠叶枯和枝枯病,并确定致病菌为Lasiodiplodiagilanensis。但关于红楠其他病害的研究报道较少。【本研究切入点】笔者在调查中发现,在红楠生长过程中确实存在其他病害的发生和危害,严重影响红楠的正常生长,但并未见该病害的任何报道。【拟解决的关键问题】本研究以发病严重的红楠为研究对象,采集发病的组织材料,采用组织分离法对病原菌进行分离,进一步通过柯赫氏法则确定致病菌,并通过形态学和分子生物学相结合的方法鉴定病原菌,同时采用菌丝生长速率法筛选出对病原菌具有良好抑制效果的杀菌剂,旨在为红楠病害的识别和鉴定以及病害的综合防治提供重要的理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 红楠发病叶片和健康叶片于2016年12月采自广州市天河区华南植物园。
1.1.2 供试杀菌剂 本试验所有供试杀菌剂均为杀菌剂原药,包括98 %嘧菌酯、96.8 %苯醚甲环锉、97 %嘧霉胺、97 %吡唑醚菌酯、98 %溴菌腈、98 %福美双、98.4 %多菌灵,均以上药剂均购自中国农科院植保所廊坊农药厂。
1.1.3 仪器与试剂 SW-CJ-2G型超净工作台(苏州净化设备有限公司);BX43F生物显微镜(奥林巴斯(中国)有限公司);MLS-3870三洋高压灭菌锅(松下电器产业株式会社);Exceed-C超纯水机(成都唐氏康宁科技发展有限公司); JA2003N分析天平(上海精密科学仪器有限公司);LRH-50型生化培养箱(上海恒科科技有限公司)。
葡萄糖(分析纯,天津市大茂化学试剂厂);琼脂(健阳生物科技有限公司);升汞(天津市富宇精细化工有限公司);Ezup柱式真菌基因组DNA抽提试剂盒(上海生物工程有限公司);引物ITS4和ITS5(上海生物工程有限公司);95 %酒精和二甲基亚砜(DMSO)均为分析纯(天津市富宇精细化工有限公司)。
1.2 方法
1.2.1 症状观察和描述 使用放大镜观察发病的叶片,对病斑进行描述记录,如病斑的位置、大小、颜色、排列等,再对病害植株的生长状态进行观察和描述。
1.2.2 病原菌的分离和纯化 病原菌的分离和纯化参照陈哲等[11]和席中刚等[12]的方法,略有修改。首先将发病的叶片用水冲洗后置于超净台内,剪取发病叶片病健交界处的叶片组织10份,大小约为3 mm× 3 mm,置于75 %酒精中浸泡20 s,再放入0.1 %升汞溶液中浸泡1 min左右,然后用无菌水冲洗3~4次,用灭菌的滤纸吸干表面的水分,接种于准备好的PDA平板上。将接种好的PDA平板放入28 ℃恒温培养箱中培养,待长出菌丝后,用灭菌的牙签挑取菌落边缘生长旺盛的菌丝接种到另一个PDA平板上。重复以上操作3次左右,获得纯化的菌株,然后将纯化后的菌株接种于5 mL冻存管PDA斜面上,于4 ℃冰箱保存。
1.2.3 致病性测定 致病性的测定采用Xu 等[13]的方法。采集健康的红楠叶片,用清水冲洗干净,再用75 %酒精棉球擦拭叶片表面,而后用无菌水清洗3次。在每个叶片中脉两侧制造两个针刺伤口,左右对称,将纯化好的菌丝接种在叶片左边的针刺伤口处,右边的针刺伤口作为对照,每个处理重复3次。将接种好的叶片置于提前铺好吸水纸并加入无菌水的培养皿中,用保鲜膜封住皿口,放入生化培养箱保湿培养。一段时间后,对接种叶片进行观察,记录发病情况。然后从发病叶片的病健交界处进行病原菌的再次分离鉴定,最终确定致病菌。
1.2.4 病原菌的形态学鉴定 用灭菌后的牙签挑取PDA平板上生长旺盛的菌落边缘的菌丝,接种于另一个PDA平板中央,置于生化培养箱中培养5 d,然后用生物显微镜观察菌落的菌丝、分生孢子梗、分生孢子等特征。然后参照《真菌鉴定手册》以及《植物病原真菌学》对分离的病原菌进行形态学鉴定[14-15]。
1.2.5 病原菌的分子生物学鉴定 将纯化后的菌株(在PDA生长5 d)接种到PDB培养基中,28 ℃ 150 r/min振荡培养5 d,四层纱布过滤收集菌丝,用液氮进行充分研磨至粉末状,而后采用真菌基因组DNA抽提试剂盒提取其DNA。使用真菌的通用引物ITS4和ITS5扩增其ITS序列,反应扩增体系为:去离子水21 μl,2×TaqPCR MasterMix(含染料)25 μl,ITS4(10 μmol/L)1 μl,ITS5(10 μmol/L)1 μl,模板 DNA(10 ng/μl)2 μl。PCR扩增程序: 94 ℃预变性3 min,然后94 ℃变性40 s,56 ℃退火40 s,72 ℃延伸1 min 20 s,共30个循环;最后72 ℃延伸10 min。
PCR产物送生工生物工程(上海)股份有限公司完成测序。将测序成功的ITS序列提交至GenBank数据库,获得登录号。通过在NCBI网站上进行Blast,将测序结果在GenBank数据库中进行同源性检索,下载与其相似性较高的序列及其近似属的序列,使用MAFTT version 7进行序列处理后,采用最大似然法(Maximum likelihood),用MEGA 7.0.26软件构建系统发育树,其中Bootstrap method中重复抽样次数(No. of bootstrap replication)设置为500,模式为General Time Reversible Model。
1.2.6 不同杀菌剂对病原菌室内毒力测定 不同杀菌剂对红楠炭疽病病原菌的室内毒力测定采用菌丝生长速率法[16],分别称取不同的供试杀菌剂12 mg,加入0.3 mL的DMSO,待完全溶解后再加入0.7 mL的无菌水,然后用30 %的DMSO采用倍半稀释法依次稀释成7个不同的浓度。将配制好的不同浓度的杀菌剂1 mL加到 29 mL的PDA(灭菌,冷却至60 ℃)中,充分混匀后倒入3个无菌的培养皿中,每皿约10 mL,制成含药培养基,浓度为6.0、3.0、1.5、0.75和0.375 mg/mL,溶剂为30 %的DMSO。将配制好的不同浓度的杀菌剂1 mL加到 29 mL的PDA(灭菌,冷却至60 ℃)中,充分混匀后倒入3个无菌的培养皿中,每皿约10 mL,制成含药培养基,得到供试杀菌剂的终浓度分别为0.4、0.2、0.1、0.05、0.025、0.0125和0.00625 mg/mL。用打孔器将培养5 d且生长良好的待测菌边缘打成直径为7 mm的菌饼,菌饼朝下接种于含药PDA平板上,以加入无菌水的PDA平板为空白对照,以30 %的DMSO阴性对照,98.4 %多菌灵为阳性对照,每个处理重复3次。28 ℃培养5 d左右,待空白对照的菌落生长至培养皿面积的2/3时,采用十字交叉法测得不同处理的菌落直径,计算抑菌率。
抑菌率 =
纯生长量=菌落平均直径-菌饼直径
计算出不同浓度下的抑菌率,选取其中的5个浓度,以杀菌剂浓度的对数值为横坐标,以抑菌率的生物统计机率值为纵坐标,在Origin2018软件中进行数据处理,得到毒力回归方程和回归系数,同时计算出EC50值,比较不同杀菌剂的相对抑制效果。

A:炭疽病症状; B:接种发病状; C:菌落正面; D:菌落背面; E:菌丝形态; F:分生孢子A: Symptom of anthracnose; B: Symptom of inoculation; C: Front side of colony; D: Reverse side of colony; E: Mycelial morphology; F: Conidia
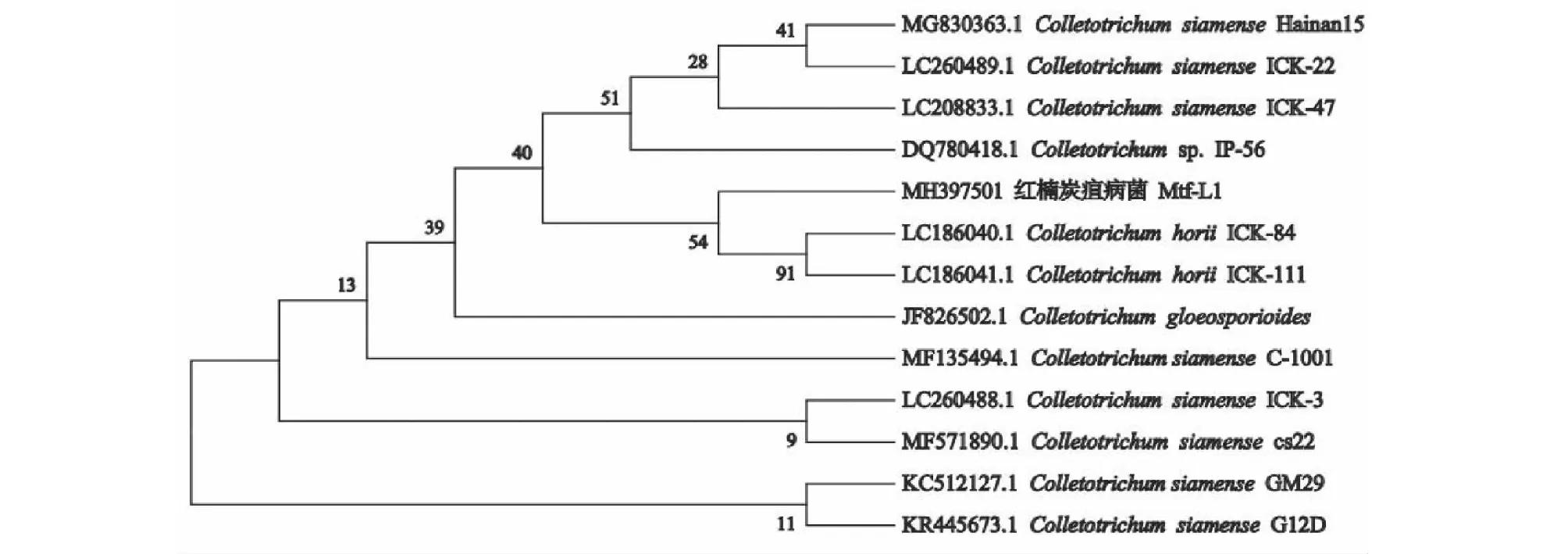
图2 基于ITS序列构建的红楠炭疽病菌Mtf-L1系统发育树系
2 结果与分析
2.1 红楠炭疽病病害症状
通过调查发现该病害主要危害红楠叶片,发病初期,叶片表面出现棕黄色小点,不规则圆形。后期病斑逐渐扩大,中间坏死呈灰褐色,边缘颜色较深,呈红褐色(图1A)。发病严重时,病斑布满整个叶片,导致叶片变黄脱落。
2.2 红楠炭疽病病原菌的分离和致病性测定
对红楠的发病叶片进行病原分离鉴定,得到3种不同的真菌菌株Mtf-L1、Mtf-L2和Mtf-L3。用针刺法将3种菌株分别接到离体健康的红楠叶片。接种3 d之后,接种Mtf-L1菌株的叶片开始发病,叶片接种点出现黑色的病斑并逐渐扩大,症状与自然发病症状类似(图1B左侧),并从发病的病斑上能再次分离可得到与接种菌株形态一致的菌落,对照组织未发病(图1B右侧);而接种Mtf-L2和Mtf-L3菌株的叶片未发病。结果表明Mtf-L1是红楠炭疽病的病原菌。其菌落形态如图1C所示。
2.3 红楠炭疽病病原菌的鉴定
PDA培养基上生长的菌落为圆形(图1C),白色,边缘整齐,气生菌丝发达,排列整齐,毛绒状,菌落背面中部呈浅黄色(图1D)。培养7 d后,菌落长满整个培养基(图1C,D)。在显微镜下可观察到菌丝有隔(图1E),分生孢子无色,单孢,长椭圆形或圆柱形,两端钝圆 ,大小平均为11.95 μm×4.03 μm(图1F)。根据以上形态特征,将该病原菌初步鉴定为炭疽病菌。
采用真菌通用引物ITS4和ITS5进行PCR扩增,获得大小为602 bp的序列,将该序列提交至Genebank,获得登录号为MH397501。在GenBank数据库中进行同源性比对,通过MEGA 7.0.26软件采用最大似然法(Maximum likelihood)构建系统发育树(图2)。从图2可以看出,该病原菌被聚类在炭疽菌属,但无法确定到种,因此最终确定引起红楠叶部病害的病原菌为Colletotrichumsp.,属于半知菌类,黑盘孢目,炭疽菌属。
2.4 不同杀菌剂对红楠炭疽病病原菌的室内毒力测定
不同供试药剂对红楠炭疽病菌的抑制效果见图3和表1。从表1中可以看出,所有供试杀菌剂对红楠甲炭疽病菌均表现出一定的抑制作用,但不同杀菌剂之间存在明显的差异。阳性对照98.4 %多菌灵的抑菌效果最好,在供试浓度下对红楠炭疽病菌的抑制率均为100 %。其次是97 %吡唑醚菌酯,EC50值为(19.74 ± 1.79)μg/mL,98 %的福美双也表现出较好的抑菌活性,EC50值为(55.92 ± 5.34)μg/mL。98.4 %的多菌灵在不同浓度下的抑制率均达100 %,97 %吡唑醚菌酯和98 %的福美双对红楠炭疽病菌的EC50值均小于0.1 μg/mL,说明红楠炭疽病菌对这几种药剂非常敏感;98 %嘧菌酯、98 %溴菌腈、96.8 %苯醚甲环锉和97 %嘧霉胺的EC50值均为(418.64 ± 81.79)、(353.06± 21.45)、(209.08 ± 14.97)、(329.07 ± 21.10)μg/mL,在0.1~1 μg/mL,即红楠炭疽病菌对这几种药剂较敏感。该结果表明,98.4 %多菌灵、97 %吡唑醚菌酯和98 %的福美双在理论上是化学防治红楠炭疽病菌较好的杀菌剂。7种杀菌剂对胶孢炭疽菌的抑制效果由大到小依次为98.4 %多菌灵>97 %吡唑醚菌酯>98 %福美双>96.8 %苯醚甲环锉>97 %嘧霉胺>98 %溴菌腈>98 %嘧菌酯。

表1 杀菌剂对红楠炭疽病菌的室内毒力测定结果
注:EC50值为不同杀菌剂中有效成分的抑制中浓度。

a: 98 %嘧菌酯; b:98 %溴菌腈; c:96.8 %苯醚甲环锉; d:97 %嘧霉胺;e:97 %吡唑醚菌酯; f:98 %福美双; 浓度1~5分别从大依次减小。a: 98 %Azoxystrobin; b: 98 %Bromoacetonitrile; c: 96.8 %Diphenyl ether ring; d: 97 %Pyrimethanil; e: 97 % Pyraclostrobin; f: 98 %Fumeishuang; concentration of 1-5 decrease in order from large
3 讨 论
形态学鉴定和分子生物学鉴定结果表明,红楠炭疽病的致病为Colletotrichumsp.。炭疽菌属(Colletotrichum)病原菌广泛分布于热带、亚热带,该类真菌是全球性的植物病原菌,寄主繁多,可引发各种林木和农作物的炭疽病,造成叶、枝、花、果腐烂等严重症状,影响林木及农产品的质量,造成严重的经济损失[17-18]。Chen等[19]研究发现红富士苹果炭疽病菌为Colletotrichumgloeosporioides,炭疽病的发生严重降低了红富士苹果的质量和产量,造成了严重的经济损失。炭疽病是世界范围内辣椒的毁灭性疾病,其致病菌为C.gloeosporioides和C.truncatum,两者都会导致辣椒大量减产[20]。最新的研究表明该属真菌还可侵染中国的香蕉[21]、猕猴桃[22]和Basellaalba[23],意大利的FeijoasellowianaBerg[24],墨西哥的Crataegusgracilior[25]以及格鲁吉亚的芹菜[26]等。本研究确定红楠是炭疽病菌的新寄主,通过观察致病菌的显微形态和基于ITS序列构建系统发育树确定致病菌属于炭疽菌属。由于炭疽菌属种类繁多,有些物种缺乏模式标本,使得菌种的鉴定愈发困难。目前,采用多基因进行系统学分析已成为炭疽菌物种鉴定的趋势,通过ITS、ACT、Apn2、Mat1 /Apn2、GAPDH、CHS-1、TUB2、CAL和 ApMAT 等的基因序列对炭疽菌进行鉴定[27-30],这也是本研究努力的方向及未来研究的重要课题。
为了筛选抑制红楠炭疽病菌生长的杀菌剂,为红楠炭疽病的防治提供依据,本研究测定了8种杀菌剂对红楠炭疽病菌的室内毒力,筛选出福美双、吡唑醚菌酯和多菌灵3种有效抑制红楠疽病菌的杀菌剂。福美双属于二硫代氨基甲酸盐类农药,具有低毒广谱杀菌作用,广泛用于水果与蔬菜的病虫害,马珂[31]研究发现福美双可有效抑制茄子褐纹病菌(Phomopsisvexans),邓之亮等[32]研究发现福美双可有效防治棉花立枯丝核病菌(Rhizoctoniasolani)。但是,福美双的残留不可忽视,其毒性逐渐引起研究人员的重视,相关研究表明福美双会造成斑马鱼早起原始生殖细胞移动分布的延迟,以及诱导细胞凋亡,也会造成肉鸡胫骨软骨发育不良软骨细胞凋亡[33-34]。何炼等[35]和王敏等[36]研究发现福美双在川麦冬和豆芽根部的残留量正常,所以在病害防治中应合理使用福美双,在正常残留范围内达到最好的防治效果。吡唑醚菌酯应用范围较广,可防治多种真菌性病害(如子囊菌、担子菌、半知菌和卵菌的真菌引起的病害),同时具有内吸传导性和耐雨水冲刷性能,持效期较长[37]。多菌灵作为商品化的杀菌剂,化学性质稳定,高效低毒,对半知菌、子囊菌引起的多种真菌性病害有较好的防治效果,主要是通过干扰脱氧核糖核酸(DNA) 的合成,特别是阻碍核苷的生成过程起到杀菌作用[38]。近些年,研究人员陆续使用多种杀菌剂对炭疽菌进行内毒力测定,其中吡唑醚菌酯和苯醚甲环唑对枣炭疽菌有较好的抑制作用[39];吡唑醚菌酯对辣椒炭疽菌有较好的抑制作用[40],以上结果与本试验的结果类似。本试验采用菌丝生长速率法进行室内毒力测定,它代表了杀菌剂与病原菌的菌丝直接接触时产生的效果,但实际的抑制效果的不仅与此因素有关,还与孢子的产生、萌发等及杀菌剂的特效性有关;另外寄主植物的生长环境,如温度、湿度等因素,也是影响抑制效果的一个重要因素[41]。因此在后续研究中,可将福美双、吡唑醚菌酯和多菌灵,进行林间药效进一步测定,同时测定福美双的残留量,为植物病害防治提供科学依据。
4 结 论
采用组织块分离法分离引起红楠炭疽病的病原菌,并通过形态学和分子生物学相结合的方法以及病害症状观察和柯赫氏法则,确定红楠炭疽病的致病菌是Colletotrichumsp.,本论文是首次关于红楠炭疽病的报道。同时室内毒力测定结果表明,98.4 %多菌灵、97 %吡唑醚菌酯和98 %福美双对红楠炭疽病菌菌丝生长的抑制作用最强,可作为防治红楠炭疽病的化学杀菌剂,本论文也是首次关于不同杀菌剂对红楠炭疽病菌的室内毒力测定的报道。

