雨生红球藻UVR8的基因克隆和生物信息学分析
张宏江,杭 伟,马浩天,王晓丹,李润植,崔红利
(山西农业大学分子农业与生物能源研究所,山西 太谷 030801)
【研究意义】植物的生长离不开阳光照射,植物在利用太阳光进行光合作用的同时必然会受到紫外光的辐射,从太空照射至地球的紫外光只有少部分的中波紫外光(UV-B, 280~320 nm)与长波紫外光(UV-A, 320~400 nm)[1]。其中,中波紫外光对植物的生长具有双重效应,研究表明,高强度(HF>10 kj·m-2)的UV-B照射会使植物细胞产生大量活性氧分子,从而对植物细胞内的生物大分子如DNA、蛋白质、脂类物质等造成伤害,影响植物的正常生长发育;而低强度(LF >1~5 kj·m-2)的UV-B则是植物生长的信号调控因子,如抑制植物下胚轴的伸长,提升类黄酮等化合物的合成[2]。【前人研究进展】卢克欢等研究发现经过UV-B处理后颠茄的光合作用能力及生物碱的积累受到抑制[3];Vandenbussche等发现适当的UV-B辐射拟南芥会影响其生长素分布,从而调节叶片的发育,而高强度的辐射则会影响叶片的正常发育[4];杜照奎等发现随着UV-B强度的增强,花生叶片的PSⅡ活性受抑制愈加明显[5]。由此科学家推测在植物体内肯定存在能感知UV-B的光受体[6]。中波紫外光UV-B光受体最早发现于一株对UV-B特别敏感的拟南芥突变体uvr8-1[7],在此基础上分离获得UVR8蛋白,证实UVR8就是UV-B的光受体[8]。UVR8不同于其他光受体,它不能结合其共价修饰基团来吸收特定波段的光。由于UVR8的最大吸收峰(280~315 nm)与色氨酸的最大吸收峰(280 nm)相近,因此Brown等推测其可能利用特定的色氨酸残基作为其发色团[9]。研究表明,拟南芥UVR8内含有14个色氨酸残基,1个分布在C末端,6个分布在β-片状螺旋结构部位,其余7个分布在二聚体接触部位。目前对于UVR8介导的信号通路研究已日渐深入,其调节基因表达的一般机制如图1所示:紫外光受体UVR8在无紫外光照射时以二聚体形式存在于细胞质中,二聚体依靠两个单体之间的盐桥连接[8],盐桥的稳定依靠精氨酸(Arg)、天门冬氨酸(Asn)、色氨酸(Trp)和谷氨酸(Glu)来维持,受到紫外光照射后,盐桥解体,二聚体解聚以单体形式向细胞核中富集[10],并且与COP1发生相互作用,从而抑制COP1对HY5的降解[11-12],并且可以促进MYB转录因子的表达[13];UVR8介导的正反馈机制过度表达会激活其负反馈机制的调节,光形态发生的抑制因子RUP1/RUP2和STO/BBX24会进行转录,从而抑制UVR8与COP1的相互作用,从而抑制HY5的表达。当失去紫外光照射时,UVR8蛋白的两个单体又再次形成二聚体[12]。研究发现,来源于高等植物及绿藻等不同物种中的UVR8蛋白在氨基酸序列水平上具有极高的相似性,尤其是盐桥结构中的色氨酸和精氨酸形成的高度保守结构域,暗示不同物种来源UVR8s可能具有相同的分子作用机制[14-17]。这种氨基酸序列水平的保守性可能与早期光合藻类植物生存环境中存在高强度的UV-B有较大关系。因此,UVR8可能在早期的光合藻类植物中就已经形成,深入探讨UVR8的进化需要分析原始藻类植物的基因组序列[6]。同理,说明在雨生红球藻体内同样存在UVR8的基因,但尚未见研究报道。雨生红球藻(Haematococcuspluvialis)是一种单细胞绿藻,属团藻目,红球藻科,是目前公认的天然虾青素的理想来源[18]。虾青素(Astaxanthin)是一种超强的天然抗氧化剂,对细胞内氧自由基清除效果明显,具有延缓皮肤衰老,防止紫外辐射以及预防心血管疾病等功效[19]。在正常培养条件下,雨生红球藻为绿色游动细胞,在不利生长条件下(如高光,高温,营养成分缺乏),雨生红球藻由绿色游动细胞变为红色厚壁孢子,虾青素在红色孢子状态下大量积累[19],可达细胞干重的4 %。研究表明,紫外光照射可显著提高雨生红球藻虾青素含量[20-21]。但具体分子机制尚不清楚,藻细胞如何感知并转导紫外光信号,如何激活虾青素合成相关基因的表达。【本研究切入点】本文以雨生红球藻为研究对象,通过同源克隆和RACE结合的方法获得雨生红球藻HaeUVR8基因的cDNA 全长,并利用生物信息学技术对其理化性质、高级结构及其功能域进行预测。【拟解决的关键问题】以期为雨生红球藻中紫外光受体蛋白HaeUVR8的功能研究以及对雨生红球藻中虾青素的积累机制解析奠定基础。

1.COP1:Constitutively photomorphogenic 1; 2.HY5:Elongated hypocotyl 5; 3.HYH:Hypocotyl 5 homolog; 4.SPA:Suppressor of PHYA-10; 5.STO/BBX24:Salt tolerance/b-box zinc finger protein 24; 6.RUP:Repressor of UV-B photomorphogenesis
1 材料与方法
1.1 供试材料
1.1.1 实验材料 本实验所用雨生红球藻藻种为购自 Dunstaffnage Marine Laboratory 的品种Flotow 1844。藻种接种在BBM培养基保存于光照培养箱中(山西农业大学分子农业与生物能源研究所藻种库)。培养箱光照强度设置为25 μmol·m-2s-1,温度设置为(23±1) ℃,光/暗培养周期为12 h/12 h,且每8 h摇晃1次。本实验所用大肠杆菌菌种为Top 10。
1.1.2 实验设备 高温灭菌锅Panasonic MLS-3781L日本松下健康株氏会社;超净台Boxun BJ-CD上海博迅;光照培养箱 BIC-400 上海博讯;电泳仪、凝胶成像仪、PCR仪 BIO-RAD 美国;旋涡振荡器XH-C泰州迈兴康;离心机ALLEGRA X-30R美国;恒温水浴锅HWS 12 型上海皖宁;移液枪Eppendorf德国;分光光度计Nano Drop 2000赛默飞世尔科技公司。
1.1.3 实验试剂 本实验所需试剂盒:总RNA提取试剂盒、RNA反转录试剂盒、SMARTerTMRACE盒、PCR试剂盒、DNA凝胶回收试剂盒及pMD-18T测序载体等均购于TaKaRa Bio生物公司。本实验所需化学试剂:异丙醇购于上海富蔗化工有限公司,无水乙醇、氯仿购于上海诚心化工有限公司,琼脂糖购于北京瑞达恒辉科技发展有限公司。
1.2 试验方法
1.2.1 总RNA的提取 雨生红球藻总RNA的提取按照所购试剂盒上步骤进行。为避免污染样品,实验过程中所需的试管,量筒,研钵等需在180℃ 下烘烤8 h以上,所需离心管均为提RNA专用无菌无酶的离心管。具体实验步骤如下:①取50 mL藻液12 000 r/min 离心10 min,弃上清,PBS 缓冲液重悬浮,重复3~4次,移液枪吸取剩余上清,并及时将离心管放于液氮中保存。②10 s后将藻体转移到预冷的研钵中,加液氮快速充分研磨,将粉末转移至1.5 mL 离心管,加入1 mL 的RNAiso plus,在漩涡器上震荡均匀,然后将样品室温放置5 min。③加0.2 mL的氯仿,盖好管盖,震荡至均匀,室温放置3 min。④12 000 r/min,4 ℃,离心15 min。将上层无色水相转移至新的离心管中。⑤在离心管中加入等体积的异丙醇,震荡摇匀,-20 ℃静置30 min。⑥12 000 r/min,4 ℃条件下离心10 min,弃上清。⑦加入1 mL提前用无RNase的ddH2O配置好的75 %的酒精洗涤沉淀。⑧5000 r/min,4 ℃条件下离心3 min,弃上清,注意不要倒出沉淀,用移液枪小心吸出剩余少量液体。⑨室温下晾3~5 min 至干燥,加入适量DEPC处理过的ddH2O,反复吹打混匀,充分溶解RNA。⑩测定RNA的浓度和纯度,同时利用电泳仪进行电泳检测。将提取到的RNA放在-80 ℃冰箱保存。
1.2.2 模板的制备 雨生红球藻cDNA模板的制备按照所购试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser)步骤进行。RACE模板的制备按照所购试剂盒(SMARTerTMRACE cDNA Amplication Kit)上步骤进行。
1.2.3 引物设计 雨生红球藻UVR8基因引物的设计是通过对莱茵衣藻(C.reinhardtii)、团藻(V.carteri)、小球藻(C.variabilis)、胶球藻(C.sp.C-169)等4种与雨生红球藻相近藻种中的UVR8基因进行序列比对,找出其保守的氨基酸序列,然后通过CODEHOP软件设计引物。RACE引物是根据同源克隆片段所设计,由上海生工生物工程公司合成。表1所示为所设计引物信息。
1.2.4 同源片段的获得 通过PCR扩增的方法获得雨生红球藻中的同源片段。反应体系按照试剂盒说明进行配置,其中模板为1.2.2中合成的雨生红球藻 cDNA,引物为1.2.3中设计的同源克隆引物。PCR反应条件为:阶段一,94 ℃预变性 5 min ;阶段二,94 ℃变性 30 s,55 ℃退火 30 s,72 ℃延伸 60 s,30个循环;阶段三,72 ℃延伸 7 min。循环终止后,取 3 μl PCR 扩增产物于1 %琼脂糖凝胶电泳 25 min,将长度相符且条带清晰的PCR产物进行后续的转化和测序。

表1 文中用到的引物信息
1.2.5 全长的获得 雨生红球藻UVR8 基因全长的获得通过RACE技术完成。引物为1.2.3中设计合成的RACE引物,模板为1.2.2中获得的cDNA序列,按照SMARTerTMRACE盒上说明进行PCR。将获得的PCR产物于1 % 琼脂糖凝胶电泳进行检测,根据检测结果挑选阳性克隆进行测序。
1.3 生物信息分析
通过DNAStar SeqMan 软件对中间以及5’和3’端RACE片段进行拼接获得雨生红球藻UVR8基因cDNA序列全长;通过序列处理在线工具包(SMS)(http://www.bio-soft.net/sms/)将获得的HaeUVR8基因翻译成氨基酸,并通过 ORFfinder 软件(https://www.ncbi.nlm.nih.gov/orffinder/)对目的基因的开放阅读框进行查找;先用 Clustal W 软件对多序列进行比对分析,再通过软件PhyML 及MEGA 绘制进化树。理化性质分析通过软件 ProtParam 完成,信号肽进行预测通过 SignalP 4.1 软件完成;然后利用 TMHMM 软件对HaeUVR8蛋白跨膜结构域进行分析。HaeUVR8 蛋白的保守结构域通过NCBI的CCD(https://www.ncbi.nlm.nih.gov/cdd/)在线软件以及本地软件 SMART 进行预测分析。
2 结果与分析
2.1 总RNA的提取和基因克隆
如图2所示,从上往下共3个条带,依次是28S rRNA、18S rRNA和5S rRNA,前两条带带型清晰,第三条带较模糊,说明所提RNA完整性较好,未发生明显降解。微量分光光度计(NanoDorp 2000)检测所提RNA浓度及纯度,结果显示,所得RNA浓度是850 ng/μl,波长A260/A280数值在1.8~2.0之间,波长A260/A230数值在1.9~2.0范围内。说明所提RNA质量较好,可进行后续实验。
2.2 HaeUVR8蛋白cDNA序列
在同源克隆基础上利用RACE方法获得了雨生红球藻中编码紫外抗性蛋白的cDNA 序列(HaeUVR8, NCBI 注册号:KT354897)的全长(图3)。该序列全长2187 bp,编码区从144~1697共1554 bp,编码517个氨基酸,5’端非编码区(5’-UTR)和3’端非编码区(3’-UTR)长度分别为143、490 bp,且带有poly A尾巴结构。利用BLASTp程序对所获得的HaeUVR8蛋白与其它物种中的UVR8蛋白进行比对分析,发现与拟南芥中的UVR8基因相似性达到51 %,与莱茵衣藻中UVR8基因相似性可达59 %。图3中黑色标注区域为雨生红球藻中UVR8基因中的7个RCCI结构域,灰色标注为14个色氨酸残基,这与拟南芥中的UVR8基因相似。
2.3 HaeUVR8蛋白基本理化性质分析
ProtParam 软件分析结果显示,雨生红球藻中UVR8蛋白分子式为C2385H3716N690O732S17,该蛋白质分子量为54.31 kD,等电点pI为5.56。编码该蛋白的氨基酸共有20 种,其中含量较高的氨基酸为甘氨酸(Gly, 15.1 %)、亮氨酸(Leu, 9.9 %)、丙氨酸(Aly, 8.7 %)和缬氨酸(Val, 8.1 %),而甲硫氨酸(Met)和酪氨酸(Tyr)含量偏低,分别为1.2 % 和 1.4 %。带负电荷的氨基酸残基总数(Asp+Glu)共51个,带正电荷的氨基酸残基(Arg+Lys)共36个。蛋白质不稳定系数为31.77,为稳定蛋白。软件 SignalP 4.1 预测结果显示编码雨生红球藻UVR8蛋白的氨基酸序列中没有信号肽序列。 TMPred 和 TMHMM 软件结果显示雨生红球藻UVR8蛋白中没有跨膜结构域,是可溶性蛋白。TargetP 1.1 预测结果显示目的蛋白定位于细胞质。

M:DNA标准分子量;1~2:所提RNA样品;3:代表 3′RACE产物;4:5′RACE产物;5:开放阅读框的产物;6:同源克隆产物

图3 雨生红球藻中编码UVR8的核苷酸序列和氨基酸序列
2.4 HaeUVR8蛋白二级结构及三级结构分析
SOPMA预测结果显示目的蛋白中无规则卷曲所占比例最高(44.87 %),其次为延伸链(23.40 %),此外,α-螺旋和β-折叠分别占21.28 % 和10.44 %。因此,雨生红球藻UVR8蛋白的二级结构主要由无规则卷曲和延伸链组成,为混合型蛋白。利用在线软件SWISS-MODEL(https://swissmodel.expasy.org/)通过同源建模的方法对雨生红球藻UVR8蛋白高级结构进行了预测,结果(图4)显示,雨生红球藻UVR8蛋白与拟南芥相同,都含有7个保守的叶片螺旋结构,7个片状螺旋纵向排列并围成环状结构,中间区域形成充水通道。
2.5 HaeUVR8蛋白系统进化分析
紫外抗性蛋白UVR8最先在拟南芥中发现,然后在高等植物及真核绿藻中相继被发现,为进一步研究UVR8蛋白的系统进化,从NCBI数据库中获得12个物种的UVR8蛋白氨基酸序列并通过PhyML及MEGA软件对多序列进行比对及系统进化分析。分析结果(图5)表明,雨生红球藻(HaeUVR8)与其他5株藻种团藻(VcaUVR8)、莱茵衣藻(CreUVR8)、胶球藻(CsuUVR8)和小球藻(CvaUVR8)聚为一支为绿藻门;拟南芥(AthUVR8)、亚麻荠(CsaUVR8)及油菜(BnaUVR8)聚为一支为十字花科植物;蓖麻(RcoUVR8)、南瓜(CmoUVR8)、胡桃(JreUVR8)、月季(RchUVR8)聚为一支为豆类植物,且与十字花科植物形成姊妹群;小立碗藓(PpaUVR8)自为一支。
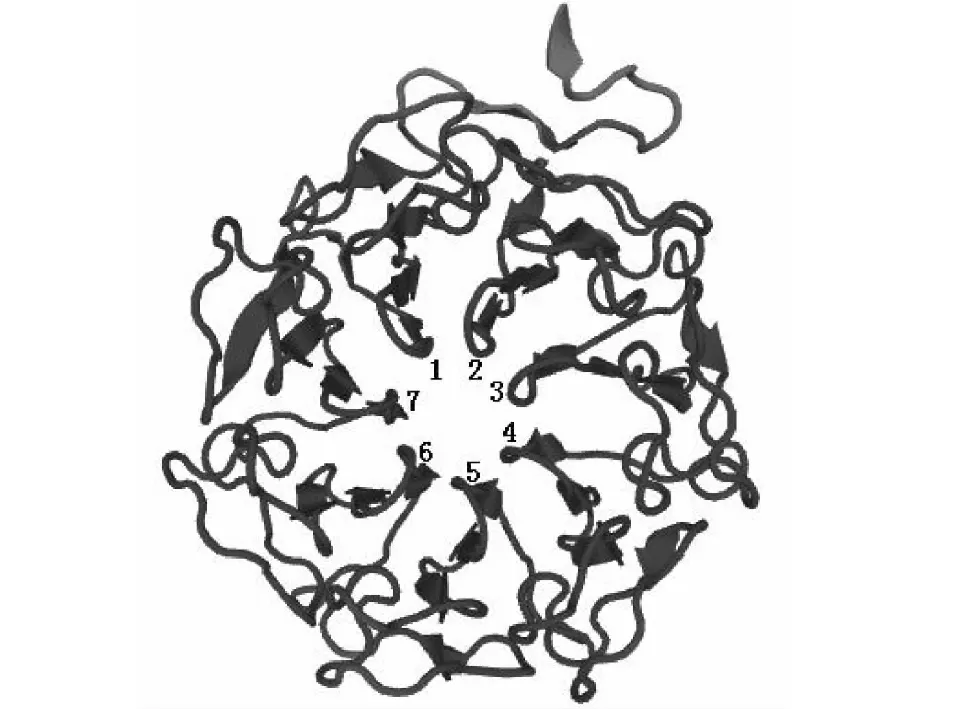
图4 HaeUVR8蛋白高级结构预测

图5 HaeUVR8蛋白系统进化分析
2.6 HaeUVR8蛋白保守域及磷酸化位点分析
对雨生红球藻UVR8蛋白的保守域分析结果(图6A)显示,HaeUVR8蛋白中共存在7个重复的RCCI家族结构域,是紫外抗性蛋白家族的典型特征。为了对雨生红球藻中UVR8蛋白的保守结构域进一步研究,对与其同源性相近的4株微藻物种(CreUVR8,CsuUVR8,CvaUVR8,VcaUVR8),苔藓(PpaUVR8)以及拟南芥等7株高等植物中的UVR8s蛋白进行序列比对发现,7株高等植物引物以及苔藓中都含有3个“GWRHT”(图6B矩形框选区域)基序,而5株绿藻品种中仅含有2个“GWRHT”基序,第1个基序中的苏氨酸“T”被丝氨酸“S”取代(图6B第一个矩形框选区域),图中序列下方五角星表示3个色氨酸残基(W221,W273,W325)与相邻功能域中的色氨酸(W82)形成稳定的“金字塔”结构;图中序列上方三角形代表对维持紫外抗性蛋白二聚体盐桥起重要作用的精氨酸(R274,R326)。软件Scansite 3.0 对雨生红球藻UVR8蛋白可能的磷酸化位点进行预测分析,分析结果(图6C)显示,第2个RCC1结构域中包含2个磷酸化位点(T131和T145);第5个包含1个磷酸化位点(T276);第6个包含2个(S284,S328);第7个存在1个磷酸化位点(S336),在RCCI结构域之外还存在1个磷酸化位点(P416)。
3 讨 论
紫外光UV-B是植物调节自身生长发育过程中一个极重要的环境信号,对植物的生长有着双重效应[2]。UVR8作为目前已知唯一的一个紫外光受体在植物体光形态建成过程中发挥着信号接收与信号转导的重要桥梁作用。UVR8最早在拟南芥中发现,目前对于拟南芥中UVR8的研究表明,UVR8介导的中波紫外光UV-B可对植物体多种生理过程进行调控[4-6],这为雨生红球藻中UVR8蛋白的调控网络研究提供了线索。

蛋白质的磷酸化是蛋白质在翻译后对蛋白质进行修饰的最重要也是最基本的机制。通过对雨生红球藻UVR8蛋白的磷酸化进行分析发现,该蛋白共存在7个可能的磷酸化位点且分布不均匀,其中6个分布在RCC1结构域上,另外一个分布在RCC1结构域之外。HaeUVR8蛋白的系统进化分析结果显示,5株真核绿藻为一个分支,小立碗藓与其他几株高等植物为一个分支,这一分析结果与物种之间的进化树相符合。
研究表明,用不同剂量紫外光对雨生红球藻进行辐射发现藻体内各种色素以及SOD酶活性都有所增加[20]。目前对于紫外光受体的研究主要集中在高等植物拟南芥中,但UVR8介导的光信号转导体系仍有许多问题待研究,因此本实验从雨生红球藻UVR8出发对其进行了生物信息分析,以期为今后更深入研究UVR8蛋白响应UV-B的分子机理做出一定的参考。
4 结 论
本实验将同源克隆与RACE技术相结合,首次获得了雨生红球藻中紫外光受体UVR8的cDNA序列全长,并对其进行了生物信息学分析。HaeUVR8蛋白分子式为C2385H3716N690O732S17,分子量为54.31 kD,编码区全长1554 bp,共编码517个氨基酸,预测的理论等电点为5.56,蛋白质不稳定系数为31.77,属于稳定蛋白。在HaeUVR8蛋白中共发现7个RCC1结构域,2个RCC1_2结构域,7个保守的叶片螺旋结构,3个稳定的“GWRHT”基序,存在2个由特定氨基酸(W221,W273,W325与W94)组成的“金字塔”结构,这些都与拟南芥等高等植物相似,暗示HaeUVR8的作用机理同其他高等植物相似。本实验为进一步深入了解雨生红球藻中紫外光受体蛋白的作用机制提供了参考。

