间质性肺病小鼠循环纤维细胞与血清KL-6的相关性
王慧选 徐敏纹 鹿莉 殷寒秋 殷松楼 马华
(徐州医科大学附属医院风湿免疫科,江苏 徐州 221000)
间质性肺病(ILD) 是以不同程度的肺泡炎症和肺纤维化为病理特征的一类肺部疾病。约1/3的ILD患者继发于结缔组织疾病,ILD常导致肺功能降低,5年生存率为20%〔1〕。已知成纤维细胞在ILD病理发生发展中具有重要作用,循环纤维细胞是成纤维细胞的重要来源之一〔2〕。虽然有研究将循环纤维细胞作为ILD的生物学标志物〔3〕,但尚未得到广泛共识。血清Ⅱ型肺泡表面抗原(KL)-6糖蛋白为ILD病理进展和预后的生物学标志物〔4,5〕。本实验观察博来霉素(BLM)诱导的ILD 小鼠不同病程阶段外周血循环纤维细胞数量和KL-6浓度的关系。
1 材料和方法
1.1材料 9~10周龄SPF级雌性昆明小鼠40只(购于徐州医科大学实验动物中心),重量(20.00±0.93)g。戊巴比妥钠购于北京索莱宝科技有限公司;BLM针剂为日本化药株式会社,15 mg/支;固定与透膜试剂盒、Percp 标记抗小鼠 CD45 购自BD公司;兔抗小鼠Ⅰ型胶原蛋白(ColⅠ)抗体购自Rockland 公司;荧光素(FITC)标记的山羊抗兔免疫球蛋白(Ig)G购自上海贝博生物;小鼠KL-6酶联免疫分析试剂盒购自上海信帆生物科技有限公司;Masson染色试剂盒和羟脯氨酸试剂盒购自南京建成生物工程研究所;流式细胞仪为BD LSRFortessaTM Cell Analyzer。
1.2分组与模型建立 实验小鼠随机分为模型组(A组)和对照组(B组)各20只。适应性饲养后腹腔注射0.3%戊巴比妥钠溶液(30 mg/kg),麻醉后切开颈部逐层分离组织暴露气管。A组用1 ml注射器吸取5.0 mg/kg的BLM溶液,缓慢滴入气管,滴入过程中将小鼠直立,使BLM溶液在肺内分布均匀,同时观察小鼠呼吸情况。B组小鼠经气管滴入等体积的生理盐水作为阴性对照。
1.3循环纤维细胞检测 两组均在BLM给药后第7、14、21、28天眼球取血法各处死5只,取200 μl肝素钠抗凝血于流式管中,CD45单抗25 ml(0.02 mg/ml),涡旋器震荡混匀,室温避光孵育15 min;离心机2 000 r/min离心5 min后,加入固定透膜液500 μl(1∶1),4℃孵育20 min;每管加透膜洗涤液1 ml(1∶10),2 000 r/min离心5 min,弃上清,重复上述操作1次;每管加兔抗小鼠ColⅠ抗体2 μl(0.01 mg/ml),4℃避光孵育30 min,洗涤2次;每管加FITC 标记的山羊抗兔抗体27 μl(0.04 mg/ml)于管底,4℃避光孵育30 min,洗涤2次后,最后以300 μl磷酸盐缓冲液(PBS)重悬细胞。流式细胞仪检测,每管获取1×105个细胞,原始数据采用FloJo-V10软件处理。
1.4血清KL-6检测 将取得的全血8 000 r/min离心5 min,取血清。按小鼠KL-6酶联免疫分析试剂盒说明书进行操作,用酶标仪在450 nm波长下测定吸光度,通过标准曲线计算样品中KL-6浓度。
1.5肺组织炎症、纤维化程度的病理学分析 右肺组织经4%多聚甲醛通用型组织固定液固定、脱水、石蜡包埋,石蜡切片机制作3 μm的石蜡切片,常规苏木素-伊红(HE)染色及按照Masson染色试剂盒说明书进行染色。观察肺组织炎症改变,观察肺组织胶原沉积情况。肺部炎症评分:0分为无炎症细胞,1分为少量炎症细胞,2分为轻度炎症,3分为中度炎症,4分为重度炎症;肺部纤维化评分采用Ashcroft半定量法〔6〕:0分为正常的肺组织;1分为肺泡或细支气管壁轻微增厚;3分为细支气管壁或肺泡壁增厚,肺泡结构无明显破坏;5分为纤维化程度增加,肺泡结构受到一定程度的破坏,有小纤维团形成;7分为肺泡结构受到严重破坏,大面积纤维化;8分为肺几乎完全纤维化(2、4、6分为1、3、5分的过渡阶段)。
1.6肺组织羟脯氨酸测定 取左肺组织按照羟脯氨酸试剂盒说明书进行操作,分光光度仪检测羟脯氨酸含量。
1.7统计学分析 采用SPSS24.0软件进行t检验、Spearman相关性分析。
2 结 果
2.1肺组织病理学改变 HE染色显示:A组第7天肺间隔增宽且有大量炎症细胞浸润;14 d肺部组织基本消失,肺泡结构几乎不可见;第21天肺部斑片化;28 d斑片面积减少。B组各个时期病理改变较A组轻(图1)。Masson染色显示:A组第7天开始出现少量胶原纤维沉积,到14 d达到最高,随后逐渐减少。B组各时期的胶原纤维沉积程度较A组轻(图2)。
2.2肺部炎症及纤维化评分 A组炎症评分在第7、14、21天时均显著高于B组,差异有统计学意义(P<0.01),A组纤维化评分各时期均显著高于B组,差异有统计学意义(P<0.01),见表1。
2.3羟脯氨酸含量 A组羟脯氨酸含量在第14天达到最高,随后逐渐下降,A组各时期羟脯氨酸含量均显著高于B组(P<0.01),见表2。
2.4外周血循环纤维细胞 A组循环纤维细胞第7天达到最高,在第7、14、21天均显著高于B组(P<0.01),见表3。
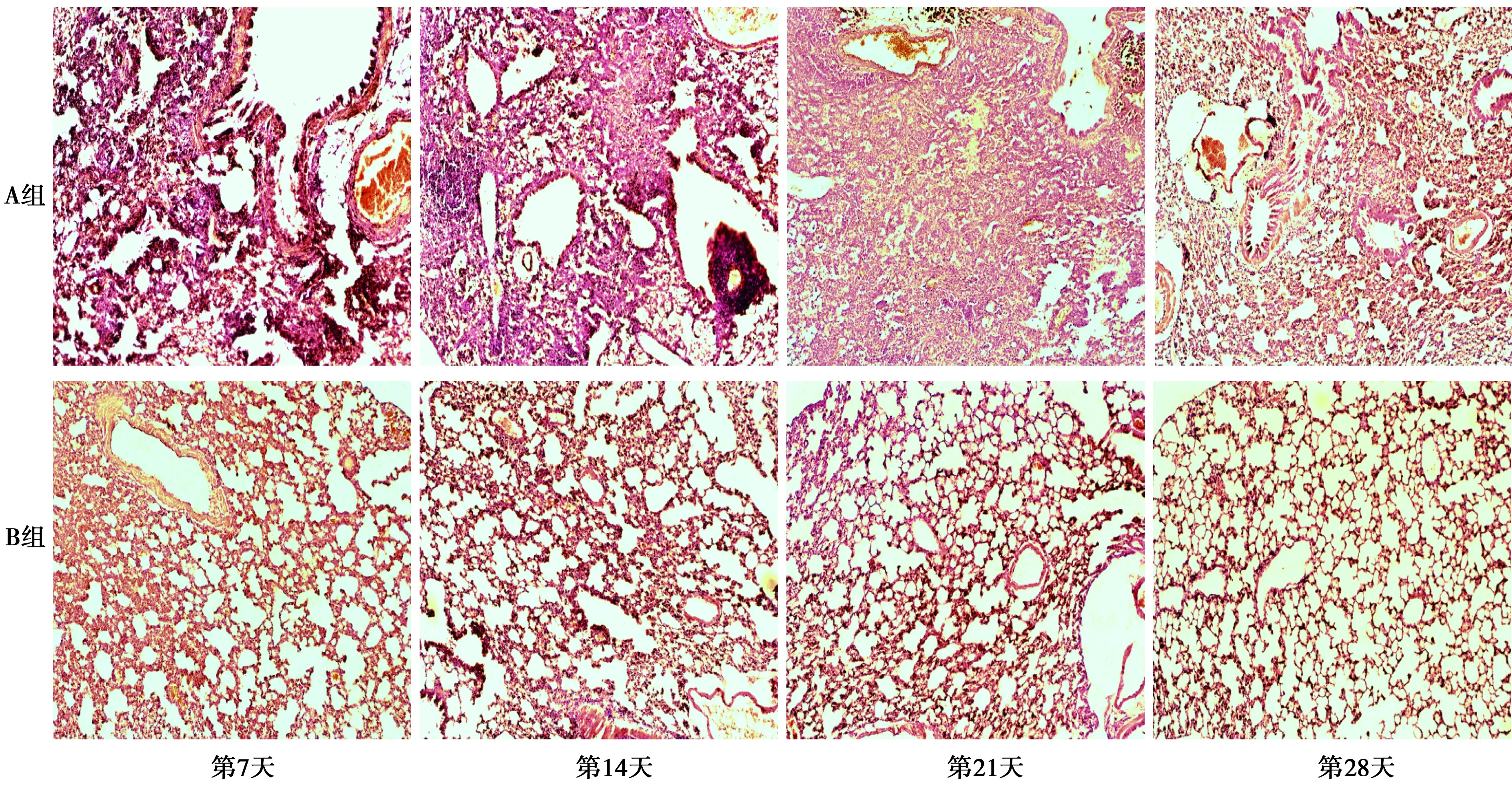
图1 两组肺组织HE染色(×200)
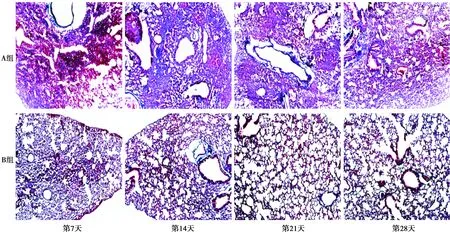
图2 两组肺组织Masson染色(×200)

组别炎症评分第7天第14天第21天第28天纤维化评分第7天第14天第21天第28天A组2.80±0.571)3.60±0.421)2.60±0.421)1.50±0.793.00±0.621)3.80±0.571)4.20±0.571)3.20±0.571)B组0.90±0.420.70±0.270.30±0.270.30±0.270.80±0.270.50±0.350.20±0.270.10±0.22
与B比较:1)P<0.01;表2同

表2 两组肺组织羟脯氨酸含量
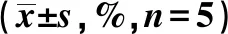
表3 两组外周血循环纤维细胞百分比
2.5血清KL-6浓度 A组血清KL-6浓度第21天达到最高,在第14、21、28 d显著高于B组(P<0.05),见表4。
2.6循环纤维细胞百分比与肺组织炎症、纤维化评分、羟脯氨酸含量、血清KL-6浓度的相关性 Spearman分析结果显示,循环纤维细胞百分比与肺组织炎症评分、纤维化评分、羟脯氨酸含量、血清KL-6浓度呈正相关(r=0.631、0.676、0.764、0.454,n=40,P<0.01)。

表4 各组血清KL-6浓度
3 讨 论
循环纤维细胞是存在于外周血中的一类新的白细胞亚型,在正常人群中占外周有核细胞的0.1%~1.0%。Hashimoto等〔7〕在BLM诱导长期移植表达增强型绿色荧光蛋白转基因小鼠的肺损伤模型中,发现肺部表达胶原的细胞很大比例是骨髓来源的外周循环纤维细胞。循环纤维细胞同时具有血源性细胞和成纤维细胞的特征,因此,标志物CD45和ColⅠ双阳性常用来鉴别循环纤维细胞〔8〕,本研究结果显示外周血循环纤维细胞数量变化与ILD病理进展一致。由于循环纤维细胞具有上述特征,因此其有可能参与ILD的炎症及纤维化进程〔9〕,本研究提示循环纤维细胞可能参与BLM诱导小鼠ILD的炎症和纤维化进程。
KL-6是一种高分子量的肺细胞糖蛋白标记物,在肺组织中由肺泡Ⅱ型上皮细胞和支气管上皮细胞分泌,KL-6在肺组织细胞损伤反应和再生后增加,在ILD中升高,参与ILD的病理生理过程。因此,KL-6常被作为ILD病情监测和预后的生物学标志物〔5〕,既往临床研究也证实了这一观点〔10〕。本实验结果显示循环纤维细胞数量与血清KL-6水平呈正相关,表明循环纤维细胞可作为ILD评估病情的生物学标志物。
本实验未涉及循环纤维细胞参与ILD的机制,有待进一步深入研究。因小鼠与人体的差异性,因此该动物实验结果可能与临床结果有差异,需进一步临床研究验证。

