自动化机械发酵食醋过程中品质变化规律
王文秀,刘 琳,姜 鑫,代鑫鹏,孙剑锋,王 颉,彭彦昆,北村丰
自动化机械发酵食醋过程中品质变化规律
王文秀1,刘 琳1,姜 鑫1,代鑫鹏1,孙剑锋1※,王 颉1,彭彦昆2,北村丰3
(1. 河北农业大学食品科技学院,保定 071000;2. 中国农业大学工学院,北京 100083;3. 筑波大学生命环境科学研究科,筑波 3058572)
为全面了解转鼓式反应器固态发酵食醋过程中主要成分和风味物质的动态变化规律,该文对反应器发酵食醋过程进行跟踪取样,利用高效液相色谱、固相微萃取技术、气相色谱-质谱联用技术,对酒精、总酸、还原糖、氨基态氮、有机酸、挥发性风味物质含量变化进行实时监测,结合主成分分析方法,探究食醋不同发酵阶段的风味物质差异。结果表明,酒精含量在发酵0~4 d内迅速增加,随后逐渐下降至零;总酸含量呈现先快速上升后缓慢上升的趋势;还原糖含量呈先快速下降后逐渐上升,最后逐渐下降的趋势;氨基态氮呈现先快速上升后缓慢上升的趋势;乙酸和乳酸是主要的有机酸,整个发酵过程中,乙酸含量持续增加,乳酸含量呈先上升后下降趋势,其他有机酸含量较少,发酵期间变化波动相对较小;共检测出64种挥发性风味物质,包括酯类25种,醇类12种,酸类6种,酚类5种,醛类5种,酮类6种,杂环类5种;发酵前、中、后期的重要挥发性物质分别是醇类化合物、酯类和醛类化合物、酸类化合物。该结果为推进转鼓式固态发酵食醋反应器的实际生产应用提供了理论基础和数据参考。
转鼓式反应器;食醋;固态发酵;主要成分;挥发性风味物质;动态监测
0 引 言
食醋是人们饮食生活中不可缺少的调味品,淀粉、可发酵性糖类和蛋白质等成分的原料经微生物系列代谢作用酿造而成。食醋的主要成分是醋酸,还包括丁酸、戊酸等挥发性酸和乳酸、苹果酸、琥珀酸等非挥发性酸[1]。此外,丰富的醇类、酯类、醛类等风味物质与有机酸相互配合,相辅相成,造就了食醋特有的风味和感官特性。
食醋的酿造方式以传统固态发酵工艺为主,发酵周期长,参与微生物种类多,代谢产物丰富,风味独特[2]。但目前传统固态发酵制醋技术和生产设备仍存在很多缺陷,如设备简单、生产环境卫生条件差、受季节气候条件变化影响较大,各环节过程中物料搬倒、运输繁琐,劳动强度大,生产效率低等。针对上述瓶颈问题,研发自动化、机械化的固态发酵设备具有十分重要的意义。
目前在发酵领域,已有浅盘式反应器、填充床式反应器、转鼓式反应器等[3-4],其中转鼓式发酵机能对温度和通风量有较好控制,因此对这类发酵机的研究较多,但是适用于食醋固态发酵的反应器报道较少。宋春雪等[5]设计了一种立式固态发酵设备,充分利用了立体空间,使单位面积下的产出率大幅提高。上述研究为食醋的自动化生产提供了解决思路,但仍存在一些不足,如立式发酵的设计限制了料层厚度,料层过厚会影响物料散热和溶氧,通过搅拌加快物料散热和溶氧时又会增加能耗。课题组在前期研究基础上,通过将传统固态发酵多边共酵原理同现代化设备相结合设计了转鼓式反应器,具备入料、出料、接种、发酵、淋醋、熏醋功能,将所有工艺流程集成在反应器中,初步实现了酿醋的机械化和一体化。
为了使机械酿造食醋的品质满足人们对食醋的要求,应对发酵过程中各理化指标进行实时监测,以认识机械发酵过程中的内在特性和变化规律,从而进一步优化反应器设计及生产工艺条件。目前关于食醋发酵过程动态监测的研究,大多集中在传统固态发酵过程中总酸[6]、还原糖[7]、有机酸[8]、挥发性成分[9-12]、微生物菌相[13-14]等指标的变化上。Tang等[15]对传统醋大曲高温发酵过程中微生物类群和代谢产物的变化规律进行了探究,Zhu等[16]借助新型的高光谱成像技术对食醋固态发酵过程中总酸和水分含量的变化进行了快速实时监测。但是关于自动化机械发酵食醋过程中各指标的动态变化规律研究鲜有报道。
为了探析转鼓式反应器食醋固态发酵过程的生产特性,本文对其发酵过程进行动态监测,利用高效液相色谱、固相微萃取技术、气相色谱-质谱联用技术,结合主成分分析方法,探寻不同发酵阶段食醋主要成分和挥发性风味物质的差异,深入全面的了解转鼓式反应器发酵过程中品质的动态变化规律,为推进转鼓式固态发酵反应器的工业化应用提供理论基础和参考指导。
1 材料与方法
1.1 材料与试剂
原料:大米面(主料)、麸皮(辅料)、稻壳(填充物料)、大曲(糖化发酵剂)均购置于河北省保定市农大科技市场。
试剂:糖化酶(100 000U/mL)、淀粉酶(100 000U/mL):上海源叶生物科技有限公司;盐酸、硫酸、无水乙醇、磷酸二氢钠、磷酸氢二钠、无水氯化钙、硝酸铝、邻苯二酚、氯化钠、无水氯化钙、乙酸等均为分析纯,上海化学试剂厂;酵母粉:北京奥博星生物技术有限公司;乙腈:色谱纯,上海化学试剂厂。
1.2 仪器与设备
本研究利用实验室自行设计的转鼓式反应器进行食醋的固态发酵。反应器的结构示意图如图1,该设备由罐体、进水管、温度计、进料口、罐体内挡板、风机、传动装置、进风管道、排风管道、拖轮、取样孔、淋醋筛板等组成。
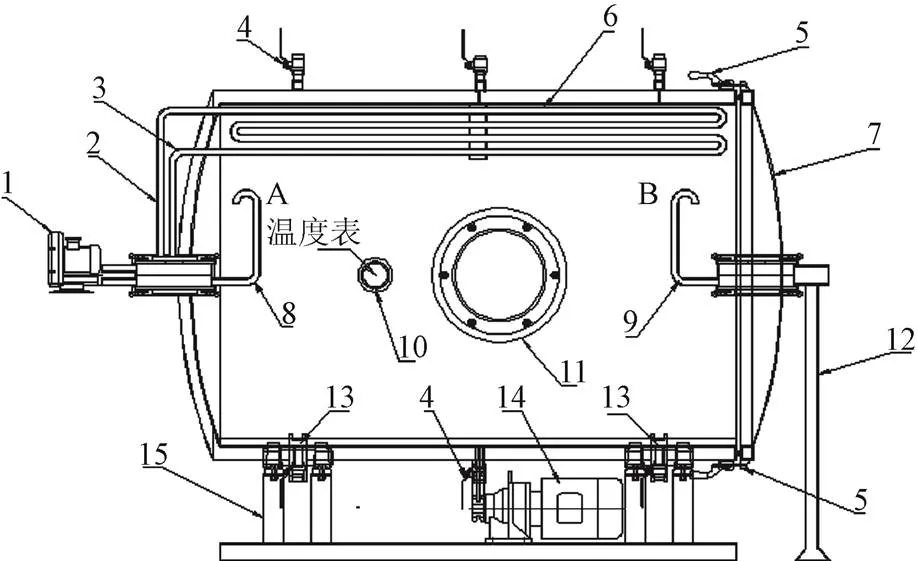
1.风机 2.进水管 3.出水管 4.淋醋管(接种管) 5.开关 6.挡板 7.侧盖 8.进气管 9.出气管 10.温度表 11.进料口 12.固定杆 13.拖轮 14.电动机
试验所用其他仪器包括:7890A-5975C气相色谱质谱联用仪,美国Agilent公司;Agilent 1200高效液相色谱仪,美国Agilent公司;50/30m DVB/CAR/PDMS固相微萃取头,美国Supelco公司;UV2200 紫外可见分光光度计,上海舜宇恒平科学仪器有限公司;15R高速冷冻离心机,力康生物医疗科技控股有限公司;H.SWX-600BS电热恒温水温箱,金坛市朗博仪器制造有限公司;HH-4数显恒温水浴锅,上海比朗仪器有限公司;pH计,奥豪斯仪器(上海)有限公司;AR423CN电子分析天平,奥豪斯仪器(上海)有限公司。
1.3 试验设计方法
利用转鼓式反应器发酵食醋过程如图2所示,将面粉、麸皮、稻壳、大曲依次加入反应器内,关闭入料口,待物料被搅拌均匀后,加入水、已活化的酵母菌、液化型淀粉酶、糖化型淀粉酶,搅拌均匀后进入发酵阶段。发酵过程中根据不同阶段的需氧状况,利用风机向反应器内通入适量的氧气,同时排出发酵过程产生的CO2。利用循环水通道对物料温度进行调节,当总酸的含量不再上升或上升速率极低时停止发酵。
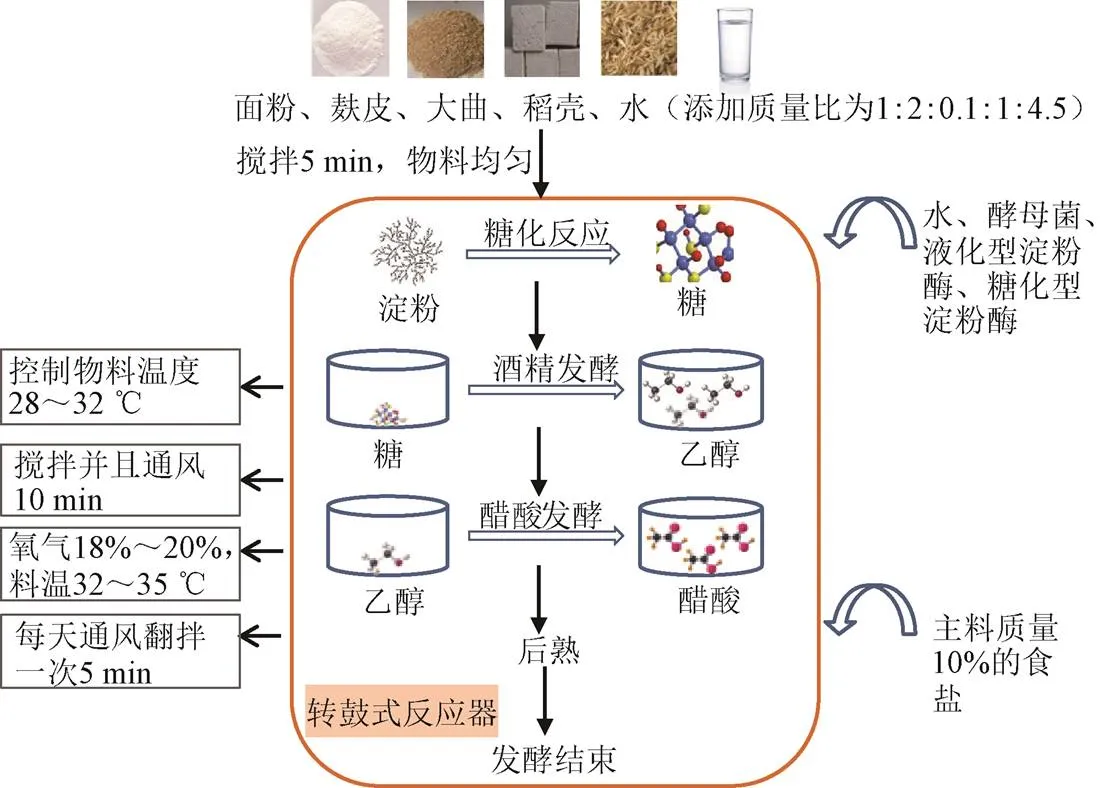
图2 转鼓式反应器食醋发酵流程
取样方法:以入料当天记为0 d,分别在发酵0、2、4、6、8、10、12、14、16、18、20、22和24 d时打开淋醋阀,从3个淋醋管中各取100~150 mL醪液,混匀,以保证样品的均匀性和代表性。然后进行酒精、总酸、还原糖、氨基态氮、有机酸等基本成分和挥发性风味物质的测定分析,监测各指标在发酵过程中的动态变化规律,每个指标平行测定3次并求取平均。
1.4 理化指标测定方法
1.4.1 基本理化指标的测定
酒精的测定:参照国标《GB5009.225-2016》;总酸的测定:参照国标《GB/T 12456-2008》;还原糖的测定:参照国标《GB 5009.7-2016》;氨基态氮的测定:参照国标《GB5009.235-2016》。
1.4.2 有机酸的测定
参照余永建[17]的方法。
1.4.3 挥发性风味成分种类和相对含量的测定
参照李攀恒等[18]的方法进行测定,并利用面积归一法定量计算各风味物质的相对百分含量。
1.4.4 出品率的计算
参照赵红年等[19]的方法,以1 kg主粮产出酸度为5°的食醋的千克数计。
1.5 数据处理与统计分析
对不同发酵阶段挥发性风味成分进行主成分分析,通过寻找主成分的相关性,明确各个发酵阶段的关键风味物质。数据处理和方差分析均在SPSS17.0软件中进行,绘图通过Origin9.1软件完成。
2 结果与分析
2.1 转鼓式反应器发酵过程中基本理化指标变化规律
发酵过程中各基本理化指标的变化趋势如图3所示。可以看出,酒精体积分数在发酵0~4 d内快速增加,第4天达到最高值5.6%(酒精体积/醪液体积),随后逐渐下降,在第18天时降至为0。这与张奶英等[20]对四川麸醋发酵过程中酒精变化趋势的研究结果一致。在前期酒精发酵阶段,酵母菌作为优势菌种,以还原糖为营养物质生成酒精,使其含量快速上升。随着醋酸发酵的进行,醋酸菌占据优势地位,以乙醇为营养物质生成乙酸,因此酒精含量呈迅速下降的趋势。
总酸含量呈先快速上升后缓慢上升的趋势,与熊越[21]和Xu等[22]对四川麸醋和镇江香醋发酵过程中总酸含量变化趋势的研究结果一致。食醋发酵过程存在系列微生物和众多酶系,通过丙酮酸或三羧酸循环生成多种有机酸[23]。其中,酒精发酵过程为厌氧环境,存在大量的乳酸菌,乳酸菌大量繁殖且代谢旺盛产生大量乳酸,酵母菌在酒精发酵过程中也会生成琥珀酸。醋酸发酵阶段,醋酸菌将酒精发酵生成的乙醇氧化为乙酸,同时此阶段醋醅中氨基态氮的含量较高,氨基酸降解后被氧化或还原生成酸性物质,加上部分饱和脂肪酸降解,使得总酸的含量快速增加。而到了发酵后期,由于有机酸的累积和大量营养物质被消耗,各种微生物的代谢活动变得迟缓,因此总酸含量呈缓慢上升趋势。
还原糖含量在发酵0~4 d内快速下降,第4天时降至最低,达到0.19 g/100 mL,第6~18天逐渐上升,与Zhang等[24]对北京米醋发酵过程中还原糖的变化描述一致。在前期酒精发酵阶段,大量的还原糖被转化为乙醇,因此还原糖含量迅速降低。在醋酸发酵阶段,淀粉酶和糖化酶仍具备一定活性,将继续水解剩余的淀粉生成还原糖,同时发酵后期过酸的环境对某些微生物起到了一定的抑制作用,导致糖类物质较少被利用,从而使其含量逐渐上升。然而,与之不同的是,本研究中还原糖含量在第20~24天逐渐下降。一方面是由于部分还原糖参与了美拉德反应,另一方面是发酵后期的醋酸菌和乳酸菌会进一步利用还原糖,因此使其含量呈降低趋势。
氨基态氮呈现先快速上升后缓慢上升的趋势,与张奶英和孙宗保等研究四川麸醋和镇江香醋发酵过程中氨基态氮变化趋势的研究结果一致[20,25]。微生物菌体和原料中的蛋白质被蛋白酶降解为氨基酸、肽、蛋白胨等,使氨基态氮含量迅速上升,这也为酵母菌生长繁殖提供了氮源物质。酒精发酵结束后,酵母菌发生自溶,同时伴随醋酸发酵的进行,酸含量的升高抑制了一些微生物的活动,加上蛋白酶活力也随着发酵时间的延长而下降,因此发酵后期氨基态氮含量增长速度缓慢[26]。
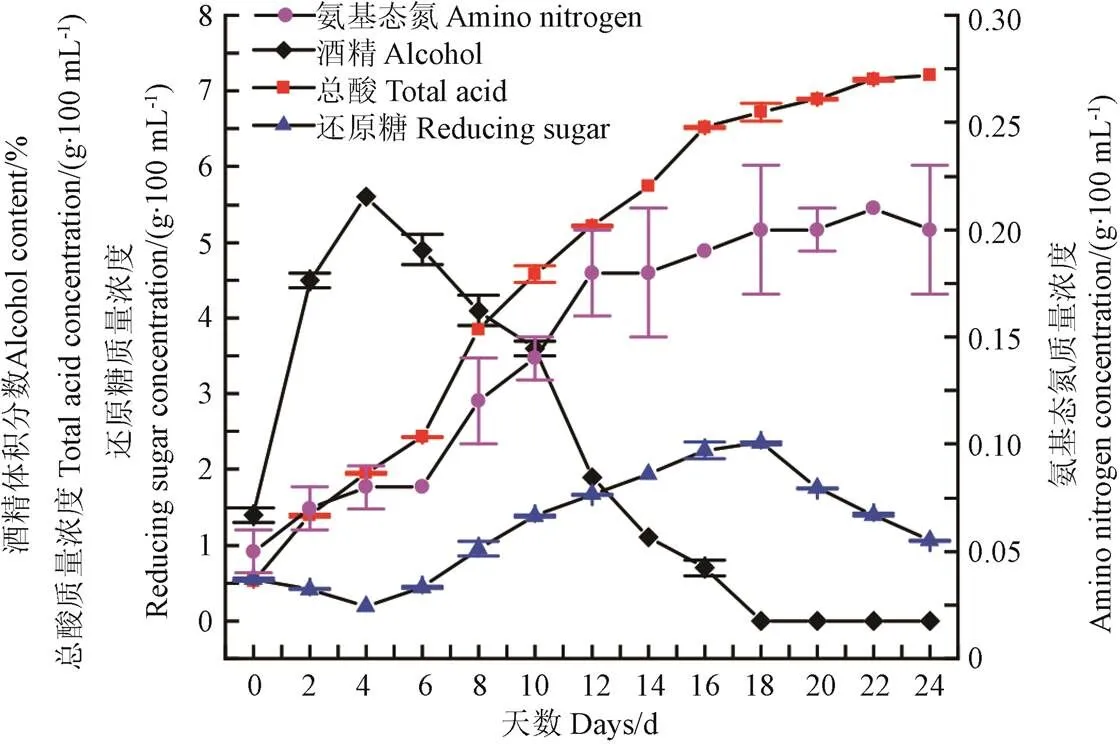
图3 发酵过程中基本理化指标的变化趋势
2.2 转鼓式反应器发酵过程中有机酸动态变化分析
2.2.1 发酵过程中有机酸含量变化
有机酸包括以乙酸为主的挥发性有机酸和以乳酸为主的非挥发性有机酸。本研究对发酵过程中7种有机酸含量进行测定,结果如表1和表2所示。其中,乙酸是食醋发酵过程中含量最高的有机酸,是酸味的主要来源,其含量在发酵过程中不断增加,尤其在第4~18天,质量浓度增加最为迅速,从7.74 mg/mL上升至43.00 mg/mL,随后上升趋势逐渐变缓,发酵结束时质量浓度为44.76 mg/mL,该趋势与Jiang等[27]研究红曲米醋发酵过程中乙酸的变化一致。乳酸含量仅次于乙酸,在发酵过程中呈先上升后下降的趋势,第4天达到了最高值40.70 mg/mL,随后逐渐下降至发酵结束时的15.24 mg/mL。这2种酸已被证实是中国传统食醋(如山西陈醋、镇江香醋、天津独流醋等)的主要有机酸[28]。
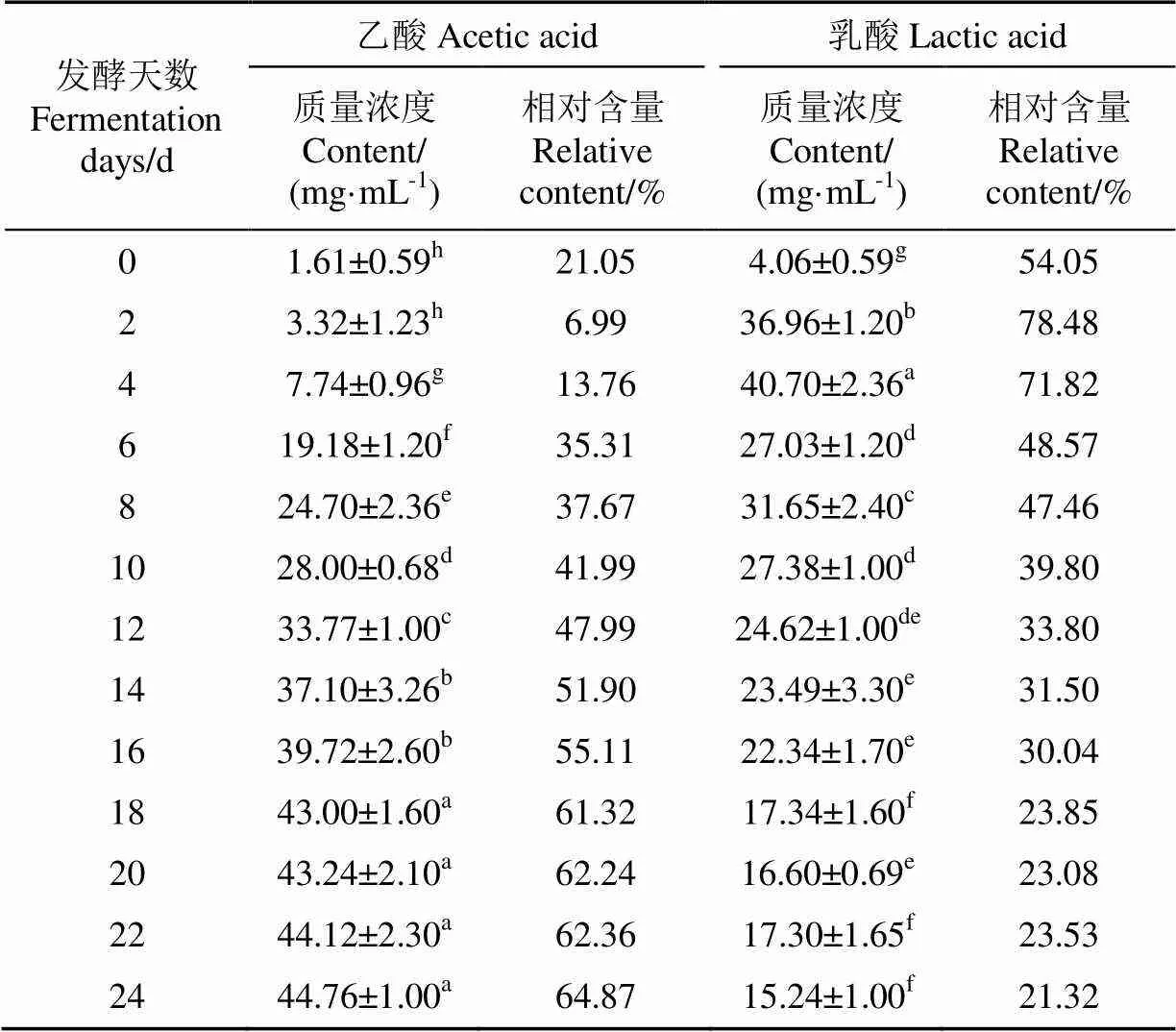
表1 转鼓式反应器发酵过程中乙酸和乳酸的含量变化
注:表中同一列数据上不同上标字母代表有显著差异(<0.05),下同。
Note: There are significant differences in different superscript letters in the same column of data in the table (<0.05), the same below.
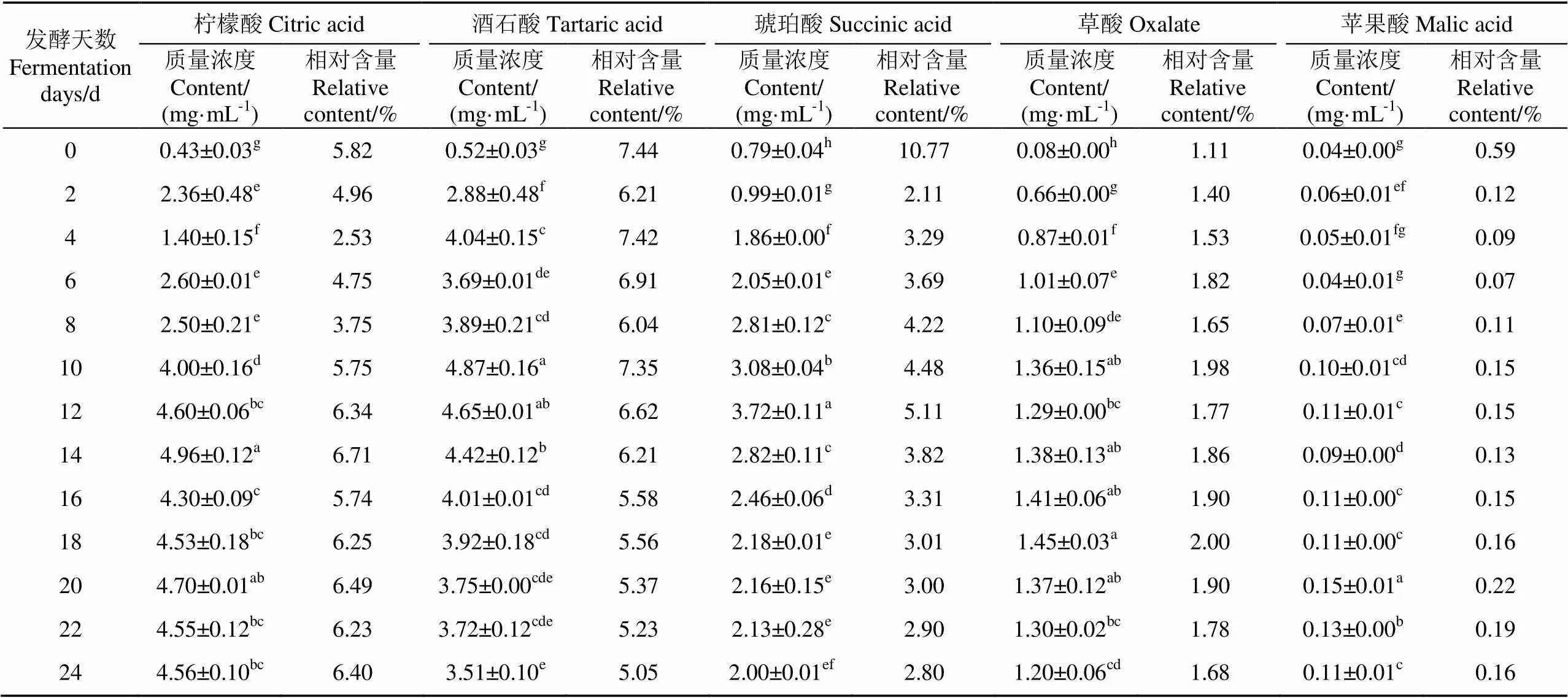
表2 转鼓式反应器发酵过程中其他有机酸的含量变化
相对于乙酸和乳酸,其他有机酸的含量较低。柠檬酸质量浓度在发酵过程中有所波动,由最初的0.43 mg/mL变化至发酵结束时的4.56 mg/mL。酒石酸含量在发酵前中期呈上升趋势,第10天时达到最高值4.87 mg/mL,之后缓慢下降至发酵结束时的3.51 mg/mL。琥珀酸是酵母菌发酵的代谢产物,具有鲜酸爽口的滋味,其含量在0~12 d迅速增加,第12天达到最高值3.72 mg/mL,随后逐渐下降至发酵结束时的2.00 mg/mL。草酸含量较低,在发酵第0~18天内呈上升趋势,第18天时质量浓度最高达到1.45 mg/mL,随后逐渐下降至发酵结束时的1.20 mg/mL。苹果酸质量浓度最低,在第0~20天内由0.04 mg/mL变化至0.15 mg/mL,第24天后下降至发酵结束时的0.11 mg/mL。
2.2.2 发酵过程中有机酸含量变化分析
食醋发酵包括酒精发酵和醋酸发酵2个阶段。前期酒精发酵阶段为厌氧环境,此时乳酸菌代谢旺盛从而大量繁殖产生乳酸,其含量占70%以上,是最丰富的有机酸。而后期为有氧环境,乳酸菌的生长受到抑制,发酵过程以醋酸发酵为主,因此乳酸产生速度缓慢。同时,随着发酵的进行,乳酸可能会作为碳源被某些微生物利用,因此乳酸含量呈现下降的趋势。乙酸在酒精发酵过程中产量相对较少,发酵结束时占有机酸含量的64.87%;进入醋酸发酵过程后,醋酸菌代谢旺盛且大量繁殖,加上通过苹果酸/琥珀酸回补偶联有氧呼吸产生的乙酸,使乙酸含量迅速增加。发酵后期,乙醇含量降低,细胞氧化乙醇的活力下降,因而产酸的速率有所下降。
分析表2可知,其他有机酸变化波动相对较小。在前期酒精发酵阶段,伴随着苹果酸-乳酸发酵的进行,苹果酸含量有一定幅度降低。而此时酵母菌为了维持细胞内的中性环境,会将琥珀酸等发酵产物分泌出去,导致琥珀酸等有机酸的增加。在醋酸发酵过程中,酒石酸、琥珀酸等有机酸含量有不同程度的下降,柠檬酸含量呈升高的趋势,说明醋酸菌在利用乙醇获得能量生成乙酸的同时,可代谢酒石酸、琥珀酸等,产生和积累柠檬酸。发酵后期,苹果酸和琥珀酸再次被消耗,一方面用于辅助乙醇呼吸链功能维持细胞在高酸环境下的正常代谢,另一方面用于回补三羧酸循环和磷酸戊糖途径等[29]。
利用转鼓式反应器进行食醋发酵有利于有机酸的生成。一方面,转鼓式反应器是一个密闭环境,氧气通入和二氧化碳排放分别经由进风管道和排风管道完成,此过程不会引入过多的杂菌与醋醅中的微生物进行竞争,避免了传统固态发酵开放环境下污染杂菌的弊端。另一方面,转鼓反应器通过循环水通道注入冷凝水,转动罐体使醋醅整体都能均匀的接触到表面,能更加准确的控制发酵温度,有效克服了传统发酵过程中通过改变竹竿数量和塑料薄膜高度的方法只能调节醋培表面温度的缺点。此外,转鼓反应器比传统发酵池温度偏低,更有利于通氧时环境中的有益微生物进入到醋培中参与有机酸的生成。
2.3 转鼓式反应器发酵过程中挥发性风味物质动态变化规律
食醋中具有高含量的挥发性风味物质,与其香气有密不可分的关系,主要由微生物代谢并相互转化而成。发酵过程采用的是自然发酵,虽然原料中自带了少许菌种,导致有杂菌进入,但因其不是优势菌种,因此挥发性风味物质中仍以酯类、醇类、酸类等化合物占主导地位。酯类化合物是风味中最重要的组成部分,大多呈现香甜的果香味、烘焙味等。利用转鼓式反应器发酵食醋过程中挥发性成分的种类和含量变化如表3和图4所示,共检测出64种风味物质,包括酯类25种、醇类12种、酸类6种、酚类5种、醛类5种、酮类6种以及杂环类5种,占比较小的醛类、酚类、酮类、吡嗪类等化合物多产生于食醋陈酿期间。

表3 转鼓式反应器发酵过程中挥发性风味物质变化
注:ND表示未检出。
Note: ND represented “not detected”.

图4 发酵期间挥发性风味物质变化情况
如表3和图4所示,酯类化合物含量所占比例在前期有所波动,至在发酵中期12 d左右酯类化合物占得比例最大,占整体风味物质的55.65%,随后呈下降趋势,至发酵结束后占整体的14.74%。根据Barre等[30]的研究,酯类化合物的形成与酵母菌活性有较大关联,通过醇类和酸类化合物的酯化反应产生,其含量与醇类化合物的含量呈正相关关系。在发酵后期,醇类化合物含量逐渐减少,因此酯类化合物的含量也会随之减少。同时由于酸类化合物含量逐渐增加,酸性环境抑制了微生物的活动,而酯类化合物还在分解,进一步造成了酯类化合物的减少。酯类化合物种类在发酵的第8天达到23种,随后种类有所减少,至发酵结束时仅剩5种。其中,乙酸乙酯、正己酸乙酯、辛酸乙酯、乙酸苯乙酯、乙酸异戊酯、棕榈酸乙酯是酯类化合物中的重要物质。乙酸乙酯所占总酯比例最大,与Zhou等[31]分析镇江香醋中酯类物质种类的研究结果一致,其具有果香味,在发酵过程中呈现先上升后下降趋势,在第14天,其含量占总酯的42.20%。乙酸苯乙酯在发酵过程中呈现逐渐上升的趋势,具有蜂蜜香味,在发酵结束时,其含量占总酯的33.00%左右;棕榈酸乙酯具有水果味和奶香味,在发酵过程中呈现先上升后下降的趋势,在发酵第4天,含量占总酯的16.61%,发酵结束后含量为0;辛酸乙酯具有菠萝味和花香味,呈现先缓慢上升后下降的趋势,在第2天含量占总酯的12.5%,发酵后期含量为0。
醇类化合物主要是在酒精发酵阶段产生的,大都具有果香味和花香味,对食醋的整体风味有着积极的作用。在固态发酵的前期阶段,主要涉及淀粉水解和酵母菌代谢生成酒精的反应,此时醇类化合物含量逐渐上升,至第4天时占比高达37.39%。此后随着发酵过程中酯化反应和酸的形成,醇类化合物占得比例呈逐渐减少的趋势,至发酵结束时所占比例为4.44%,与Ubeda等[32]的研究结果一致。乙醇、苯乙醇、正己醇是主要的醇类化合物,其中乙醇所占比例最大,具有酒精味道,在酒精发酵阶段生成。发酵第4天时,乙醇含量占总醇的60.00%,达到最高值,随后逐渐下降为0。苯乙醇具有香甜的玫瑰花气味,由苯丙氨酸代谢产生,在发酵过程呈先下降后上升的趋势,是发酵后期主要的醇类化合物。正己醇呈下降趋势,从初期的41.00%到发酵结束含量为0。
发酵进行至第4天时,反应器内通入适量氧气,此时进入有氧发酵阶段,醋酸菌代谢旺盛,乙酸不断生成,此时虽然酯化反应也在进行,但酯化反应的速率要远低于生成酸的速率,因此造成乙酸的大量累积。发酵初期酸类化合物所占比例为7.54%,随着发酵的进行呈逐渐增加的趋势,至发酵结束时在整体风味物质中占有较大比例,达到了68.32%。酸类化合物由最初的3种达到后期的5种,含量随之大幅增加,包括乙酸、己酸、庚酸、辛酸和棕榈酸。乙酸是最主要的酸,在整个发酵过程中呈现上升的趋势,在发酵中后期所占比例高达80%,与Zhang等[24]对北京米醋发酵过程中酸类化合物的变化趋势一致,在后者的研究中,乙酸占全部酸类物质的90%以上。
其他化合物含量所占比例相对较少,酚类化合物主要起到助香的作用,其形成机理较为复杂,部分由原料代入[21]。其含量在整体风味物质中的比例有所上升,从发酵初期的6.49%上升至发酵结束时的10.66%,主要包括4-乙烯-2-甲氧基苯酚、2-甲氧基-4-甲基苯酚、4-乙基-2-甲氧基苯酚、苯酚和愈创木酚。醛类、酮类、杂环类化合物在发酵期间的种类和含量都很少。醛类化合物通过微生物发酵作用或氨基酸的降解作用产生[33],包括苯甲醛、苯乙醛、2-羟基-3-甲基苯甲醛和2-羟基-6-甲基苯甲醛。酮类化合物的形成与微生物氧化、氨基酸降解和不饱和脂肪酸热氧化分解有关[33],包括3-乙酰基-2-丁酮、2-哌嗪酮、2, 3-丁二酮和6-甲基-3,5-戊二烯-2-酮。杂环类化合物包括十六烷、2,3,5,6-四甲基吡嗪等,其生成与微生物发酵有关,也可由美拉德反应和Strecker降解产生的氨基酮经缩合反应生成[21]。
2.4 挥发性风味物质主成分分析
利用SPSS软件对不同发酵时间下挥发性物质含量进行主成分分析,得到主成分的特征值和特征向量。前两个主成分的载荷矩阵如表4所示,可见第一主因子对酯类化合物、醇类化合物、酸类化合物和杂环类化合物有较高的载荷系数,说明这些变量与第一主成分(PC1)有较高的相关性;第二主因子对酚类化合物和酮类化合物有较高的载荷系数,说明这两类化合物与第二主成分(PC2)有较高的相关性。
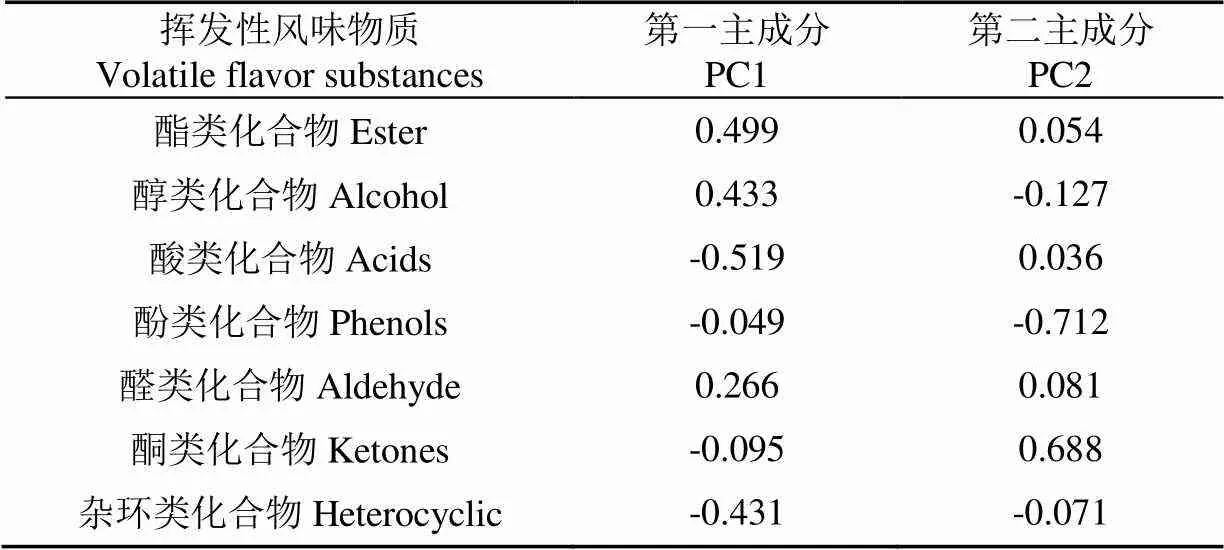
表4 主成分载荷矩阵
不同发酵时间的食醋及挥发性风味物质的第1主成分和第2主成分的散点图如图5所示。从图5a可知,14 d位于PC1和PC2正方向区域,0、2、4 d位于PC1正方向区域和PC2负方向区域,6、8、10、12 d位于PC1正方向区域,而18、22、24 d位于PC1负方向区域和PC2正方向区域,20 d位于PC1和PC2的负方向区域。由图中可以看出6~12、16~18、22~24 d聚集在一起,说明第6~12、16~18和第22~24 d挥发性物质最为接近,而其他时间段趋于离散阶段,说明挥发性物质相差比较大。
结合图5b,发酵前期(0~4 d)位于PC1正方向区域和PC2负方向区域,与之密切相关的挥发性物质为醇类化合物,说明醇类化合物是发酵前期的重要挥发性风味物质;发酵中期(6~12 d)与PC1主成分有极大正相关关系,与之密切相关的挥发性物质为酯类化合物和醛类化合物,说明酯类和醛类化合物是发酵中期重要的挥发性物质;16~18和22~24 d位于图中的第二象限,与PC1呈负相关,与PC2呈正相关,与之密切相关的挥发性化合物主要为酸类物质,说明发酵后期,酸类化合物是主要的挥发性物质[34]。
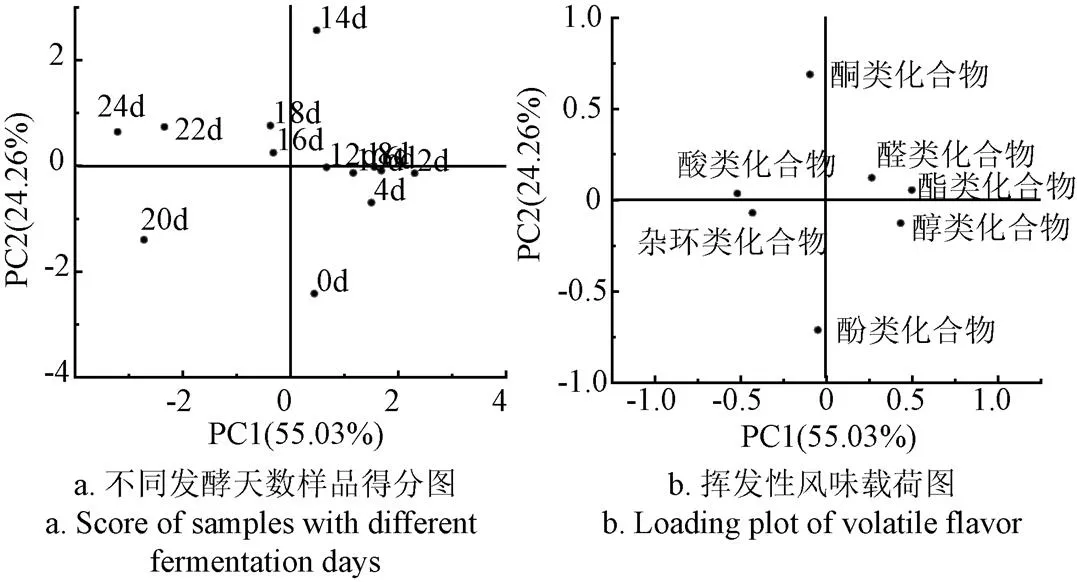
图5 发酵过程中挥发性风味物质主成分分析结果
从图5中可知,发酵前4 d含有的挥发性风味物质有所差别,这可能与转鼓式反应器在发酵前期就将主料和辅料混在一起,原料自身带有一些微生物有关。发酵不同时期挥发性风味物质有所不同,这与发酵环境中微生物群落动态变化有关。发酵初期微生物需要适应新的环境,因此微生物代谢产生的挥发性物质含量和种类处于一种较为波动的状态,发酵中期绝大部分微生物已经适应了醋酸发酵的环境,能够稳定的产生挥发性物质。发酵后期一些微生物由于营养物质的消耗和酸性环境的制约,菌落结构发生了重大改变,从而代谢产生的挥发性物质有了很大的差异。
2.5 转股式反应器发酵食醋出品率
利用转鼓式反应器发酵食醋的周期为24 d,以出品5度的成品醋为标准计算其食醋出品率,则该反应器食醋酿造的出品率达8.55,能较为有效的利用原料,酿造高出品率的食醋。
3 结 论
通过对转鼓式反应器固态发酵食醋过程进行跟踪取样,对基本理化指标、有机酸、挥发性风味物质的变化进行监测,得到如下结论:
1)总酸、氨基态氮在发酵过程中呈持续上升趋势,酒精发酵阶段还原糖量不断下降,酒精、乳酸含量迅速上升,其中乳酸占有机酸含量的70%以上,是最丰富的有机酸;醋酸发酵期间还原糖呈先上升后下降的趋势,酒精含量迅速下降,第18天左右降为0,乙酸含量在第4~18 d持续快速上升,发酵结束时占有机酸含量的64.87%;其他有机酸含量相对较少,发酵期间变化波动相对较小。
2)共检测出64种挥发性风味物质,包括酯类25种,醇类12种,酸类6种,酚类5种,醛类5种,酮类6种,杂环类5种,且以酯类、醇类、酸类等化合物占主导地位。
3)主成分分析结果表明,醇类化合物是发酵前期的重要挥发性风味物质,酯类和醛类化合物是发酵中期重要的挥发性物质,酸类化合物是发酵后期主要的挥发性物质。
转鼓式反应器发酵食醋可对发酵过程的温度、醋醅含氧量等进行人工控制,优化了生产环境,稳定了食醋质量,有望解决传统固态发酵存在的设备简单,污染环境,生产环境条件低劣、占地面积大、效率低、受季节气候条件变化影响大等瓶颈问题,更好的满足工业生产和人们对食醋的需求。研究结果为推进机械制醋设备的实际应用提供了理论基础和数据参考,下一步将该发酵过程与传统固态发酵进行对比研究,进一步为机械化生产食醋提供改进和指导建议。
[1] Chin W Ho, Azwan M L, Shazrul F, et al. Varieties, production, composition and health benefits of vinegars: A review[J]. Food Chemistry, 2017, 221: 1621-1630.
[2] Nie Z Q, Zheng Y, Wang M, et al. Exploring microbial succession and diversity during solid-state fermentation of Tianjin duliu mature vinegar[J]. Bioresource Technology, 2013, 148(8): 325-333.
[3] Durand A. Bioreactor designs for solid state fermentation[J]. Biochemical Engineering Journal, 2003, 13: 113-125.
[4] 孙宏韬,李伟,朱曼丽,等. 食醋的固态发酵工艺及其反应器进展[J]. 中国调味品,2018,43(12):89-93,98.
Sun Hongtao, Li Wei, Zhu Manli, et al. Advances in solid-state fermentation of vinegar and its reactor[J]. China Condiment, 2018, 43(12): 89-93, 98. (in Chinese with English abstract )
[5] 宋春雪,贾鹏,林汲,等. 全自动立式固态发酵设备:中国,CN202519237U[P]. 2012-11-07.
[6] Uysal R S, Soykut E A, Boyaci I H, et al. Monitoring multiple components in vinegar fermentation using Raman spectroscopy[J]. Food Chemistry, 2013, 141(4): 4333-4343.
[7] 王欢,卢红梅,张义明,等. 固态发酵食醋中还原糖、总糖含量测定[J]. 中国酿造,2011(9):172-175.
Wang Huan, Lu Hongmei, Zhang Yiming, et al. Determination of the contents of reducing sugar and total sugar in solid-state fermented vinegar[J]. China Brewing, 2011(9): 172-175. (in Chinese with English abstract )
[8] Chen Q S, Liu A P, Zhao J W, et al. Monitoring vinegar acetic fermentation using a colorimetric sensor array[J]. Sensors & Actuators B Chemical, 2013, 183(41): 608-616.
[9] Wang Z X, Wang X, Xu P, et al. Aroma patterns of Beijing rice vinegar and their potential biomarker for traditional Chinese cereal vinegars[J]. Food Research International, 2019, 119: 398-410.
[10] Guan B B, Zhao J W, Cai M J, et al. Analysis of volatile organic compounds from Chinese vinegar substrate during solid-state fermentation using a colorimetric sensor array[J]. Analytical Methods, 2014, 6(23): 9383-9391.
[11] Wang A L, Song H L, Ren C Z, et al. Key aroma compounds in Shanxi aged tartary buckwheat vinegar and changes during its thermal processing[J]. Flavour and Fragrance Journal, 2012, 27(1): 47-53.
[12] 许女,张天震,樊玮鑫,等. 山西老陈醋酿造过程中香气成分的动态变化[J]. 中国食品学报,2018,18(11):198-210.
Xu Nü, Zhang Tianzhen, Fan Weixin, et al. The dynamics changes of aroma components in brewing process of Shanxi mature vinegar[J]. Chinese Journal of Food Science, 2018, 18(11): 198-210. (in Chinese with English abstract )
[13] Wang Z M, Lu Z M, Yu Y J, et al. Batch-to-batch uniformity of bacterial community succession and flavor formation in the fermentation of Zhenjiang aromatic vinegar[J]. Food Microbiology, 2015, 50: 64-69.
[14] Wu J J, Ma Y K, Zhang F F, et al. Biodiversity of yeasts, lactic acid bacteria and acetic acid bacteria in the fermentation of “Shanxi aged vinegar”, a traditional Chinese vinegar[J]. Food Microbiology, 2012, 30(1): 289-297.
[15] Tang H L, Liang H B, Song J K, et al. Comparison of microbial community and metabolites in spontaneous fermentation of two types Daqu starter for traditional Chinese vinegar production[J]. Journal of Bioscience and Bioengineering, 2019, 128(3): 307-315.
[16] Zhu Y D, Zou X B, Shen T T, et al. Determination of total acid content and moisture content during solid-state fermentation processes using hyperspectral imaging[J]. Journal of Food Engineering, 2016, 174: 75-84.
[17] 余永建. 镇江香醋有机酸组成及乳酸合成的生物强化[D]. 无锡:江南大学,2014.
Yu Yongjian. Organic Acids Analysis and Enhanced Lactic Acid Synthesis of Zhenjiang Aromatic Vinegar[D]. Wuxi: Jiangnan University, 2014. (in Chinese with English abstract)
[18] 李攀恒,郑吴伟,汪超,等. HS-SPME-GC-MS测定中国四大名醋的香气成分[J]. 中国酿造,2018,37(4):164-168.
Li Panheng, Zheng Wuwei, Wang Chao, et al. Determination of aroma components of four Chinese famous vinegars by HS-SPME-GC-MS[J]. China Brewing, 2018, 37(4): 164-168. (in Chinese with English abstract )
[19] 赵红年,曹晋宜,平俊爱,等. 不同高粱品种对老陈醋品质的影响研究[J]. 中国酿造,2016,35(6):46-49.
Zhao Hongnian, Cao Jinyi, Ping Junai, et al. Effect of different sorghum variaties on quality of aged vinegar[J]. China Brewing, 2016, 35(6): 46-49. (in Chinese with English abstract )
[20] 张奶英,刘书亮,杨勇,等. 四川麸醋发酵过程中理化指标与微生物菌相的动态分析[J]. 食品工业科技,2014,35(11):174-178.
Zhang Naiying, Liu Shuliang,Yang Yong,et al. Dynamic analysis of physiochemical indexes and microbes in fermentation process of Sichuan bran vinegar[J]. Food Industry Science and Technology, 2014, 35(11): 174-178. (in Chinese with English abstract )
[21] 熊越. 四川麸醋发酵过程中风味物质的变化研究[D]. 重庆:西南大学,2011
Xiong Yue. Study on the Variation of Flavor Substances in Fermentation Process of Sichuan Bran Vinegar[D]. Chongqing: Southwestern University, 2011. (in Chinese with English abstract )
[22] Xu W, Huang Z Y, Zhang X J, et al. Monitoring the microbial community during solid-state acetic acid fermentation of Zhenjiang aromatic vinegar[J]. Food Microbiology, 2011, 28(6): 1175-1181.
[23] Volschenk H, Vuuren M, Viljoen-Bloom. Malic acid in wine: Origin, function and metabolism during vinification[J]. South African Journal for Enology & Viticulture, 2006, 27(2): 123-135.
[24] Zhang X, Wang P, Xu D D, et al. Aroma patterns of Beijing rice vinegar and their potential biomarker for traditional Chinese cereal vinegars[J]. Food Research International, 2019(119): 398-410.
[25] 孙宗保,赵杰文,邹小波,等. 镇江香醋加工过程中理化指标分析及其与香气成分关系初探[J]. 食品科学,2009,30(9):59-61.
Sun Zongbao, Zhao Jiewen, Zou Xiaobo, et al. Analysis on physicochemical indexes of Zhenjiang fragrance vinegar during processing and their relationships with aroma components[J]. Food Science, 2009, 30(9): 59-61. (in Chinese with English abstract )
[26] 刘芳,张奶英,刘书亮,等. 四川麸醋发酵过程中有机酸及游离氨基酸含量变化分析[J]. 食品与机械,2017,33(7):11-15.
Liu Fang, Zhang Naiying, Liu Shuliang, et al. Changes of organic acids and free amino acids in ferment action process of Sichuan bran vinegar[J]. Food & Machinery, 2017, 33(7): 11-15. (in Chinese with English abstract )
[27] Jiang Y J, Lü X C, Zhang C, et al. Microbial dynamics and flavor formation during the traditional brewing of Monascus vinegar[J]. Food Research International, 2019, 125: 108531.
[28] Ai M, Qiu X, Huang J, et al. Characterizing the microbial diversity and major metabolites of Sichuan bran vinegar augmented by Monascus purpureus[J]. International Journal of Food Microbiology, 2019, 292: 83-90.
[29] 亓正良. 巴氏醋杆菌高酸度醋发酵过程的能量代谢分析[J]. 微生物学通报,2013,40(12):2171-2181.
Qi Zhengliang. Analysis of energetic metabolism of acetobacter pasteurianus during high acidic vinegar fermentation[J]. Journal of Microbiology, 2013, 40(12): 2171-2181. (in Chinese with English abstract)
[30] Barre P, Blondin B, Dequin S, et al. La levure de fermentation alcoolique[M]. Paris: Tec Doc Lavoisier, 1998: 454-497.
[31] Zhou Z L, Liu S P, Kong X W, et al. Elucidation of the aroma compositions of Zhenjiang aromatic vinegar using comprehensive two dimensional gas chromatography coupled to time-of-flight mass spectrometry and gas chromatography- olfactometry[J]. Journal of Chromatography A, 2017, 1487: 218-226.
[32] Ubeda C, Callejón R M, Hidalgo C, et al. Determination of major volatile compounds during the production of fruit vinegars by static headspace gas chromatography–mass spectrometry method[J]. Food Research International, 2011, 44(1): 259-268.
[33] 石芬芬,李文梦,王庭欣. 食醋发酵过程中风味物质的研究[J]. 中国调味品,2017,42(2):159-162.
Shi Fenfen, Li Wenmeng, Wang Tingxin. Research on the flavor substances in vinegar fermentation process[J]. China Condiment, 2017, 42(2): 159-162. (in Chinese with English abstract)
[34] 陈青柳,刘双平,唐雅凤,等. 绍兴机械黄酒发酵过程中风味物质变化[J]. 食品科学,2018,39(14):221-228.
Chen Qingliu, Liu Shuangping, Tang Yafeng, et al. Changes in flavor components during fermentation process of mechanically produced Shaoxing rice wine[J]. Food Science, 2018, 39(14): 221-228. (in Chinese with English abstract)
Quality change law of vinegar during automatic mechanical fermentation
Wang Wenxiu1, Liu Lin1, Jiang Xin1, Dai Xinpeng1, Sun Jianfeng1※, Wang Jie1, Peng Yankun2, Kitamura Yutaka3
(1.071000; 2.100083; 3.3058572)
Vinegar plays an important role in our daily diet. Solid-state fermentation of vinegar using reactors has several advantages over the traditional methods, which include shorter fermentation process, and good controlled working environment. In order to fully understand the dynamic changes of main components and flavor compounds during the solid-state fermentation of vinegar in rotary drum reactor, samples were taken throughout the fermentation process. Alcohol, total acid, reducing sugar, amino nitrogen, organic acid and volatile flavor in the process of vinegar fermentation were studied by high performance liquid chromatography, solid-phase microextraction, and gas chromatography-mass spectrometry. Meanwhile, principal component analysis was carried out to explore the difference of volatile flavor in vinegar at different fermentation stages. The results showed that the fermentation process can be divided into three stages: starch saccharification, alcohol fermentation, and oxidation of ethanol to acetic acid. The alcohol content increased rapidly within 0-4 days of fermentation, then decreased gradually to zero until the end of fermentation. The total acid content showed a sharp increase tendency first, followed by a slight increase at the late stage of fermentation. The reducing sugar content decreased rapidly at first, then gradually increased during acetic acid fermentation, and finally gradually decreased. The amino nitrogen increased rapidly at first, followed by a gradual decrease at the end of fermentation. Seven organic acids were detected in our research, including acetic acid, lactic acid, oxalic acid, succinic acid, tartaric acid, citric acid, and malic acid. Among them, acetic acid and lactic acid were the main organic acids in the whole fermentation process. The lactic acid content increased rapidly first, and became the dominant organic acid in the alcohol fermentation stage. Then it showed a gradual decrease until the end of fermentation. For acetic acid, a gradual increase tendency was observed during the whole fermentation process, which accounted for 64.87% of all the organic acids contents. Compared with those, the content of other organic acids was less, and the variation during fermentation was relatively small. These organic acids were also crucial for the formation of characteristic taste of vinegar. A total of 64 flavor volatile substances were detected, including 25 esters, 12 alcohols, 6 acids, 5 phenols, 5 aldehydes, 6 ketones and 5 heterocyclic compounds. The principal component analysis results showed that the most dominant ones responsible for volatile flavor in the early, middle, and later stage of fermentation were alcohols, esters and aldehydes, and acids, respectively. Other volatile compounds, such as aldehydes, phenols, ketones, heterocycle, were present in small amounts during vinegar fermentation based on the reactor. However, they also play a vital role in the formation of special flavor for vinegar. This is the first report to study the dynamic changes of vinegar quality during fermentation process based on a reactor. The results would enhance our understanding of the fermentation property of rotary drum solid-state fermentation vinegar reactor, which may be helpful for the improvement and effective management of reactor to promote its industrial application.
rotary drum reactor; vinegar; solid-state fermentation; main components; volatile flavor; dynamic monitoring
王文秀,刘 琳,姜 鑫,代鑫鹏,孙剑锋,王 颉,彭彦昆,北村丰. 自动化机械发酵食醋过程中品质变化规律[J].农业工程学报,2019,35(18):273-281.doi:10.11975/j.issn.1002-6819.2019.18.033 http://www.tcsae.org
Wang Wenxiu, Liu Lin, Jiang Xin, Dai Xinpeng, Sun Jianfeng, Wang Jie, Peng Yankun, Kitamura Yutaka. Quality change law of vinegar during automatic mechanical fermentation[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(18): 273-281. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.18.033 http://www.tcsae.org
2019-05-15
2019-08-19
河北农业大学引进人才科研专项(YJ201850);河北省青年拔尖人才(冀组字[2016]9号)
王文秀,讲师,研究方向:食品加工工艺及品质安全无损检测技术与装备研发。Email:Godlovexiu@163.com
孙剑锋,教授,博士,博士生导师,研究方向:食品发酵与酿造技术。Email:causunjf@126.com
10.11975/j.issn.1002-6819.2019.18.033
TS262.4
A
1002-6819(2019)-18-0273-09

