氮沉降对中亚热带米槠天然林土壤有效磷的影响
曾昭阳,范跃新,林慰敏,黄鑫毅
(福建师范大学 a.地理科学学院,b.湿润亚热带山地生态国家重点实验室培育基地,福州 350007)
0 引言
磷(Phosphorus, P)是植物体内核苷酸、磷脂和核酸类的重要组成部分[1],是森林生态系统功能维持的必需元素。普遍认为土壤中矿物的吸附与解吸作用会影响土壤中P的溶解度,这是影响土壤磷有效性的重要因素之一[2],而在热带、亚热带地区,由于土壤高度风化、大部分土壤P被铁、铝氧化物等次生矿物固定,使得该区域的森林土壤表现出相对“磷缺乏”的特征[3-4]。而高额的氮沉降可能提高土壤氮有效性,促进植物生长,增加P需求[5],中国由于化石燃料的燃烧和含氮化肥的使用已成为世界三大氮沉降区域之一[6-7],尤其在中国东南沿海地区,氮沉降速率约40 kg N·hm-2·a-1[8],这可能会进一步加剧亚热带森林土壤的P限制,并影响区域森林生态系统的结构与功能。
有效磷(Available phosphorus, AP)是土壤中可以被植物和微生物有效利用的P,这部分磷虽然含量很低,但在土壤中比较容易被吸收,是反应土壤P供应的敏感性指标[9]。同时土壤中微生物量磷(Microbial biomasses phosphorus, MBP)周转快,也可被植物吸收利用,是土壤中另一个重要的潜在有效磷来源[10]。氮沉降会通过对植物根基分泌物的影响,改变土壤的理化性质,从而影响土壤磷的转化和利用[11]。例如,有研究表明,施氮会提高植物中的氮磷比,从而加强植物对磷的吸收过程[12]。已有研究尝试探索氮沉降对土壤有效磷的影响,结果发现氮沉降增加了生物的P需求,导致土壤P有效性降低[13],且在氮沉降初期有效磷衰减速度较快,之后氮沉降对有效磷的影响逐渐减弱[14]。但也有不同的研究结果,如Mirabello等发现[15],在巴拿马的热带森林土壤中,氮沉降未显著改变土壤有效磷含量,并认为可能是施氮加快了土壤有机磷的矿化,从而增加了有效磷的供应。还有研究发现施氮后土壤有效磷含量增加[16]。由此可见,氮沉降对于土壤P有效性的影响尚存争议,仍需要对不同区域的生态系统进行探索。
与全球同纬度的其他地区相比,中国亚热带地区降水充沛,植被类型丰富,森林生态系统生产力旺盛[17]。氮沉降的加剧对该地区土壤P有效性的影响,可能会改变区域森林生态系统的养分循环过程及其对全球变化的适应能力。米槠(Castanopsiscarlesii)是中国长江以南的重要用材树种之一,是亚热带地区典型的地带性树种,分布范围广泛,因此以中亚热带米槠天然林为研究对象,设置模拟氮沉降实验,探究土壤P有效性对氮沉降如何响应,以期为氮沉降背景下中亚热带森林土壤养分循环提供依据。
1 材料与方法
1.1 研究区概况
试验地位于福建省三明市格氏栲自然保护区,地处武夷山东伸支脉(26°11′N,117°28′E),属于低山丘陵,土壤类型为山地红壤,气候类型属于中亚热带季风气候,多年平均气温19.5 ℃,多年平均降雨量1 700 mm,主要集中在3—8月,多年平均蒸发量1 585 mm,相对湿度79%,全年无霜期约300 d。保护区中植物种类繁多,其中米槠为优势种,至今已有200多年的历史。
1.2 样地设计
于2012年11月在格氏栲自然保护区米槠天然林中建立模拟氮沉降长期观测样地,共设对照(CT)、低氮(LN,40 kg·hm-2·a-1)和高氮(HN,80 kg·hm-2·a-1)3种处理,每个处理4个重复。样地大小为20 m×20 m,样地之间间隔10 m,防止互相干扰。自2012年11月开始施氮,每月月初用喷雾器在样方内均匀喷洒NH4NO3溶液20 L,对照处理喷洒等量的去离子水。
1.3 土壤样品采集
2018年4月,分别按照“S”型随机选取5个点,去除凋落物后用土钻分0~10 cm和10~20 cm两个土层取土,装入自封袋后立即带回实验室。剔除可见石块、根系、动植物残体等。过2 mm筛后分成2份,一份置于4 ℃冰箱保存,用于测定微生物生物量磷,其余土样自然风干,用于测定基本理化性质和土壤有效磷。
1.4 测定指标及方法
pH值用玻璃电极pH计(STARTER300;OHAUS,美国)测定,水土比为2.5∶1;土壤总碳(Soil organic carbon,SOC)和总氮(Total nitrogen,TN)用元素分析仪(Elementarvario EL III;Elementar,德国)测定;称取5 g鲜土加入20 mL 2.0 mol·L-1的KCl浸提液,振荡离心后用定量滤纸过滤,用流动分析仪(Skalar san++;Skalar,荷兰)测定NH4+-N和NO3--N的含量;可溶性有机碳(Dissolved organic carbon,DOC)和可溶性有机氮(Dissolved organic nitrogen,DON),称取5 g鲜土加入20 mL去离子水,振荡离心后用0.45 μm的滤膜抽滤,用总有机碳分析仪(TOC-VCPH/CPN,Shimadezu,日本)测定DOC的含量,用流动分析仪(Skalar san++;Skalar,荷兰)测定DON的含量[18]。
土壤有效磷测定采用M3浸提法[19],其通用的浸提液所提取的P包括水溶性磷、Al-P、Fe-P和Ca-P的活性部分[20]。称取3 g风干土加入30 mL M3浸提液,振荡离心后用无磷滤纸过滤,流动分析仪(Skalar san++;Skalar,荷兰)测定有效磷含量;土壤全磷(Total phosphorus, TP)采用HClO4-H2SO4法[21],用流动分析仪(Skalar san++;Skalar,荷兰)测定全磷含量。
土壤微生物量碳(Microbial biomass carbon,MBC)采用氯仿熏蒸-K2SO4浸提法[22],用总有机碳分析仪(TOC-VCPH/CPN,Shimadzu,日本)测定浸提液中总有机碳含量,计算公式:MBC=△EC/kC, 式中ΔEC为熏蒸与未熏蒸土壤有机碳含量的差值,kC为转换系数,取值0.45;土壤微生物量磷采用氯仿熏蒸-NaHCO3浸提法[23],用连续流动分析仪(Skalar san++;Skalar,荷兰)测定浸提液中磷酸根含量,计算公式:MBP=△EP/kP,式中△EP为熏蒸与未熏蒸土壤有机碳含量的差值,kP为转换系数,取值0.4。
1.5 数据处理
用Excel 2016和SPSS 20.0软件对数据进行处理。用单因素方差分析(One-Way ANOVA)和LSD多重比较法检验不同施氮处理下土壤有效磷、微生物量磷以及土壤理化性质的差异显著性(P<0.05)。用Pearson相关分析检验土壤有效磷含量与土壤理化性质的相关性。绘图采用Origin 9.0软件。
2 结果
2.1 土壤基本理化性质
在0~10 cm土层,施氮后土壤pH有降低的趋势,但未达到显著水平。与对照相比,施氮未显著改变土壤SOC、TN、DOC和NH4+-N的含量,但显著增加了NO3--N和DON的含量。在10~20 cm土层中,各处理间土壤pH、SOC、TN、DOC和NH4+-N浓度均无显著差异,HN处理下DON含量显著高于LN和CT处理(表1)。表明施氮主要改变表层土壤的有效养分,而有机碳和总氮变化不显著。
2.2 土壤有效磷、全磷
施氮处理下,0~10 cm土层的有效磷含量显著降低,但10~20 cm土层无显著变化。与AP不同,两个土层的TP含量在不同处理下均无显著差异。施氮后有效磷与全磷的比值(AP/TP)在0~10 cm土层显著降低,但在10~20 cm土层无显著变化。结果表明,施氮主要影响土壤有效磷的含量且对土壤表层的影响更明显。
2.3 土壤微生物量碳和微生物量磷
与对照相比,施氮处理未显著改变0~10 cm土层MBC的含量(图2),但却显著降低了土壤MBP的含量和增加了MBC∶MBP。在10~20 cm土层,施氮显著增加了MBC含量和显著降低了MBP含量,但未显著影响MBC∶MBP。施氮后MBP的显著降低说明氮沉降可能加剧了土壤微生物的磷限制。
2.4 土壤有效磷含量的影响因素
采用皮尔逊相关分析检验土壤有效磷与土壤因子的关系(表2),发现在0~10 cm土层中,有效磷含量与MBP含量显著正相关,与NO3--N含量极显著负相关,而与土壤NH4+-N、SOC、TN和pH的相关性不显著。在10~20 cm土层中,有效磷含量与各土壤因子间均无显著相关性。
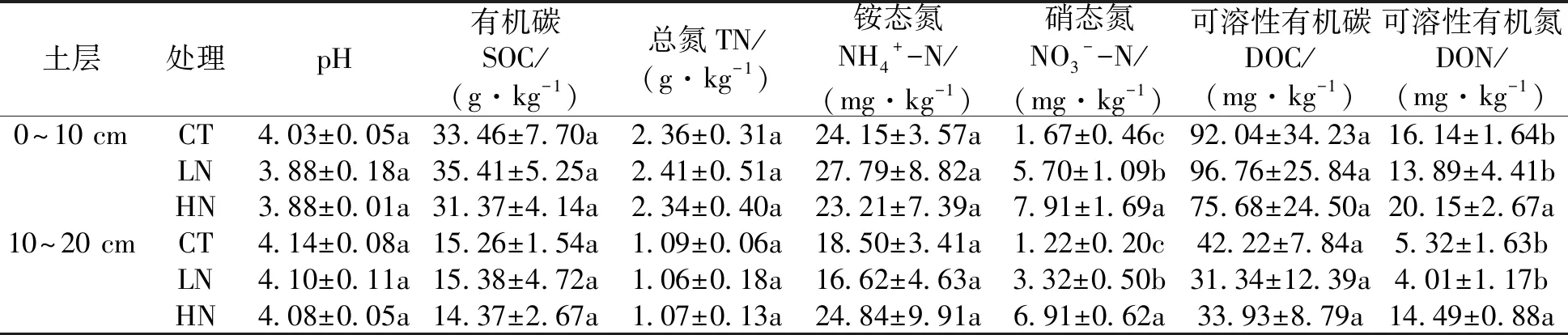
表 1 样地土壤基本理化性质Table 1 General situation of the experimental sample
注:CT:对照,LN:低氮(40 kg·hm-2·a-1),HN:高氮(80 kg·hm-2·a-1),下同;不同字母表示处理之间差异显著(P<0.05)。
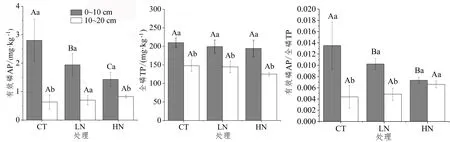
注:CT:对照,LN:低氮(40 kg·hm-2·a-1),HN:高氮(80 kg·hm-2·a-1),下同;误差线为重复间的标准误,下同; 不同大写字母表示同一土层,不同处理间差异显著(P<0.05),不同小写字母表示同一处理,不同土层间差异显著(P<0.05)。图 1 氮沉降对土壤有效磷与全磷含量的影响Figure 1 Effects of nitrogen deposition on soil available phosphorus and total phosphorus
表 2 土壤有效磷变化影响因子Table 2 The relationships between soil available phosphorus and soil properties
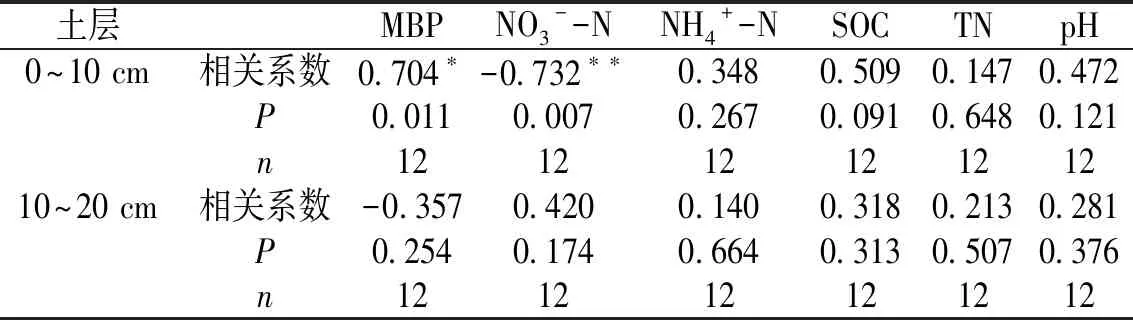
土层MBPNO3- -NNH4+ -NSOCTNpH0~10 cm相关系数0.704∗ -0.732∗∗0.3480.5090.1470.472P0.0110.0070.2670.0910.6480.121n12121212121210~20 cm相关系数-0.3570.4200.1400.3180.2130.281P0.2540.1740.6640.3130.5070.376n121212121212
注:*,P<0.05;**,P<0.01。
3 讨论
3.1 氮沉降对土壤微生物磷及微生物碳磷比的影响
MBP是植物可获取的土壤有效磷的重要来源,常用于表征生态系统的养分状况[24]。已有研究发现氮沉降会改变土壤MBP的含量,如meta分析显示,施氮后微生物量平均减少15%,且施氮时间越长、施氮量越大,微生物量降低幅度越大[25]。其他研究也发现,氮沉降会导致微生物固定P的能力下降,并认为主要与施氮会造成微生物碳限制,抑制了微生物生长有关[26]。也有研究结果显示,氮沉降并不会加剧微生物的P限制,并认为施氮会通过加快P循环速率来缓解微生物的P限制[27]。本研究中施氮显著降低了土壤MBP的含量,同时MBC∶MBP显著升高,这说明氮沉降后土壤微生物P需求增加。这一方面可能是因为施氮影响微生物,减少土壤微生物量,降低了微生物的活性,使得土壤MBP含量下降[28]。另一方面,施氮可能会刺激植物生长[29],增加植物与土壤微生物的磷竞争,导致可被微生物利用的有效磷含量下降。
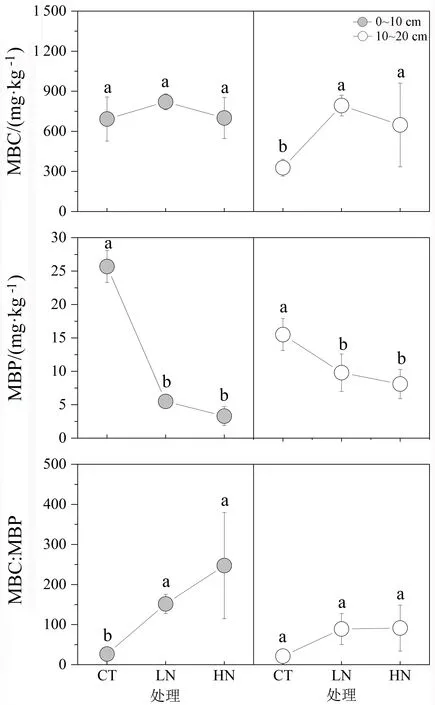
注:MBC:微生物生物量碳,MBP:微生物生物量磷; 不同字母表示同一土层,不同处理间差异显著(P<0.05)。图 2 氮沉降对土壤微生物量碳和微生物量磷的影响Figure 2 Effects of N deposition on soil microbial biomass C and P
3.2 氮沉降对土壤磷有效性的影响
土壤有效磷是指植物能直接吸收和利用的无机磷和部分小分子有机磷[30],通常用作土壤供磷能力表征指标[31]。其含量的变化可以直接体现氮沉降对土壤磷迁移和转化的影响[32],且有效磷和全磷含量之间并不具有固定的关系[1],即使在全磷含量很高的情况下,磷依然容易成为植物生长的限制因子[11]。
许多研究显示,施氮与土壤有效磷变化密切相关,且因环境而异。Marklein等[33]发现施氮虽然可以加速热带亚热带森林土壤的有机磷矿化,但由于土壤处于磷限制状态,使得有机磷转化为可利用磷后很快被植物和土壤微生物利用,因此有效磷含量仍未提高。Blanes等[34]在西班牙南部的研究发现,氮沉降后土壤活性无机磷含量呈下降趋势,认为与施氮导致土壤中的氮磷养分不平衡,使得植物根部对无机磷的吸收加快有关。而鼎湖山的一项研究表明,微生物对P的固持作用是导致土壤有效磷含量下降的主要原因[35]。还有研究发现,在N供应充足时,生物体会将N分配给水解酶(如磷酸酶)来获取有效磷[34]。本研究中,施氮处理未显著影响土壤TP含量,说明短期施氮未改变土壤磷的输入和输出平衡。在LN和HN处理下,土壤有效磷含量显著降低,说明施氮促进了植物对土壤有效磷的吸收和利用[36]。同时,本研究区所处的中亚热带地区气候温和,湿润多雨,与温带地区相比,土壤淋溶作用强,风化程度高,施氮导致土壤pH降低会促进土壤中可交换性Al3+和Fe3+含量上升,Al3+和Fe3+会和土壤中的有效磷结合形成较稳定的P,这可能也是土壤中有效磷含量减少的一个重要原因[37-38]。
3.3 土壤磷有效性变化的影响因素
Pearson分析显示,土壤因子对有效磷含量的影响主要在0~10 cm土层中,与10~20 cm土层有效磷含量的变化相关性不显著。且在0~10 cm土层中,有效磷含量变化主要与MBP含量、NO3--N含量显著相关(表3)。施氮后土壤MBP降低反映了氮沉降对土壤微生物的影响,而土壤微生物的降低可能影响磷酸酶的分泌,进而影响土壤有机磷的矿化和土壤有效磷的含量[11, 34, 39]。另一方面,微生物能通过自身代谢活动释放无机磷[11,33],施氮降低微生物的数量,从而降低了这部分有效磷的来源。此外,本研究区土壤酸性较强(pH接近4),氮沉降可能会增加土壤中的H+,也可能抑制磷酸酶活性和减少有机磷矿化,降低土壤有效磷含量。
4 结论
施氮显著降低了米槠天然林0~10 cm土层的有效磷和MBP的含量,但TP变化不显著,说明氮沉降主要改变表层土壤的有效磷含量,而TP对氮添加响应不敏感。相关分析发现表层(0~10 cm)土壤有效磷含量与MBP显著正相关,但与NO3--N含量显著负相关,说明施氮后土壤有效氮和土壤微生物量磷是有效磷变化的重要因素。未来研究还应关注地上植物吸收与土壤磷供应的关系,以进一步揭示未来氮沉降背景下森林生态系统的磷供应机制。

