柠檬苦素降解酶的分离纯化与酶学性质
刘川海,朱平平
(中南大学资源加工与生物工程学院,湖南长沙 410083)
1 实验方法
1.1 IDE的分离纯化
1.1.1 培养液的制备
将50 ml选择性液体培养基放置于250 ml锥形瓶内,121℃,进行20 min的灭菌处理,把种子液接种于选择性液体培养基内。37℃,180 r/min摇床培养,收集培养液,4℃,10 000 r/min,进行30 min的离心处理,收集上清液,在此基础上测定上清液的总酶活力与总朊饱和度。
1.2.2 饱和(NH4)2SO4沉淀
取离心后菌株的发酵上清液,在冰浴环境下,搅拌时加入饱和度不相同的固体(NH4)2SO4,4 ℃过夜沉淀后10 000 r/min,15 min离心,将沉淀用少量蒸馏水溶解,放在透析袋内予以透析除盐处理。
完成透析后,分别测定各饱和度及不同透析液的吴茱萸内酯IDE活力与朊量,在此基础上绘制出(NH4)2SO4沉淀峰值,并明确(NH4)2SO4沉淀的最适饱和度。
上清液以最适的(NH4)2SO4饱和度盐析后,4℃静置24小时,10 000 r/min离心30 min,剔除上淸液,把沉淀用少量蒸馏水溶解,放在透析袋内透析除盐24 min,就能够获取经初步纯化的粗酶液,在4℃环境下保存备用。
1.2.3 [C6H10O5]n凝胶G-100凝胶过滤层析
[C6H10O5]n凝胶G-100凝胶柱(1.6厘米×50厘米)装柱后,首先通过0.02 mmol、pH为4.0的C6H8O7缓冲液予以平衡处理,在此基础上将通过(NH4)2SO4沉淀、透析脱盐、浓缩后的粗酶液加到已预先被平衡过的凝胶柱内,同时用0.02 mmol、pH为4.0的C6H8O7缓冲液洗脱,流速1 ml/min,经自动部分收集器每5 ml收集一管,经紫外检测仪在280 nm波长区间予以全面检测,跟踪监测朊饱和度;依附于洗脱曲线,分别收集各洗脱峰值,并测定不同洗脱峰的降解吴茱萸内酯活性,明确具有降解吴茱萸内酯活性的目标峰并予以收集处理,合并后在4 ℃环境下透析,通过HO(CH2CH2O)nH浓缩至5 ml,在4 ℃环境下保存备用。
1.2.4 二乙氨乙基离子交换层析
二乙氨乙基离子交换柱(26厘米×20厘米)装好后,提前通过0.02 mol、pH为4.0的C6H8O7平衡缓冲液予以平衡处理,在此基础上将通过[C6H10O5]n凝胶g-100凝胶柱收集的活性峰浓缩后的样品上样,先经缓冲液洗脱至样品完全吸附,在此基础上经0~1 mmol的NaCl溶液予以线性梯度洗脱,流速控制在2 ml/min。经自动部分收集装置每5 ml收集一管,在280 nm波长区间择取紫外检测仪予以检测,跟踪监测朊饱和度;依附于洗脱梯度曲线分别收集各洗脱峰系数,在此基础上测定不同洗脱峰的降解吴茱萸内酯酶活性,明确具有降解吴茱萸内酯酶活性的目标峰并予以收集处理,完成合并后在4 ℃环境下透析浓缩,并在4℃环境中保存备用。
1.2.5 降解吴茱萸内酯酶纯度鉴定与分子质量测定
采用C12H25―OSO3Na凝胶电泳垂直板电泳法,鉴定酶的纯度并测定其分子质量。C12H25―OSO3Na凝胶电泳垂直板电泳采用12%的分离胶质量分数、电流强度为15毫安,浓缩胶质量分数为5%、电流强度为10毫安。电泳在3小时后停止,通过coomassie brilliant blueG-250予以染色,在脱色后实施拍照处理。
2 IDE酶学性质的研究
2.1 酶最适反应温度
分别选取25、30、35、40、45 ℃作为酶反应的温度,测定反应结构中的酶活力,以最高酶活力为100%。
2.2 温度对酶稳定性的影响
分别取10 ml酶液于35、45、55 ℃下恒温水浴中保温,每30 min吸取酶液各1 ml。立即于冰水中冷却,在此基础上取样测剩余酶活力,以最高酶活力为100%,绘制温度-相对残留酶活力曲线,进入明确温度对酶稳定性的影响。
2.3 金属离子对酶活力的影响
分别配制含终浓度为10.0 mmol/L的不同金属离子,其中包括Cu2+、Ca2+、Zn2+、Fe2+的标准溶液。
3 结果
3.1 IDE的分离纯化
3.1.1 (NH4)2SO4沉淀
分别在10%-90%的饱和度(NH4)2SO4将上清液沉淀后,测定其透析液的朊析出量,作(NH4)2SO4饱和度-朊析出量曲线,如图1所示,在(NH4)2SO4的饱和度超过90%,上清液中的朊析出量达到极值;40%~80%饱和度区间,随(NH4)2SO4的饱和度的提高而递增:在(NH4)2SO4的饱和度超过80%状态下,朊析出量并未出现明显的提升。
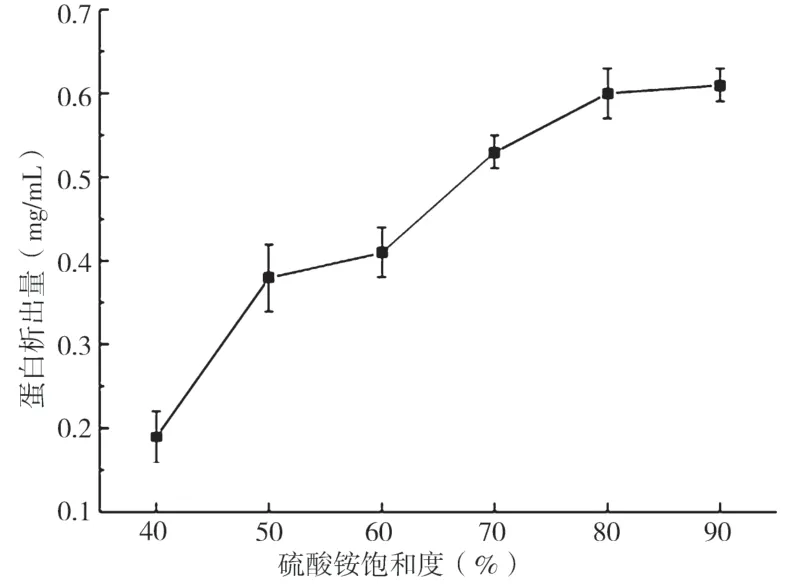
图1 (NH4)2SO4饱和度对朊析出量的影响
3.1.2 [C6H10O5]n凝胶G-100凝胶过滤柱层析
将经(NH4)2SO4沉淀、透析脱盐、浓缩后的朊样品上[C6H10O5]n凝胶G-100凝胶过滤柱得到如图2所示的洗脱曲线。如图2所示,上清液经凝胶过滤柱处理后,出现两个较为突出的洗脱峰,同时合并相同峰的洗脱液,浓缩后测定不同峰朊含量与降解吴茱萸内酯酶活性。结果表明,峰1中朊含量为0.02 mg/ml,降解吴茱萸内酯酶活力为19.47 μg,峰2内朊含量为0.0133 mg/ml,活性为375.54 μg,通过比较,峰2有降解吴茱萸内酯活性。
3.2 二乙氨乙基柱层析
通过二乙氨乙基柱层析分离后,朊主要集中于9~42管,同时在第16、37管岀现两个活性峰,其中第16管朊含量达到极值,超过0.8325 μg/ml;吴茱萸内酯IDE主要集中在第7~26管,其中在第16管出现一个峰值。通过洗脱曲线可发现,吴茱萸内酯降解集中在7~26管被洗脱岀来,和35~42管的杂朊分离。通过分析对比,将7~26管的收集液作为纯化分离后的酶液,通过透析、浓缩后测定吴茱萸内酯IDE活力为64.% U/μg。
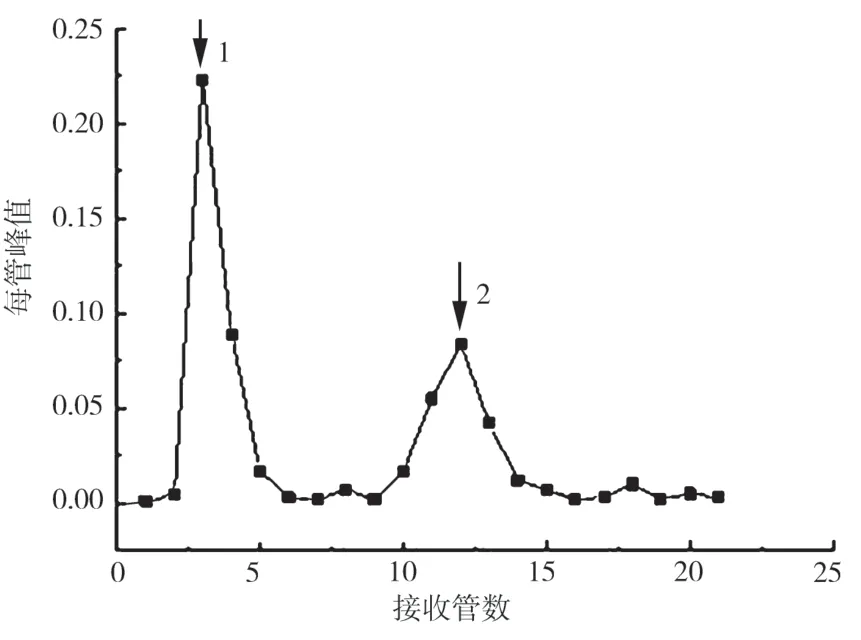
图2 粗朊通过[C6H10O5]n凝胶G-100纯化
3.3 酶纯化结果
发酵上清液经(NH4)2SO4盐析、[C6H10O5]n凝胶G-100层析、二乙氨乙基柱层析后,各纯化流程后所获取的酶的比活力、纯化倍数与酶活力回收率的表现为:粗酶液在通过3个的分离纯化操作后,酶的纯化倍数为9.54倍,酶活力回收率0.92%,比活力为354.51 U/μg,纯化效果显著。
4 IDE酶学性质的研究
4.1 温度对酶活力的影响
在25~35 ℃的范围内,吴茱萸内酯IDE相对酶活力依附于温度的提升而增加;在温度为35 ℃状态下,该酶活力达到极值;而在35~45 ℃区间,依附于温度的增加,酶活性出现了一定程度的衰减,不过其下降幅度相对缓慢。所以,35 ℃是该酶的最适反应温度。
4.2 温度对酶稳定性的影响
该酶在35 ℃状态下相对稳定,酶活力有一定程度的改变。在45 ℃状态下,依附于时间的增加,IDE活力逐渐衰减,50 min后其酶活力损失约20%,而处于55 ℃状态下,依附于保存时间的增加,吴茱萸内酯IDE活力迅速衰减,由此可证该IDE的耐热性不佳。
4.3 金属离子对酶活力的影响
Fe3+对酶活力的促进作用相对显著,Cu2+与Fe2+对酶活力无显著影响,不过Ca2+与Zn2+对酶活力有明显的抑制。
5 结论
综上所述,此次研究通过(NH4)2SO4沉淀、透析、浓缩、 [C6H10O5]n凝胶 C-100凝胶过滤层析、二乙氨乙基柱层析对6号菌株在最佳发酵环境中培养所获取发酵液中所产的吴茱萸内酯IDE予以纯化及特性硏究。在(NH4)2SO4的饱和度超过90%,上清液中的朊析出量达到极值;40%~80%饱和度区间,依附于(NH4)2SO4的饱和度的提高而递增:在(NH4)2SO4的饱和度超过80%状态下,朊析出量并未出现明显的提升。该酶在35 ℃状态下相对稳定,酶活力有一定程度的改变。在45 ℃状态下,依附于时间的增加,吴茱萸内酯降解酶活力逐渐衰减,50 min后其酶活力损失约20%,而处于55 ℃状态下,依附于保存时间的增加,吴茱萸内酯降解酶活力迅速衰减,由此可证该吴茱萸内酯降解酶的耐热性不佳。Fe3+对酶活力的促进作用相对显著,Cu2+与Fe2+对酶活力无显著影响,不过Ca2+与Zn2+对酶活力有明显的抑制。通过C12H25―OSO3Na凝胶电泳,纯化后吴茱萸内酯IDE的分子量达到了电泳纯,在35℃条件下吴茱萸内酯IDE的热稳定性优异。Fe3+能够促进吴茱萸内酯IDE活性的提高,Ca2+与Zn2+对酶具有显著的抑制作用。

