对2019年高考全国卷Ⅰ理综28题的深度分析与教学启示
湖南
一、研究背景
2019年高考试题以学科素养为抓手,将核心价值、学科素养、关键能力和必备知识等考查内容有机结合,注重基础性、综合性、应用性和创新性的考查。通过创设具有探索性的问题情境,加大对核心素养考查的力度,有利于发挥高考选材功能,强化教学核心素养导向。全国卷Ⅰ理综28题,素材新颖、情境真实,凸显了对学科素养的考查,堪称试题典范。部分教师觉得不易理解,故本文对此进行深度分析,希望对大家有所作用。
二、高考原题

(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.025 0。②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.019 2。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO________(填“大于”或“小于”)H2。
(2)721℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为________(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
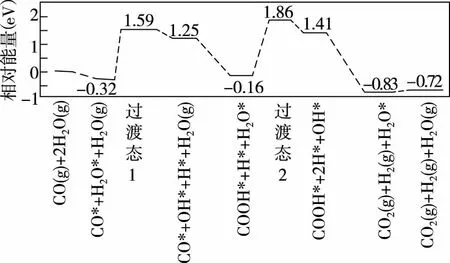
可知水煤气变换的ΔH________(填“大于”“等于”或“小于”)0。该历程中最大能垒(活化能)E正=________eV,写出该步骤的化学方程式:________________。
(4)Shoichi研究了467℃、489℃时水煤气变换中CO和H2分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体系中的pH2O和pCO相等、pCO2和pH2相等。

三、详细分析


物质的量分数x平衡0.025 0 1-0.025 0=0.975
[上式中n平衡=平衡时n(H2O)+n(H2)]
可见,对于反应前后气体物质的量相等的可逆反应,可用平衡时各气体组分的物质的量分数(或物质的量)代替其平衡浓度直接计算浓度平衡常数Kc。据此求下列反应的Kc:
物质的量分数x平衡0.019 2 1-0.019 2=0.980 8
这两个平衡常数的数值,就是该物质还原CoO能力大小的一个“标尺”。显然Kc2>Kc1,即还原CoO(s)为Co(s)的倾向为CO大于H2,或者说721℃下,CO夺取氧的能力大于H2。
虽然高中课本未涉及分压平衡常数Kp,但从2014年开始,高考全国卷中就开始以提供信息的方式考查Kp。那么,能否用Kp比较?Kp与Kc又有何关系?现以Kp1为例推断如下:

(上式中p平衡=平衡时pH2O+pH2)
可见,对于反应前后气体物质的量相等的可逆反应,相同温度下,Kp=Kc。即
上述比较Kc2与Kc1大小的过程也可以改为比较Kp2和Kp1大小的过程。另外,上述结论在后面第(2)、(4)问的解决过程中也可以运用,进而加强学生对分压平衡常数的理解,减少他们的陌生感。


分析方法②:根据多重平衡原理分析,
由②-①得:

在此基础上,可引导学生用不同思路推断平衡时H2的物质的量分数范围。
解法一:假设法
由于该小问是一个选择性判断,学生可充分利用选项中提供的数据,用假设法快速判断。
若H2的物质的量分数为0.25,则根据题意可知:
物质的量分数x起始0.50 0.50 0 0
物质的量分数x某时刻0.25 0.25 0.25 0.25
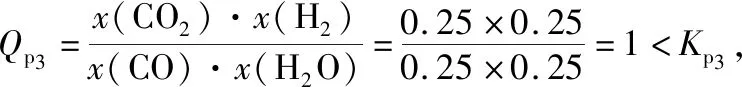
若H2的物质的量分数为0.50,根据反应的化学方程式可知,CO2的物质的量分数亦为0.50,即反应物的转化率达100%,与该反应为典型的可逆反应这一事实不符,即平衡时H2的物质的量分数必然小于0.50。综上所述,平衡时H2的物质的量分数范围为0.25~0.50。
解法二:不等式法
学生也可直接利用该反应在721℃时的Kp3>1进行正向思维计算判断。
设721℃时该反应达平衡时H2的物质的量分数为x,物质的量分数之比=物质的量之比,故可将物质的量分数直接代入方程式进行分析:

总之,由于河套问题的出现,在北部边防沉重的军事压力之下,卫所制度趋于崩溃的同时,为有效抵御蒙古部落的入掠,募兵制和军事家丁制度逐渐兴起。但这也无异于饮鸩止渴,由此产生大量冗兵的军费造成了政府财政的超负荷运转,为明王朝的加速覆亡埋下了伏笔。
物质的量分数x起始0.50 0.50 0 0
物质的量分数x平衡0.50-x0.50-xxx

又由于可逆反应达平衡时反应物的转化率小于100%,即平衡时各组分的物质的量分数均大于0,可知0.50-x>0,解得x<0.50。综上所述,平衡时H2的物质的量分数范围为0.25~0.50。
另外,课堂上当学生想一探究竟时,也要呵护学生的积极性。
解法三:常规法

物质的量分数x起始0.50 0.50 0 0
物质的量分数x平衡0.50-x0.50-xxx

在运用数学方法进行解方程、不等式或运用公式的过程中,要特别注意每个代数式、公式的化学含义及适用条件,只有这样,才能更好地运用数学知识解决化学问题。
以上解法三中,根据确切的Kp3计算平衡时H2的物质的量分数增加了计算量,耗费了更多的时间。可见,在平时的课堂教学中选择不同的思维方法,不仅能因材施教,照顾不同学生思维方式的差异性,同时还能培养学生思维的全面性、深刻性、灵活性;在考场上,针对不同的设问方式,学生才能用敏锐的眼光捕捉试题中所给的有效信息,快速作出判断,优化解决问题的策略。
部分学生可能由于阅读理解能力不够强、基础知识不够扎实或意志品格不够坚定,遇到难度较大的问题或看似“已知条件不够”的问题,没有深入思考与展示思维过程的好习惯,往往是粗粗浏览一下试题就有可能放弃。而通过引导学生进行上述的推导及分析,能使学生坚信,只要理解题意,善于把实际问题转化为化学问题,大都可以化难为易。比如,平衡常数的推导计算,先写出平衡常数的表达式,再顺藤摸瓜,逐步找出试题中的已知条件,挖掘其中隐含条件,并关联已有知识,敢于尝试,将抽象的思维从内隐走向外显,就可逐步找到思路,并进行深入推导,从而构建解决各类问题的一般思维模型;遇到具体问题时,又能灵活调整解题策略,从而在遇到困难时能树立信心,进入“山重水复疑无路,柳暗花明又一村”的境界。




仔细分析该图象,除了上文提到的反应要经历两个过渡态外,还可知其他信息:
①开始吸附阶段:相对能量由0 eV降到-0.32 eV,为放热过程。
②最后的脱附阶段:相对能量由-0.83 eV升高到-0.72 eV,为吸热过程。
③中间阶段:相对能量分别由1.25 eV降到-0.16 eV,1.41 eV降到-0.83 eV,均为放热过程,表观活化能均小于0。
怎样理解表现活化能小于0的反应过程呢?处于激发态的自由基,复合成分子时回到基态,会释放出能量,使表观活化能出现负值。
笔者对这个复杂反应历程图的理解是:在整个反应历程中有4个基元反应,其中两个反应涉及正活化能,两个反应的活化能为零。
该问的设置拓宽了学生的认知视野,使学生认识到大多数化学反应并不是一步完成的,而是经过几个基元反应分步完成的,催化反应更是如此,同时意识到影响反应速率因素的复杂性。
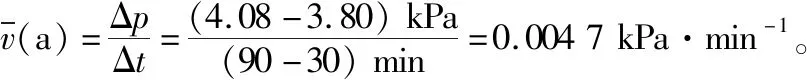
通过该问题的设置,使学生明白中学课本上反应速率的表达式是针对一般情况的,从而防止学生认识僵化。

由题知467℃、489℃水煤气变换实验的初始体系中pH2O和pCO相等、pCO2和pH2相等,为了让起始条件更明朗,不妨进行下列题设:

p起始p1p1p2p2

p起始p3p3p4p4
在接下来的分析中,至关重要的一点是帮助学生理清对分压-时间图的正确理解。
学生可能存在的第一个困惑:p1是否等于p2?p3是否等于p4?p1是否等于p3?p2是否等于p4?读图可知t=0时纵坐标上出现了四个不同的pCO或pH2分压,显然p1≠p2≠p3≠p4。对上述已知条件的分析有助于提升学生理解能力,消除学生潜在的认知困惑。
学生可能存在的第二个困惑:为什么图象中只画出了两种不同温度下的pCO、pH2?因为两种不同温度下均有pCO=pH2O、pCO2=pH2,故两种不同温度下的pCO与pH2O必然重合,pCO2和pH2也必然重合,也就是说,每种温度下,反应物和产物都只能取其中一种物质,图象中总共4条分压-时间曲线。
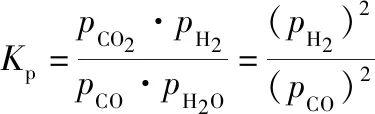
从前文计算及分析可知,721℃时,Kp3=Kc3>1,即pH2>pCO。
分析方法①:要判断四条曲线分别对应哪种温度下的pCO或pH2,最容易想到的是先判断哪两条曲线对应的是同一温度下的反应。
读图可知30~90 min内:
a曲线:Δpa=4.08-3.80=0.28 kPa
b曲线:Δpb=3.64-3.30=0.34 kPa
c曲线:Δpc=2.21-1.87=0.34 kPa
d曲线:Δpd=1.49-1.21=0.28 kPa
因为Δpa=Δpd=0.28 kPa,Δpb=Δpc=0.34 kPa,由方程式中化学计量数的关系可知,a、d代表的是某相同温度下pH2或pCO的变化曲线,b、c代表的是另一相同温度下pH2或pCO的变化曲线。又由于pH2>pCO,可知a、b代表的是pH2,c、d代表的是pCO。该反应的ΔH<0,故其他条件不变时,降低温度,平衡右移,即平衡时pH2(467℃)>pH2(489℃)、pCO(467℃) 学生可能存在的第三个困惑:算出四条曲线30~90 min 时的Δp后,为何不能认为Δp大的是对应较高温度下的曲线?这种认识的根源在于只看到了温度对反应速率的影响,忽视了压强对反应速率的影响。因为同一温度下反应中总压始终不变,若选择30 min时的数据进分析:467℃时,p总=3.30×2+2.21×2=11.02 kPa;489℃时,p总=1.21×2+4.08×2=10.58 kPa。温度相对较低的,压强相对较大;温度相对较高的,压强相对较小。其他条件不变时,对于该反应而言,温度升高或压强增大时反应速率均增大。该反应低温时压强大、高温时压强小,因此,只从温度角度判断反应速率是不正确的。 分析方法②:因为在同一温度下反应的总压始终不变,pCO+pH2为定值。曲线a、d在30 min时分压之和为4.08+1.21=5.29 kPa,90 min时分压之和为3.80+1.49=5.29 kPa,两者相等;曲线b、c在30 min时分压之和为3.30+2.21=5.51 kPa,90 min时分压之和为3.64+1.87=5.51 kPa,两者相等。说明曲线a、d对应同一温度的反应数据,b、c对应另一温度的反应数据,然后在此基础上用解法一的后续思路得出正确结论。 由此,可以感受到命题专家高超的智慧,试题的呈现与设问方式充分尊重学生思维方式的差异性。 学生可能存在的第四个困惑:为什么467℃时CO的分压减小、H2的分压增大,即反应从正反应方向建立平衡;而489℃时H2的分压减小、CO的分压增大,即反应从逆反应方向建立平衡? 此时可引导学生读图,通过计算帮助学生解决困惑。 p起始/kPa 2.6 2.6 2.8 2.8 p平衡/kPa 1.5 1.5 3.9 3.9 显然Qp p起始/kPa 0.8 0.8 4.4 4.4 p平衡/kPa 1.6 1.6 3.6 3.6 (因起始时和平衡时的分压较难读准,此为近似值) 显然Qp>Kp,反应从逆反应方向建立平衡,即pCO渐大、pH2渐小,直至反应达到平衡。 不难看出,第(4)问与第(1)(2)(3)问的设置紧密相关,只有将前三问的结论应用于第(4)问,才能推理出第(4)问,该问对思维的全面性、综合性、深刻性和灵活性要求更高。在教学中,需合理利用试题,引导学生自己搭建思维台阶,逐步分析,解决问题。 另外,从图象中还可看出,可逆反应达到平衡状态所需的时间很长,启示我们化工生产中不一定要追求化学平衡状态。 该题以水煤气的变换为载体,要求学生在掌握反应原理的基础上,根据实验数据关系图表、运用化学基本原理分析反应过程中的能量变化,判断反应历程和机理,推测温度等因素对反应速率及化学平衡的影响。试题涉及气体分压、反应热、活化能、反应速率、化学平衡常数等方面的知识。该题综合性很强且难度较大,要求学生能结合试题新颖的设问方式,避开常规思维进行巧妙判断与灵活计算。实验结合计算机模拟图象的题型不常见,试题设计新颖,分步设问、层层递进、环环相扣、首尾呼应,构建了逻辑严谨的试题结构,具有很高的区分度。该题侧重考查学生的理解能力、挖掘信息能力、数据分析能力、推理演绎能力、归纳总结能力、反思评价能力以及对已学知识进行关联并熟练运用和迁移的能力,主要渗透了对“证据推理与模型认知”核心素养的考查,要求学生具有证据意识,能基于证据对物质组成、结构及其变化提出可能的假设,通过分析推理加以证实或证伪;建立观点、结论和证据之间的逻辑关系。通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律。也渗透了对变化观念和平衡思想的考查:能认识物质是运动和变化的,知道化学变化需要一定的条件,并遵循一定规律;认识化学变化的本质特征是有新物质生成,并伴有能量转化;认识化学变化有一定限度的,是可以调控的;能从多角度、动态地分析化学变化。 第(3)问来源于我国化学工作者发表在顶级刊物Science的文章《沉积在α-MoC上单层金原子对水煤气的低温催化反应》,试题以文章中的单原子催化能量变化的理论计算模型为情境素材,让学生认识、分析催化吸附机理及反应过程中的能量变化。通过扩大试题素材来源,减少学生反复刷题、机械训练的情况,引导教师在实际教学中遵循教学规律,通过设置真实的问题情境、新颖的试题呈现方式,使“死记硬背”“机械刷题”“题海战术”没有市场,既提高试题的区分度,又引导教师注重学生从“解题”到“解决问题”的能力培养、从“做题”到“做人做事”的素养提升。同时试题中还呈现了我国科学家发表的世界领先的科技成果,增强了科技成就感和民族自豪感,激发学生的爱国热情。

四、试题评价
五、教学启示


