教学考试杂志社“优师计划”——2019年高考真题结构化研究与实践项目成果选登
一年一度的高考结束了,2019年高考化学紧紧围绕“立德树人、服务选才、引导教学”的核心功能进行命题,内容符合《普通高中化学课程标准》(2017年版)以及《2019年化学考试大纲》的要求,试卷整体难度适中,梯度分布合理,区分度高,对中学化学教学具有良好的导向作用。
2019年全国高考卷以连接基础教育和高等教育的重要枢纽为直接要求,以落实立德树人,培养德智体美劳全面发展的社会主义建设者和接班人为最终目的,回归教材,遵循考纲,科学命制。试卷落实“四翼”(基础性、综合性、应用性、创新性)考查要求,在继承以往试题优点的基础上优化创新,以考查必备知识,测评关键能力为突破口突出化学核心素养的考查,夯实学生全面发展基础。坚持以真实情境为测试载体、以实际问题为测试任务、以化学知识为解决问题的工具,实现对学生化学学科素养的测试。目前中学化学教学与以前相比较,最为显著的区别是将化学从宏观到微观的细化,从定性到定量的提升,从描述性到理论性的大幅度跨越。这种表现,在高考试卷中体现得淋漓尽致。下面以3套高考全国卷中的化学平衡原理大题为例,进行具体分析。
一、2019年高考全国卷Ⅰ真题分析

(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.025 0。②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.019 2。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO________(填“大于”或“小于”)H2。
(2)721℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为________(填标号)。
A.<0.25 B.0.25 C.0.25~0.50
D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
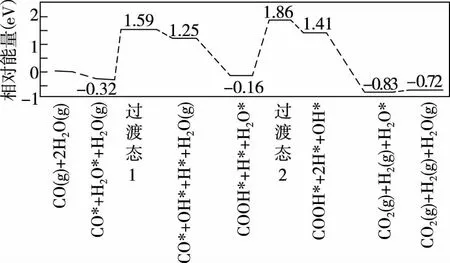
可知水煤气变换的ΔH________(填“大于”“等于”或“小于”)0。该历程中最大能垒(活化能)E正=________eV,写出该步骤的化学方程式:____________________。
(4)Shoichi研究了467℃、489℃时水煤气变换中CO和H2分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体系中的pH2O和pCO相等、pCO2和pH2相等。

【答案】(1)大于
(2)C

(4)0.004 7 b c a d
全国卷Ⅰ28题考查教材《化学反应原理》中的内容,涉及平衡常数、活化能与相对能量、反应速率计算、平衡图象与平衡常数运用、反应过程以及平衡压强变化等知识,考查了“变化观念与平衡思想”“证据推理与模型认知”的化学学科核心素养。
以水煤气交换为背景,考查化学反应原理的基本应用,注重学生学科能力的培养,难点在于材料分析和信息提取,图象形式比较新,提取信息能力较弱的学生,会比较吃力。题中第(3)问来源于我国化学工作者发表在顶级刊物Science中的文章《沉积在α-MoC上单层金原子对水煤气的低温催化反应》,试题以文章中的单原子催化能量变化的理论计算模型为情境,让学生认识、分析催化吸附机理及反应过程中的能量变化。
1.考查知识
(1)平衡转化率与反应倾向(平衡常数)。
(2)根据平衡常数估算平衡体系中某组分的百分含量。
(3)根据相对能量图象计算反应活化能、书写化学方程式,并判断焓变正、负号。
(4)利用三段式计算平衡常数、反应速率;根据平衡常数大小,判断平衡体系中各组分含量与图象的相关性。
2.关联知识
(1)阿伏加德罗定律及其推论。即在相同温度、相同体积(刚性容器)中,气体总压强与气体总物质的量成正比,气体分压与气体物质的量成正比。
(2)等效平衡。相同温度下,同一可逆反应,从反应物和产物分别建立平衡,效果相同。即在相同温度下,从H2和CO2开始反应或从CO和H2O开始反应,都能达到同一平衡状态且CO反应趋向大于H2,平衡时H2体积分数大于CO。

信息位置提取、加工、整合信息与解题关联可逆反应本题涉及的三个可逆反应都是等气体分子数的反应,暗示计算平衡常数与体积无关。利用可逆反应式加和关系可以计算总反应式的平衡常数。实验结果实验中,平衡体系中CO、H2的含量不同,可以推知,CO反应趋向大于H2,即CO的转化率大于H2。图象图象1:相对能量与反应进程。从图象中可以看出哪一步活化能大、哪一步活化能小以及反应物和产物等,活化能等于过渡态稳定的能量与起始态能量之差,注意单位不是kJ·mol-1,而是eV;从起态和终态相对能量可以看出,该反应物总能量较大,产物总能量较小,反应是放热反应。图象2:气体分压与时间图象。可以看出平衡时哪种气体分压较大(含量较大)。
二、2019年高考全国卷Ⅱ真题分析



A.通入惰性气体
B.提高温度
C.增加环戊烯浓度
D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L-1



该电解池的阳极为________,总反应为____________________________________。电解制备需要在无水条件下进行,原因为________________。
【答案】(1)89.3
(2)40% 3.56×104BD
(3)CD
全国卷Ⅱ27题考查了利用盖斯定律求反应热、利用差量法计算转化率、计算平衡常数、判断影响平衡移动的因素、外界因素对速率的影响、阳极的判断、电极反应式的书写以及条件控制等知识。
化学反应原理综合题以真实的情景为依托,将热化学、电化学、化学反应速率及平衡知识融合到一起命题,对思维能力要求较高。考查考生能够多角度、综合化学变化解决实际问题的能力,要求学生能从陌生物质的化学反应抽象出具体模型与常见的认知模型类别,并运用适当原理解释或推测物质的组成、结构、性质与变化,体现了“变化观念与平衡思想”的化学学科核心素养。
1.调用知识
(1)认知维度:认知维度中的理解、应用、分析与综合层次,学生进行辨认、联想和归类,用恰当的化学用语解释和说明。
(2)关联知识点:Kc与Kp区别。
(3)体现的化学学科思想:动态平衡思想,内、外因思想,条件控制与选择思想。
2.试题分析
本题设计了关于反应热、转化率、平衡常数的计算、利用原理分析外因对速率和平衡的影响、电解池等知识的问题,是高中化学的主干知识,(3)、(4)问中的图象设计巧妙,信息量大,提高了试题的难度。
3.反思提升
(1)试题知识层面
①得分点:反应热、转化率是常规考点,学生按部就班处理,得分比较容易,电解池阳极电极反应式也很容易书写。
②易错点:第(2)问平衡常数的计算;第(4)问电极反应式的书写。
③难点:考查了压力平衡常数,计算数据繁锁、复杂,学生不熟悉变换方法。第(3)问有关化学反应速率的计算与判断,很容易忽视条件的变化。
(2)解题思维:本题属于化学平衡原理方面知识比较集中的考题,扎实的理论基础是得分的关键,同时要充分挖掘信息,理清条件应用范围,表述准确、规范。
(3)答题技巧:强调基于分析得出结论,强调从证据到结论的逻辑性,强调结论表达的规范性(给出表达范式),突出变量控制的思想。
三、2019年高考全国卷Ⅲ真题分析
【例3】(2019·全国卷Ⅲ·28)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:


可知反应平衡常数K(300℃)________(填“大于”或“小于”)K(400℃)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=____________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是________________________________。
(2)Deacon直接氧化法可按下列催化过程进行:
ΔH1=83 kJ·mol-1
ΔH2=-20 kJ·mol-1
ΔH3=-121 kJ·mol-1

(3)在一定温度的条件下,进一步提高HCI的转化率的方法是______________________________________________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示。

负极区发生的反应有________________(写反应方程式)。电路中转移1 mol电子,需消耗氧气________L(标准状况)。

(2)-116
(3)增加反应体系压强、及时去除产物

1.命题维度
(1)题目素材来源于19世纪60年代时,Deacon开发了催化氧化HCl制氯气和电解氯化氢回收氯气的新技术。
(2)本题涉及的知识点有反应速率的表达;温度与压强对反应平衡的影响;初始浓度、平衡浓度的关系;平衡常数;温度与压力对平衡的影响;平衡的移动;反应的热效应;利用化学反应平衡的三段式计算化学反应速率、平衡常数K、转化率、浓度等。化学平衡移动问题结合勒夏特列原理,考查了判断平衡点,平衡移动的原因,提高转化率的方法,排温度或压强顺序等知识。
(3)考查能力:接受、吸收、整合化学信息的能力,分析和解决化学问题的能力。
(4)核心素养
①变化观念与平衡思想:认识反应条件对化学平衡的影响,能运用化学反应原理分析影响化学变化的因素。
②宏观辨识与微观探析:能运用化学符号和定量计算等手段说明物质的组成及其变化。
③科学精神与社会责任:认识化学、技术、社会和环境之间的相互关系,深刻认识化学对社会发展的重大贡献,能运用已有知识和方法综合分析、全面认识化学过程对自然可能带来的各种影响;具有保护环境和合理开发、利用资源的意识,理解可持续发展和绿色化学的思想观念。
2.解题维度
(1)调用知识:运用盖斯定律进行相关热化学方程式的运算;根据实验数据关系图表、运用化学基本原理进行正确分析,定性或定量描述浓度、温度等因素对反应速率及平衡变化的影响。
(2)认知维度:辨认、复现、联想、解释、举例、计算。
(3)本题以氯化氢转化为氯气反应为情境,突出了化学在污染源处理、环境保护方面所起到的重要作用,考查了现行中学化学课程中化学反应原理及其规律,了解相应的实验方法。本题强调加强化学基本原理的学习、理解和灵活运用,体现了对化学学科内基础知识整合的基调。高考几乎每年都有考查反应热、化学反应速率和化学平衡等知识的题目,该类试题的常考题型有:
①通过键能或盖斯定律计算反应热,书写热化学方程式;
②分析图象或者表格;
③反应条件对化学反应速率和化学平衡的影响;
④电化学中的电极反应式书写和相关计算。
3.反思提升
(1)知识层面—分析试题
题中第(3),问不能将速率和平衡移动混为一谈,速率是化学动力学问题,平衡是化学热力学问题。影响速率的主要因素有浓度、温度、压强、催化剂、固体表面积和形成原电池等;影响平衡的因素只有浓度和温度(压强的因素归结为浓度),平衡移动用勒夏特列原理解释。
(2)解题思维—看图象
一看面(横、纵坐标的意义);二看线(线的走向和变化趋势);三看点(起点、拐点、终点);四看辅助线(如等温线、等压线、平衡线);五看量的变化(如浓度变化、温度变化)。
(3)答题技巧
①审题——浏览全题、明确已知和所求,挖掘解题切入点
a.阅读题目信息,找出提供的已知信息;
b.解读题目所求,挖掘主要的题干条件。
②析题——仔细审读,关注有效信息
a.对于化学平衡图象类试题
明确横纵坐标的含义→理解起点、终点、拐点的意义→分析曲线的变化趋势
b.对于图表数据类试题
分析数据→研究数据间的内在联系→找出规律→挖掘数据的隐含意义
c.对于电解质溶液类试题
明确溶液中物质类型及其可能存在的平衡类型。
③答题——合理切入、规范答题
a.针对题目中所设计的问题切入;
b.联系相关理论切入;
c.注意文字表达(因果、对比)、书写规范。
④查漏——仔细检查,突破搁置难点
四、备考方略


