试剂顺序有讲究 发展能力显身手
江苏
高中化学学科核心素养是学生综合素质的具体体现。其中“证据推理与模型认知”素养中提出要有证据意识,能基于证据对物质组成、结构及其变化提出可能的假设,通过分析推理加以证实或证伪;“科学探究与创新意识”素养中提出能发现和提出有探究价值的问题,能从问题和假设出发,运用化学实验、调查等方法进行实验探究。在新的高中《化学课程标准》中还明确提出:“化学实验是研究和学习物质及其变化的基本方法,是科学探究的一种重要途径”“体会实验条件的控制对完成科学实验及探究活动的作用”。高考试题中对实验的考查向来是重点,实验中试剂的滴加顺序或者试剂的选择顺序对实验的结果有重要影响。
在高中教学中,教师要善于发现和挖掘有关试剂顺序的实验,并引发学生思考、引导学生进行探究。下面我就通过几个案例来谈谈在实验过程中如何通过试剂的滴加或选择顺序来探究物质的检验或性质,并通过高考试题的解析,培养学生能力,提升学生的化学学科核心素养。
一、离子检验中显身手
【例1】(2018·天津卷·4·节选)由下列实验及现象推出的相应结论正确的是
( )

实验现象结论D.①某溶液中加入Ba(NO3)2溶液②再加足量盐酸①产生白色沉淀②仍有白色沉淀原溶液中有SO2-4
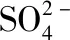
【例2】下列设计的实验方案能达到实验目的的是
( )

B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象
D.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液
【答案】B


问题如下:①白色沉淀一定是硫酸钡吗?②加稀盐酸的作用是什么?能换成稀硝酸吗?③滴加BaCl2溶液和稀盐酸有先后之分吗?

这种试剂滴加顺序的检验在Fe2+的检验中也有异曲同工之处,在苏教版化学《必修1》“铁、铜及其化合物的应用”这一节中,其中一个重要知识点就是Fe2+和Fe3+的检验,常用的方法有3种,如表1。

表1 Fe2+和Fe3+的区别方法
这是对已知的Fe2+和Fe3+的鉴别,但对于未知溶液中是否存在少量的Fe2+,上面3种方法就显得说服力不足。方法一,若溶液中Fe2+浓度比较小或者含有其他有色离子,则不能鉴别Fe2+是否存在。方法二,加氢氧化钠溶液产生的白色沉淀的还可能是Mg2+等;方法三,加KSCN溶液无现象,那就存在太多的可能性了。那么该如何检验呢?其实最有效的方法还是依靠KSCN溶液这种特效试剂来进行检验,具体方法是先加KSCN溶液无现象,再加几滴氯水,溶液立即变成血红色,则说明含有Fe2+。
二、物质探究中显身手
【例3】(2018·全国卷Ⅱ·28·节选)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有________、________。
③为防止倒吸,停止实验时应进行的操作是________________________________。
【答案】(2)①隔绝空气、使反应产生的气体全部进入后续装置 ②CO2CO ③先熄灭装置A、E处的酒精灯,冷却后再停止通入氮气
【解析】(2)①通入氮气的目的是赶走空气,防止空气中的CO2影响实验,并使反应产生的气体全部进入后续装置;②B处澄清石灰水变浑浊,则证明热分解产物中含有二氧化碳;E处固体变为红色,F处澄清石灰水变浑浊,则证明分解产物中含有CO。③先熄灭装置A、E处的酒精灯,冷却后再停止通入氮气,这是防倒吸的常见操作。
【追本溯源】在苏教版化学《必修1》中“硫酸的制备与性质”这一节,在“观察与思考”实验中对浓硫酸脱水性进行了探究,根据实验现象,蔗糖变黑,呈蓬松状,有刺激性气味气体产生,由此我们分析可能生成的气体有CO2、SO2,那么如何设计实验来检验呢?这两种气体的检验有没有先后顺序之分呢?其实,可以把上述两个问题进行分解:①如何检验CO2、SO2;②SO2能使澄清石灰水变浑浊吗?如何排除干扰?③需不需要检验干扰气体是否排净了呢?如何检验?
经过一番思考后,得出结论:先通入品红溶液,若溶液褪色说明含有SO2,然后再通入酸性KMnO4溶液,除去SO2,再通入品红溶液来检验SO2是否除干净,最后通入澄清石灰水,若石灰水变浑浊,则说明含有CO2。(图1为实验装置图)

图1
【点评】通过上面实验中试剂顺序的选择,不仅培养了学生的探究能力,还培养了学生全面思考问题的能力。
对于实验试题中出现了两次的同种试剂,一般是前者是用于检验某种物质,然后通过后续的操作进行除去,第二次出现是再次验证该物质,有的是判断是否除干净,有的是验证新反应中是否产生该物质。
三、物质除杂中显身手
【例4】(2016·全国卷Ⅰ·10·节选)下列实验操作能达到实验目的的是
( )
B.用向上排空气法收集铜粉与稀硝酸反应产生的NO
D.将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
【解析】由于NO易与空气中的氧气反应生成NO2,没有考虑除杂,B项错误;将Cl2与HCl混合气体通过饱和食盐水,只除去了HCl气体,同时又引入了新杂质水蒸气,D项错误。
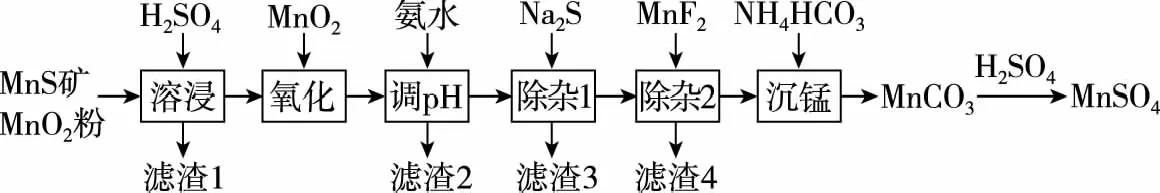
【例5】(2019·全国卷Ⅲ·26·节选)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:

金属离子Mn2+Fe2+Fe3+Al3+Mg2+Zn2+Ni2+开始沉淀的pH8.16.31.53.48.96.26.9沉淀完全的pH10.18.32.84.710.98.28.9
(2)“氧化”中添加适量的MnO2的作用是______________________________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为________~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是________。
【答案】(2)将Fe2+氧化为Fe3+(3)4.7 (4)NiS和ZnS
【解析】(2)本题首先要学会看懂表格中离子沉淀的pH,我们要得到MnSO4则要保留Mn2+,而Mn2+在pH为8.1时开始沉淀,但是Fe2+在8.3才完全沉淀,因此要先把Fe2+转化成Fe3+。二氧化锰作氧化剂,使MnS反应完全,同时将溶液中Fe2+氧化为Fe3+。(3)由表中数据知pH在4.7时,Fe3+和Al3+沉淀完全,所以应该控制pH在4.7~6之间。(4)根据题干信息,“除杂1”的目的是除去Zn2+和Ni2+,所以加入Na2S是为了除去Zn2+和Ni2+,所以滤渣3是生成的沉淀ZnS和NiS。
【追本溯源】在苏教版化学《必修1》“氯气的实验室制法”中,用MnO2与浓盐酸制取氯气,在演示实验后引导学生思考按照书本上的装置进行反应,制取的氯气是否是纯净的氯气(如图2所示),如果得到的不是纯净的氯气,可能含有什么杂质?又应该增加什么装置来除去杂质气体呢?这些杂质气体的除去有先后顺序吗?以此引发学生思考,讨论以后可知,应该先用饱和食盐水除去HCl气体,再用浓硫酸除去水蒸气,如果顺序颠倒会带入水蒸气,从而不能得到纯净的氯气,正确的装置如图3所示。在此过程中,不仅培养了学生分析问题、解决问题的能力,还培养了学生严谨的思维能力。

图2

图3 实验室制氯气装置示意图


