适配体-纳米金比色传感法检测磺胺二甲氧嘧啶
王卫平, 戴媛媛, 徐 珂, 张 莹
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
磺胺二甲氧嘧啶(SDM)是一种用于防治细菌感染的磺胺类药物,可通过食物链的富集作用累积在体内,从而损害人体泌尿和造血系统,产生过敏反应[1].目前报道的SDM检测方法有高效液相色谱法[2]、毛细管电泳法[3]、电化学法[4]等,但是这些方法存在操作复杂、设备昂贵、过程耗时、选择性不高等缺点,限制了其在现场检测方面的应用.因此,发展新型、简便、高效的SDM现场快速检测方法具有重要的意义.
适配体是一类通过指数富集配体的系统进化技术筛选得到的功能核酸,它能与靶标发生特异性的结合,具有易修饰、成本低、稳定性好等优点[5].近年来,基于纳米金(AuNPs)和适配体的新型比色传感法因其简便快速、灵敏度高、选择性好等优点,已广泛用于金属离子[6]和小分子[7-9]的检测.倪璇等[8]基于多菌灵适配体和AuNPs构建了一种新型比色适配体传感器,用于水体中杀菌剂多菌灵的检测.该比色传感法具有较低的检测限(2.3 nmol/L)和较宽的线性检测范围(2.3~800.0 nmol/L).Ramezani等[9]设计了一种基于三螺旋分子开关和AuNPs的适配体比色传感器,可用于复杂样品如牛奶和血清样品中四环素的检测,检测限低至266 pmol/L.
研究以具有良好的光学性质和生物相容性的AuNPs作为比色传导信号元件,具有高选择特异性的适配体作为传感探针,通过优化NaCl浓度、适配体浓度及适配体和AuNPs反应时间,构建了一种快速检测SDM的可视化比色传感方法.未加入SDM时,适配体吸附在AuNPs表面,可防止盐诱导下AuNPs的聚集,溶液为红色,紫外可见吸收峰在520 nm处.加入SDM后,适配体与SDM发生特异性结合,使得适配体从AuNPs表面脱落,导致AuNPs聚集,溶液颜色由红色变为蓝色,吸收峰红移至670 nm处.根据AuNPs在670 nm 和520 nm处吸光度比值(A670/A520)的变化,可实现SDM的定量检测.为了验证该比色传感法在实际样品中的应用性能,将其应用于尿样中SDM的分析检测,得到了较高的回收率.
1 实验部分
1.1 试剂与仪器
磺胺二甲氧嘧啶(SDM)、土霉素(OTC)、环丙沙星(CIP)、洛美沙星(LOM)购于国药集团化学试剂有限公司(上海);氯化钠(NaCl)购自阿拉丁试剂有限公司(上海).氯金酸、柠檬酸钠、SDM适配体(SBA,序列为:5′-C6-GAGGGCAACGAGTGTTTATAGA-3′[10])均购自生工生物工程股份有限公司(上海).适配体储备液浓度为4.3 μmol/L.所用试剂均为分析纯,实验用水为超纯水.所有溶液均在4 ℃下避光保存.
紫外可见分光光度计(T9CS型,北京普析通用仪器有限责任公司);透射电子显微镜(JEM-2100F,日本电子株式会社);电位分析仪(ZS90,马尔文仪器公司).
1.2 AuNPs的制备及表征
用于制备AuNPs的玻璃器皿均用新制的王水浸泡处理.AuNPs的制备基于文献[11]并加以改进,具体如下:向三颈烧瓶中加入50.0 mL氯金酸溶液(0.245 mmol/L),加热煮沸后,迅速加入3.0 mL柠檬酸钠溶液(34.3 mmol/L).当溶液呈酒红色后,继续加热15 min,自然冷却至室温,于4 ℃下储存.
1.3 SDM的测定
适配体溶液加热至95 ℃并保持3 min,自然冷却至室温.将500 μL AuNPs溶液与300 μL适配体溶液(终浓度为20.0 nmol/L)混合,于25 ℃下振荡反应5 min.加入100 μL不同浓度的SDM溶液,继续振荡反应5 min.加入100 μL 1.0 mol/L NaCl溶液,并用磷酸缓冲液稀释至1.5 mL,静置2 min后观察溶液颜色变化.用紫外可见分光光度计扫描波长为450~700 nm内的吸收光谱,并计算670 nm 和520 nm 处的吸光度比值(A670/A520).
1.4 样品处理
样品为健康人体空腹晨尿.取2.0 mL尿样于离心管中,4 000 r/min离心5 min,上清液经0.45 μm微孔滤膜过滤.取1.0 mL滤液于10 mL棕色容量瓶,用超纯水定容,在4 ℃下避光保存.
2 结果与讨论
2.1 比色传感法检测SDM的原理
柠檬酸根包覆的AuNPs由于静电排斥作用可稳定分散于溶液中,在520 nm左右出现最大吸收峰.加入NaCl后,溶液颜色由红色变为紫色至蓝色,这是因为盐诱导效应引起了AuNPs的聚集;此外,由于表面等离子共振效应的存在,AuNPs的吸收峰红移至670 nm左右.加入的适配体以范德华力、疏水作用及Au—N或Au—O键等形式吸附在AuNPs表面,通过静电排斥有效阻止AuNPs的盐诱导聚集,使溶液保持红色[9].加入SDM后,适配体与SDM特异性结合形成复杂的刚性结构,该结构能影响AuNPs和适配体碱基之间的作用力,使得适配体从AuNPs表面脱落[12].在高浓度NaCl条件下,失去适配体保护作用的AuNPs会再次聚集,溶液颜色由红色转为紫色至蓝色,且520 nm处的吸光度降低(见图1).因此,基于AuNPs的聚集程度及相应溶液的颜色变化,可实现SDM的可视化比色检测;根据AuNPs在670 nm 和520 nm处吸光度比值(A670/A520)的变化,可实现SDM的定量检测.
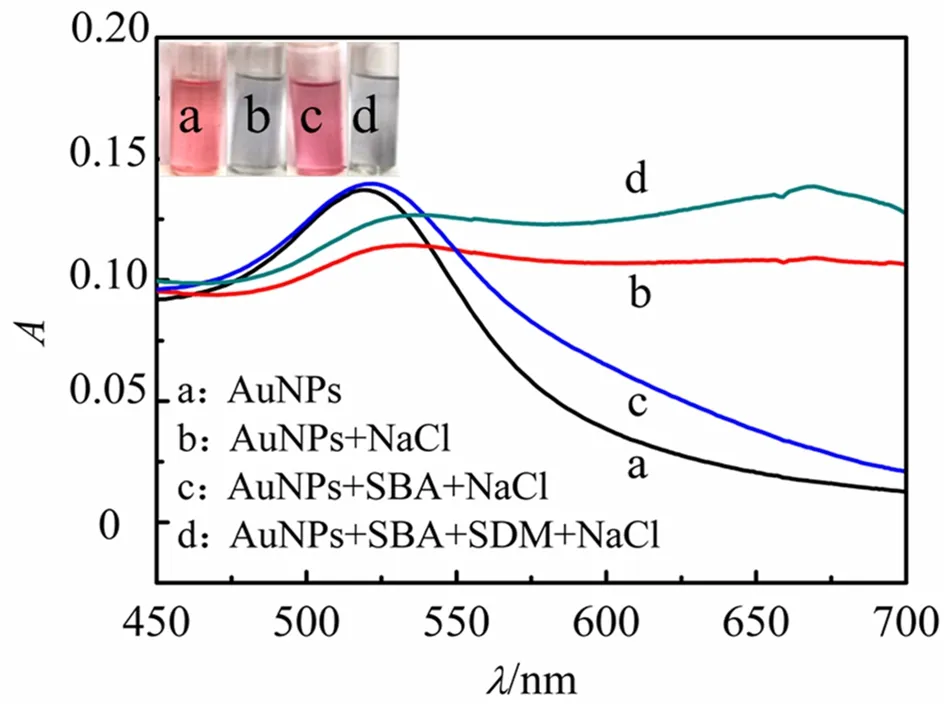
图1 AuNPs在不同溶液中的紫外可见吸收光谱
2.2 不同溶液中AuNPs的表征
利用透射电子显微镜对AuNPs在不同溶液中的形貌及聚集状态进行表征,结果如图2所示.图2A表明,分散良好的AuNPs呈光滑的球形,平均粒径约为15 nm.据文献[6]报道,粒径为15 nm的AuNPs溶液在波长为520 nm处的消光系数为2.7×108M-1·cm-1,根据朗伯—比尔定律可得出AuNPs溶液浓度为2.5 nmol/L.加入一定量的NaCl后,AuNPs发生聚集(见图2B).而加入适配体后,AuNPs能够抵抗盐诱导引起的聚集(见图2C).继续加入SDM,会使吸附的适配体从AuNPs表面脱落,导致AuNPs聚集(见图2D).

A:AuNPs;B:AuNPs+NaCl;
为了进一步研究溶液中AuNPs的聚集状态及其与适配体的作用情况,对不同条件下AuNPs的Zeta电位进行测定.实验结果表明,AuNPs溶液的Zeta电位为-18.9 mV.AuNPs与适配体混合5 min后,测得Zeta电位为-9.6 mV,表明适配体吸附在AuNPs表面.向上述溶液中再加入SDM,反应5 min后,Zeta电位值为-16.8 mV,表明部分适配体从金纳米粒子表面脱落.实验所得到的Zeta电位变化趋势与文献报道结果一致[13].
2.3 实验条件优化选择
2.3.1 NaCl浓度对AuNPs聚集的影响
考察了不同浓度的NaCl溶液对适配体-纳米金比色传感体系吸光度的影响(见图3).从图3A可以看出,未加入NaCl时,AuNPs溶液为红色且分散良好的溶液,在520 nm处有较大的吸光度;随着NaCl浓度的增加,体系颜色逐渐从红色变为浅紫色再变为蓝色,520 nm处的吸光度逐渐降低,670 nm处的吸光度逐渐增强.同时,AuNPs溶液在 670 nm 和520 nm 处的吸光度比值(A670/A520)逐渐增加(见图3B),这是由于盐浓度的大小可以改变AuNPs表面所带的负电荷,盐浓度越高,AuNPs表面的负电荷越少,则越容易发生聚集[12].当加入的NaCl浓度高于66.7 mmol/L时,AuNPs表面的负电荷几乎完全被中和,减小了AuNPs之间的静电斥力,引起反应体系中AuNPs的聚集.因此,为保证适配体-纳米金比色传感法中AuNPs完全聚集,NaCl的最优浓度为66.7 mmol/L.
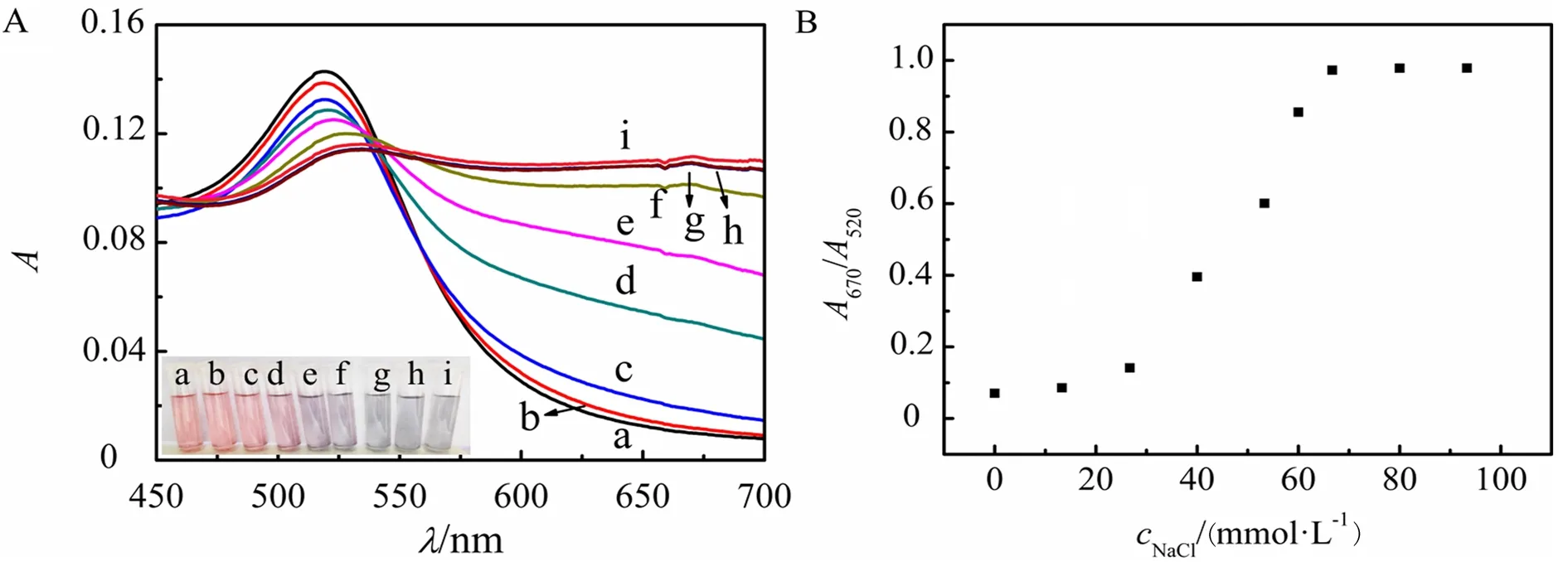
A:不同NaCl浓度下AuNPs溶液的紫外可见吸收光谱(从a至i浓度分别为:0,13.3,26.7,40.0,53.3,60.0,66.7,
2.3.2 适配体浓度对AuNPs聚集的影响
适配体浓度的大小会影响AuNPs的聚集程度,进而影响到SDM检测的灵敏度.因此,实验考察了不同浓度的适配体溶液(0.2~40.0 nmol/L)对AuNPs的聚集程度和吸光度的影响(见图4).如图4A所示,当适配体浓度为0.2 nmol/L时,AuNPs溶液呈蓝色,说明AuNPs主要呈现为聚集状态,且在520 nm处的吸光度较弱.随着适配体浓度的增加,AuNPs溶液的颜色逐渐从蓝色变为浅紫色再变为红色,且520 nm处的吸光度逐渐增强.此外,从图4B可以看出,适配体浓度为0.2~20.0 nmol/L时,AuNPs溶液在670 nm 和520 nm 处的吸光度比值(A670/A520)随适配体浓度的增加而逐渐降低,当适配体浓度高于20.0 nmol/L时,该比值基本不变,说明此时AuNPs可在溶液中保持良好的分散状态.因此,为防止盐诱导下AuNPs的聚集,适配体的最优浓度为20.0 nmol/L.
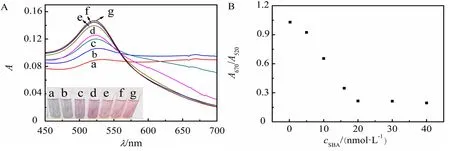
A:不同适配体浓度下AuNPs溶液的紫外可见吸收光谱(从a至g浓度分别为:0.2,5.0,10.0,16.0,20.0,
2.3.3 适配体与AuNPs反应时间对AuNPs聚集的影响
图5显示了AuNPs与适配体分别反应5,10,15,20,25,30 min后,AuNPs溶液在670 nm 和520 nm处的吸光度比值(A670/A520)变化情况.从图5可以看出,随着反应时间的延长,该吸光度比值(A670/A520)无明显改变,说明适配体与AuNPs之间的结合速度较快,适配体与纳米金的结合基本达到饱和.因此,为了缩短分析时间,后续实验中适配体和AuNPs的反应时间设为5 min.
2.4 对适配体-纳米金比色传感法的评估
在最优反应条件(NaCl 66.7 mmol/L,适配体20.0 nmol/L,适配体和AuNPs反应5 min)下,向适配体-AuNPs溶液中加入不同浓度的SDM,并记录其紫外可见吸收光谱的变化.从图6可以看出,随着SDM浓度的增加,溶液颜色由红色变为紫色至蓝色,且AuNPs在670 nm 和520 nm处的吸光度比值(A670/A520)逐渐增大,内插图为相应的溶液颜色变化.吸光度比值与SDM浓度在0.033~3.333 μmol/L时呈现良好的线性关系(见图6),线性方程为y=0.174 8x+0.254 9,相关系数为0.994 3,检测限为0.003 μmol/L,灵敏度较高,可满足实际样品中SDM的检测需求.
与文献报道的SDM分析方法相比较(见表1),本文所建立的方法分析时间缩短至15 min,优于文献中报道的分析方法.与已报道的高效液相色谱法[2,14]和毛细管电泳法[3]相比,比色传感法操作简单、成本低、灵敏度高;而在基于适配体的荧光传感法[10,15]中,适配体的共价标记过程比较繁琐、耗时(125 min),且修饰的荧光基团(和猝灭基团)会降低适配体的亲和力和选择性.因此,本文所建立的适配体比色传感法无需繁琐的修饰和标记步骤,具有操作简单、分析时间短、灵敏度高、裸眼可视等优点.
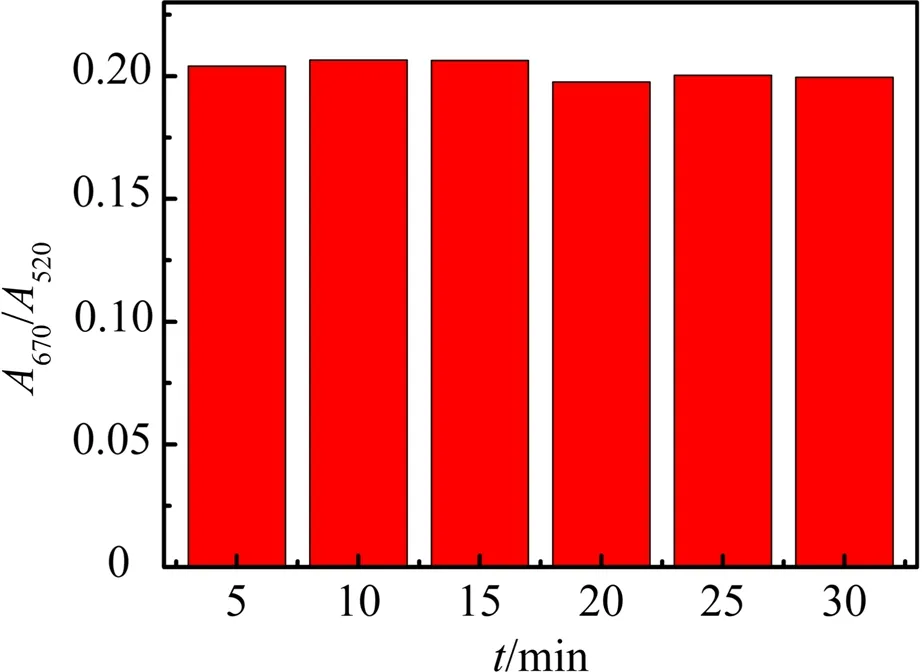
图5 适配体与AuNPs的反应时间对吸光度比值的影响
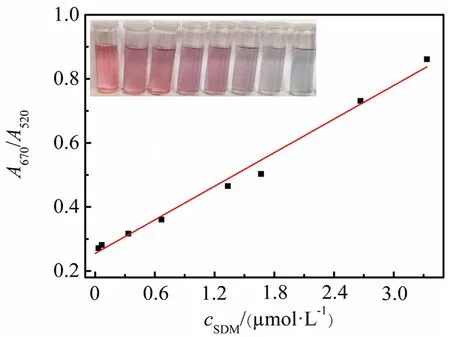
图6 SDM浓度与吸光度比值的线性关系曲线
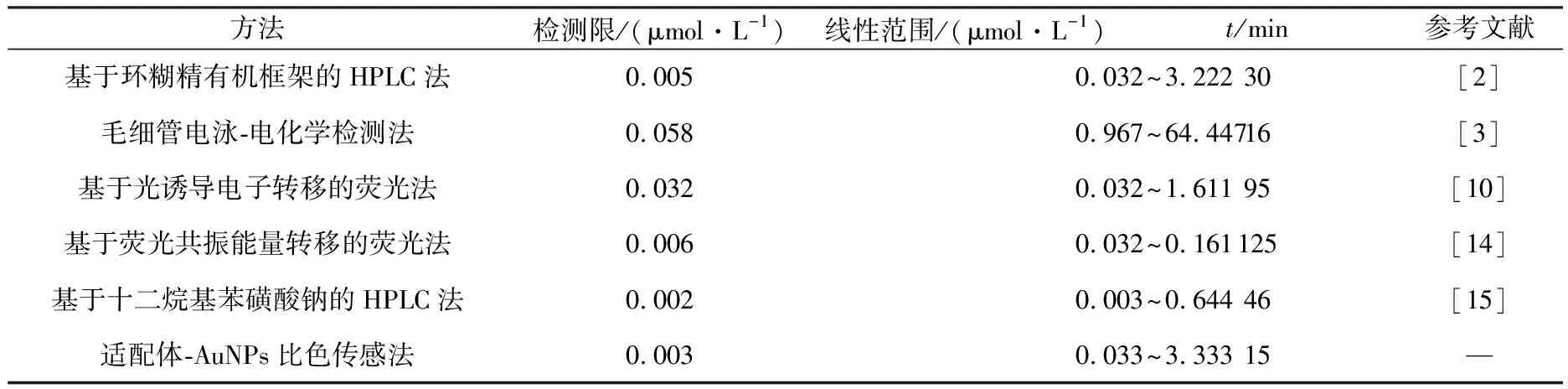
方法检测限/(μmol·L-1)线性范围/(μmol·L-1)t/min参考文献基于环糊精有机框架的HPLC法0.0050.032~3.22230[2]毛细管电泳-电化学检测法0.0580.967~64.44716[3]基于光诱导电子转移的荧光法0.0320.032~1.61195[10]基于荧光共振能量转移的荧光法0.0060.032~0.161125[14]基于十二烷基苯磺酸钠的HPLC法0.0020.003~0.64446[15]适配体-AuNPs比色传感法0.0030.033~3.33315—
2.5 适配体-纳米金比色传感法对SDM的选择性
在最优反应条件下,将其他抗生素(如OTC,CIP,LOM等)和金属离子(如K+,Ca2+,Mg2+,Fe3+等)分别加入到适配体-AuNPs溶液中,记录其吸光度变化并计算A670/A520值,以考察所建立的适配体比色传感方法对SDM的选择性.从图7可以看出,加入SDM后,AuNPs溶液在670 nm 和520 nm处的吸光度比值约为1.0,而加入抗生素或金属离子后,该比值均小于0.1.这说明在其他抗生素和金属离子存在的情况下,所建立的分析方法对SDM有较好的选择性.
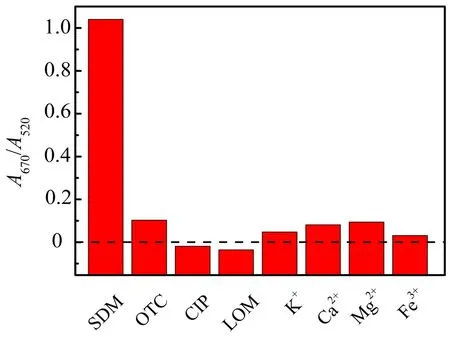
图7 适配体比色传感法对SDM的选择性
2.6 适配体-纳米金比色传感法对尿样中SDM的检测
为了评估所建立的适配体-AuNPs比色传感方法的准确性和适用性,以健康人体尿样为样品基质,在最优条件下,分别向适配体-纳米金体系中加入3个浓度水平的SDM,并记录其在670 nm 和520 nm处的吸光度比值变化情况.从表2可以看出,尿样中SDM的回收率为99.3%~105.1%,相对标准偏差(RSD)小于3.0%.结果表明,所建立的适配体比色传感法具有良好的准确度和精密度性,可用于尿样中SDM的快速检测.
3 总 结
基于盐诱导下AuNPs的聚集及适配体与目标物SDM之间高选择特异性结合的原理,建立了一种快速检测SDM的适配体比色传感法,并将其成功应用于尿样中SDM的分析检测.本文所建立的适配体比色传感法具有操作简单、成本低、耗时短、选择性好和灵敏度高等优点,可用于复杂样品中SDM的现场快速检测.此外,该方法还为其他适配体探针定量分析小分子提供了新的思路.
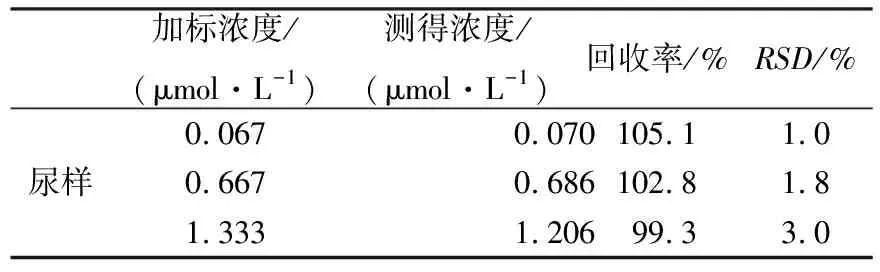
表2 尿样中SDM的分析结果(n=3)

