不同方法制备的纳米Zr-Ni-O催化剂乙烷氧化脱氢性能的比较
吴 瑛, 朱烨坤, 章 赟, 吴廷华
(浙江师范大学 物理化学研究所,浙江 金华 321004)
乙烯是一种重要的化工产品,目前工业生产中由乙烷高温裂解获得,但该过程的反应温度通常高于900 ℃,存在高能耗的缺点[1-2].相对而言,乙烷氧化脱氢(ODHE)是更理想的过程.以气相反应温度为界,ODHE催化剂通常分为高温和低温催化剂2类.由于乙烷分子是仅次于甲烷的稳定烷烃分子,其活化转化较难,需高活性的催化剂才可能在较低温度下使其反应.目前低温催化剂主要包括可还原性过渡金属氧化物[3-15],其中Mo基混合氧化物和Ni基催化剂最受关注[4-8].Mo基催化剂中MoVTeNbO复合氧化物因其乙烯选择性和收率均较高而备受关注[9-12],但其具有成分复杂、原料较贵等缺点,给深入研究带来一定的困难.相较而言,低廉的NiO成分简单,制备方法多样,且有一定低温乙烷氧化脱氢制乙烯的性能,是具有潜力的低温催化剂.与常规尺寸的NiO相比,纳米NiO具有更高的活性,在低于300 ℃的反应温度下即可获得乙烯[13-14],催化剂的活性相是高价氧化镍NiO1+δ,活性氧物种是亲电氧物种[15].
尽管纯的NiO具有较高的活性,但也容易将目标产物深度氧化成CO2,从而导致乙烯选择性较低.因此,为了提高纳米NiO的ODHE催化性能,需对其进行改性,目前研究较多的为主族元素和过渡金属的掺杂[16-18].ZrO2因具有丰富的物理化学性质,如还原、氧化和酸碱性等,使之应用于多种催化研究体系.在NiO中掺杂Zr能明显减少催化剂表面的活泼的亲电氧物种量,有效抑制乙烯的深度氧化,从而提高乙烯收率[19].由于不同制备方法对催化剂的物理化学性能有着直接的影响,继而影响反应性能,因此,可以通过对不同方法制备的纳米Zr-Ni-O催化剂进行比较研究,进一步深入了解ODHE的反应机制,以期对Ni基催化剂的改性提供指导作用.
本文采用改性溶胶-凝胶法及共沉淀法制备了纳米结构的双组分氧化物Zr-Ni-O催化剂((nZr/nNi)×100%=9.1%),通过多种表征方法研究物理化学性能,并比较其ODHE催化性能,探讨了影响催化剂反应性能的内在因素.
1 实验部分
1.1 催化剂制备
改性溶胶-凝胶法:将5.81 g的Ni(NO3)2·6H2O和0.78 g的Zr(NO3)4·5H2O分别溶解在100 mL去离子水中.将2种溶液同时滴加到100 mL柠檬酸溶液(2 mol/L)中,置于70 ℃水浴锅中,同时用机械搅拌器持续搅拌4 h.将得到的前驱体取出,放入烘箱110 ℃干燥12 h,研磨后在马弗炉中450 ℃煅烧4 h,所得样品标记为Zr-Ni-O-sg.通过相同的方法制得纯的NiO2和ZrO2用于比较.
共沉淀法:将5.82 g的Ni(NO3)2·6H2O和0.79 g的Zr(NO3)4·5H2O分别溶解在100 mL去离子水中,二者充分混合,将化学计量的KOH滴加到混合溶液中,同时在磁力搅拌器上80 ℃搅拌2 h后,过滤.得到的沉淀物用蒸馏水和乙醇冲洗数次,分别除去K+和残留的水.在烘箱中70 ℃干燥12 h,然后在马弗炉中450 ℃加热4 h,制得的样品标记为Zr-Ni-O-cp.
1.2 催化剂表征
催化剂的形貌尺寸和晶格分别通过扫描电镜(LEO-1530)和高分辨透射电镜(JEM-2010F)观测.样品的比表面积通过N2吸附(Tristar 3000)实验获得,通过BET方法得到样品表面积.相位鉴定和结构分析通过X射线粉末衍射(D/Max-rC)进行,由Scherrer公式(D=0.89λ/(βcosθ))计算平均晶体尺寸.程序升温还原(H2-TPR)实验在自制色谱上进行,使用5%H2/Ar混合气体作为还原剂.通过XPS(VG ESCA LAB)检测化学位移,以获得元素的表面状态.在O2-TPD-MS(Balzer Omni Star 200)分析时,升温速度为15 ℃/min.
1.3 催化活性测试
催化剂的ODHE反应性能在石英固定微反应床(D=5 mm)中测试,每次实验用0.1 g催化剂和0.2 g石英砂均匀混合使用以消除飞温现象.反应气总流速为30 000 h-1,nC2H6∶nO2∶nN2=1∶1∶8.反应物和产物通过配有热导检测器的气相色谱仪在线分析,其中Porapak Q色谱柱用于分离CH4,CO2,C2H4和C2H6,5A分子筛柱则用于分离O2,N2和CO.在无催化剂情况下,石英砂和纯ZrO2在550 ℃时均无反应活性,表明气相反应可以被忽略.
2 结果与讨论
2.1 催化剂的表征
2.1.1 SEM表征
图1显示了不同方法制备的Zr-Ni-O和NiO样品的形貌.可以看出,通过共沉淀法和改性溶胶-凝胶法制备的Zr-Ni-O催化剂均为纳米级别,粒径比纯纳米NiO小,可见Zr的掺杂抑制了颗粒的增长.其中Zr-Ni-O-cp是由球形小颗粒组成的具有片状结构的粒子,大小约为10~30 nm,比表面积为119 m2/g.而Zr-Ni-O-sg则呈现均匀的球形纳米颗粒,平均直径约为7~10 nm,比表面积为189 m2/g.

(a)NiO (b)Zr-Ni-O-cp (c)Zr-Ni-O-sg
图1 NiO和不同方法制备的Zr-Ni-O催化剂的SEM图像
2.1.2 XRD表征
图2为纯NiO、ZrO2和Zr-Ni-O样品的XRD谱图.从图中可以看出,Zr-Ni-O-sg样品在2θ=37,43,63°处存在3个衍射峰,对应于立方NiO最强的3个特征峰(JCPDS卡片号 03-065-5745),但在该样品上未观察到对应于ZrO2的衍射峰.Zr-Ni-O-cp样品除了具有典型的NiO衍射峰之外,在2θ=31°和50°附近还有2个归属于四方ZrO2相的宽衍射峰.这可能是因为Zr-Ni-O-cp样品体相中ZrO2物质的量之比远大于Zr-Ni-O-sg,或是因为在改性溶胶-凝胶法制备过程中掺杂的ZrO2能均匀分散到NiO中从而无法检测.此外,不同方法制备的Zr-Ni-O的衍射峰均比纳米NiO宽,且改性溶胶-凝胶法制备的Zr-Ni-O-sg催化剂宽化现象更为显著.如表1所示,由Scherrer公式计算得到Zr-Ni-O-sg粒径为7.1 nm,而Zr-Ni-O-cp的粒径为8.9 nm,均小于纯NiO和ZrO2样品,可见由于Zr的掺杂抑制了NiO晶粒的增长,而通过改性溶胶-凝胶法制备的催化剂,ZrO2分散性更好,具有更小的晶粒尺寸和比表面积,这与电镜观测到的结果一致.

表1 不同催化剂的物理化学性质

a:NiO;b:Zr-Ni-O-sg;c:Zr-Ni-O-cp;d:ZrO2
图2 NiO和不同方法制备的Zr-Ni-O催化剂的XRD谱图
2.1.3 TEM表征
为了进一步研究制备方法对Zr-Ni-O结构的影响,通过高分辨透射电镜对样品的晶格参数进行比较.从图3可以看出,纯NiO的a值为0.418 8 nm,掺杂了Zr以后,晶格参数有不同程度增加,其中Zr-Ni-O-cp为0.419 1 nm,而Zr-Ni-O-sg为0.423 7 nm.可见,在制备的过程中由于Zr的添加,有部分Zr4+取代了晶格中Ni2+,从而造成晶格的畸变.Zr-Ni-O-sg中有更多的Zr4+取代了晶格中的Ni2+,导致ZrO2和NiO之间的相互作用力更强,从而其晶格的膨胀比Zr-Ni-O-cp更为明显.

(a)NiO (b)Zr-Ni-O-cp (c)Zr-Ni-O-sg
图3 NiO及不同方法制备的Zr-Ni-O催化剂高分辨透射电镜照片
2.1.4 XPS表征
为了进一步研究ZrO2和NiO之间的相互作用,笔者利用XPS对不同催化剂的表面性质进行表征,结果如图4所示.Ni2p3/2XPS光谱显示,纳米NiO的主峰位于853.6 eV,随着ZrO2的掺杂结合能向高值方向移动,其中Zr-Ni-O-sg 更为明显,结合能增大了约0.4 eV.Zr3d的XPS峰变化趋势正好相反,相较纯的ZrO2,Zr-Ni-O-cp和Zr-Ni-O-sg的结合能分别降低0.2和0.3 eV.该结果表明,Zr的掺杂引起Ni周围电子环境的变化,由于Zr具有更强的吸电子能力,通过Zr-O-Ni桥氧键相互作用,电子由Ni2+向高价的Zr4+移动.因此,Ni外层电子密度降低,结合能相应地增大,Zr的电子结合能降低.XPS结果进一步证实了NiO和掺杂的ZrO2之间有较强的相互作用,尤其是Zr-Ni-O-sg催化剂,具有更高的Ni2+δ含量,因此,其电子结合能更接近于Ni2O3.
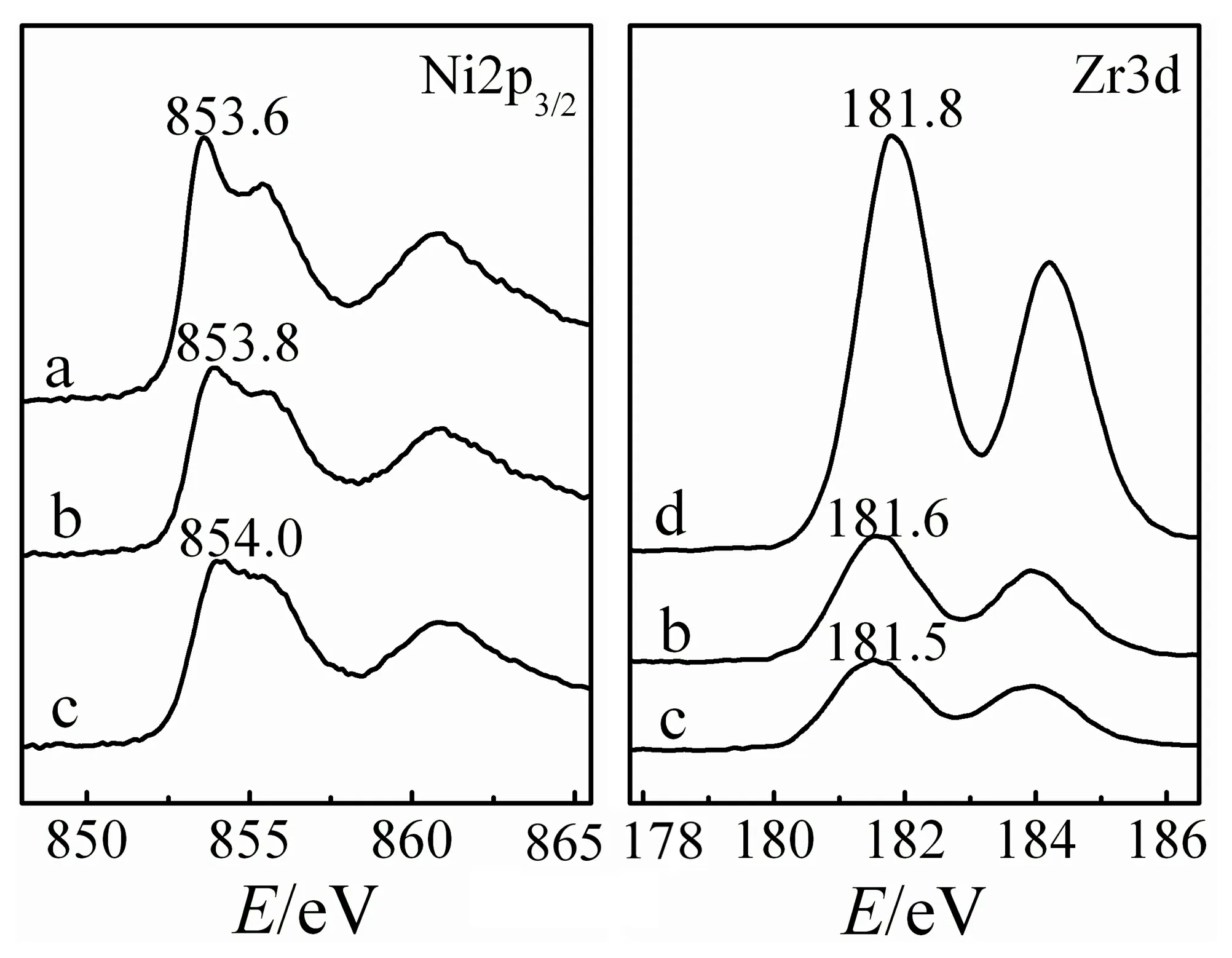
a:NiO;b:Zr-Ni-O-cp;c:Zr-Ni-O-sg;d:ZrO2
图4 NiO和不同方法制备的Zr-Ni-O催化剂的XPS谱图
此外,还通过XPS峰面积计算了催化剂表面原子组成.Zr-Ni-O-sg中(nZr/nNi)×100%=11.1%,与理论值接近;而Zr-Ni-O-cp中(nZr/nNi)×100%=21.4%,远大于理论值.这可能是因为Zr(OH)4比Ni(OH)2的溶度积Kα大,在沉淀的过程中Zr4+比Ni2+更容易沉淀,因此,生成的产物中Zr的含量远大于理论值,且制备过程中ZrO2不能均匀地分散于NiO中,因此,Zr-Ni-O-cp中无论体相还是表面的Zr含量,均明显高于Zr-Ni-O-sg.而通过改性的溶胶-凝胶法制备,由于柠檬酸的多齿结构能分别与Zr4+和Ni2+络合,并起到较好的隔离作用,因此,制得的Zr-Ni-O-sg样品的表面原子组成与理论值相接近,且ZrO2和NiO可以较好的相互分散.
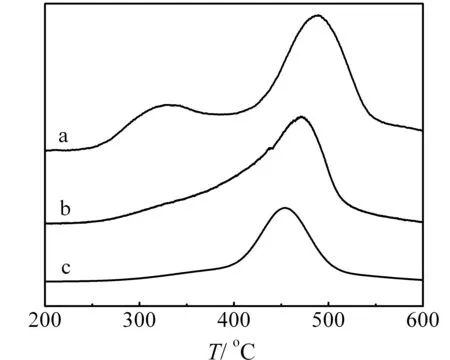
2.1.5 H2-TPR表征
图5为不同方法制备的Zr-Ni-O催化剂和纳米NiO的H2-TPR曲线.从图中可以看出,纳米NiO存在2个较窄的还原峰,其中低温还原峰应与表面高价态NiO1+δ的还原有关,高温还原峰则为体相NiO的还原.掺杂Zr之后,NiO的还原峰变宽,且还原温度明显升高.由于纳米ZrO2低于600 ℃没有明显还原峰,显然这种变化是由于NiO和ZrO2之间的相互作用造成的,可见Zr的掺杂抑制了催化剂的还原.Zr-Ni-O-sg由于ZrO2和NiO之间具有更强的相互作用,NiO更难以被还原,因此其还原温度增高更为明显.
a:NiO;b:Zr-Ni-O-cp;c:Zr-Ni-O-sg
图5 NiO和不同方法制备的Zr-Ni-O催化剂的H2-TPR谱图
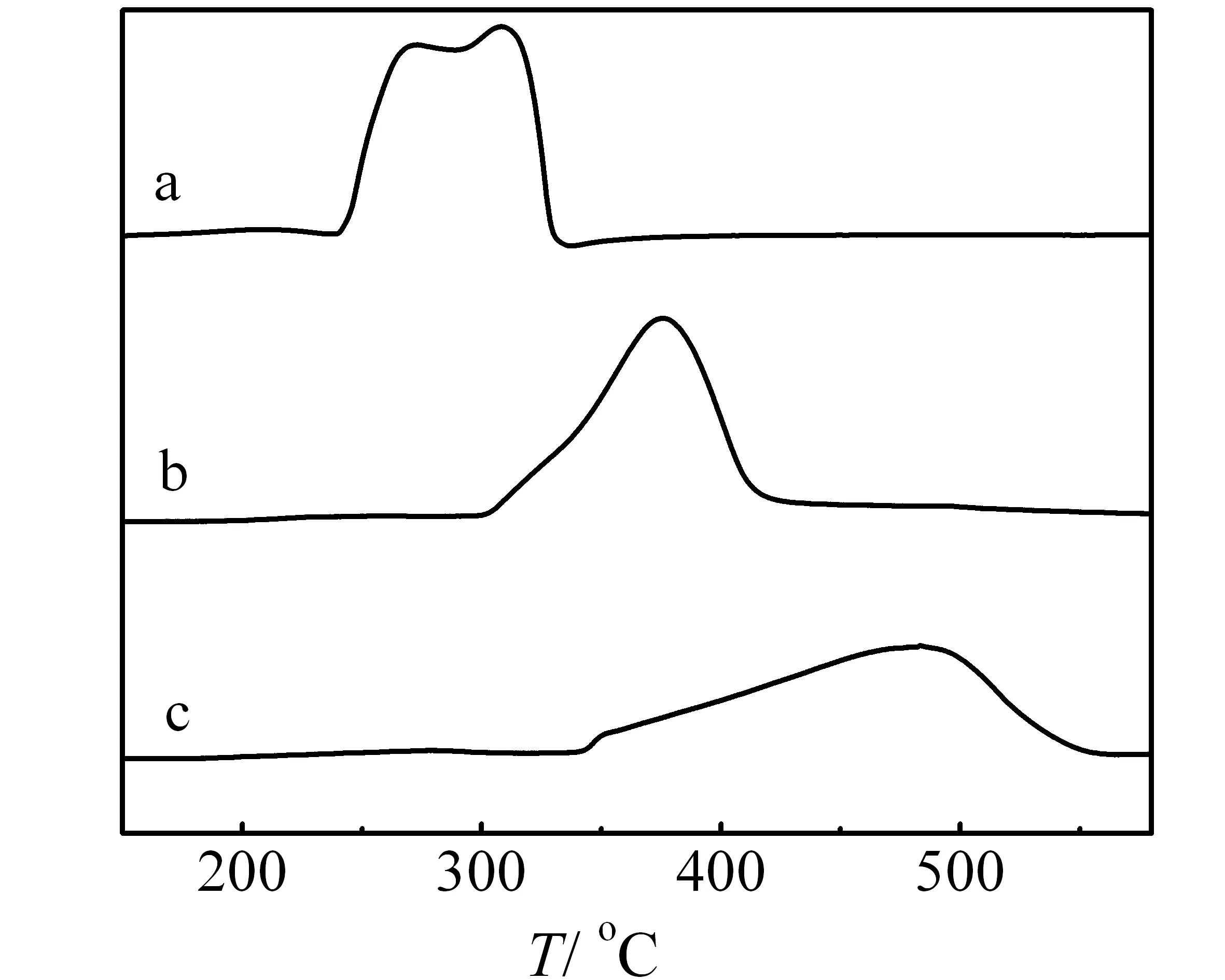
2.1.6 O2-TPD表征
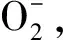
a:NiO;b:Zr-Ni-O-cp;c:Zr-Ni-O-sg
图6 NiO和不同方法制备的Zr-Ni-O催化剂的O2-TPD谱图
2.2 催化性能
纳米NiO和不同方法制备的Zr-Ni-O催化剂的乙烷氧化脱氢性能如图7所示.将这些催化剂用于ODHE反应,在较低温度时产物只有乙烯和CO2,且乙烷转化率均随反应温度的升高而增加.相比而言,纯NiO具有较高的反应活性,但其乙烯选择性较低,而ZrO2的掺杂有效地提高了乙烯的选择性,尤其是Zr-Ni-O-sg催化剂,选择性提高了约10%.在350 ℃下,纳米NiO催化剂的最大乙烯产率为24.6%,乙烯选择性为53.0%.但是当反应温度高于350 ℃时,它很快失活,乙烯选择性急剧下降到0,此时产物主要含有乙烷裂解产生的CH4和深度氧化产物COx.与NiO相比,Zr-Ni-O-cp和Zr-Ni-O-sg催化剂的失活温度提高至380 ℃和400 ℃以上.由此可见,ZrO2的掺杂有效提高了催化剂的抗乙烷裂解能力,尤其是纳米Zr-Ni-O-sg,在400 ℃时可获得最高C2H4收率为36.2%,乙烯选择性为63.7%.
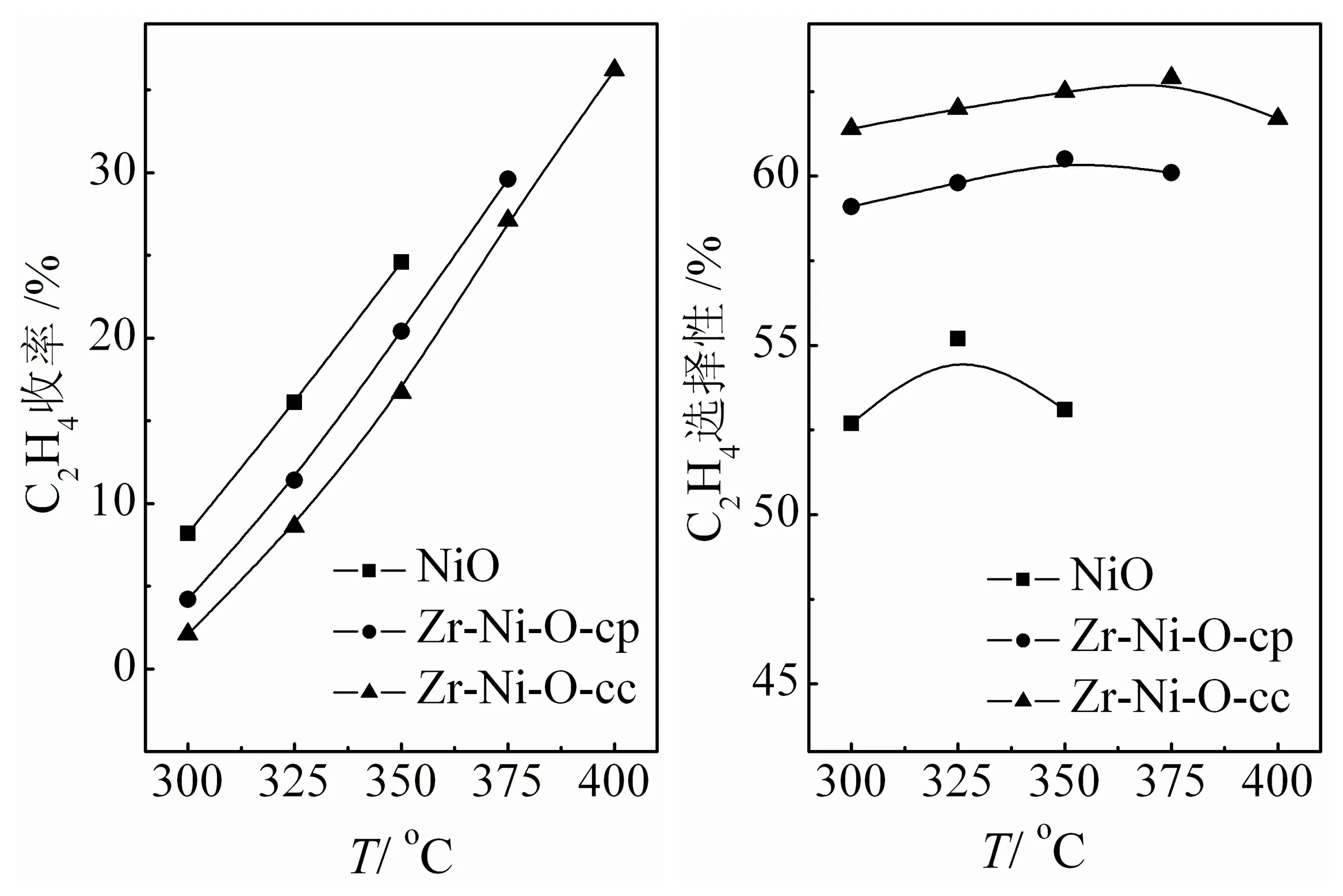
图7 NiO和不同方法制备的Zr-Ni-O催化剂的ODHE反应性能
3 结 论
改性溶胶-凝胶法和共沉淀法制备的Zr-Ni-O催化剂与纳米NiO相比,粒径减小,比表面增大,Zr的掺杂使催化剂不容易团聚,部分高价Zr4+可取代晶格中的Ni2+,还原性能降低,亲电氧物种吸附量减少.与Zr-Ni-O-cp相比,Zr-Ni-O-sg催化剂具有更窄的尺寸分布和更大的表面积,ZrO2和NiO之间存在较强的相互作用,有更多的Zr4+取代晶格中的Ni2+,选择性氧物种比例较高,晶格氧移动性增加,因此,表现出更高的乙烯选择性和更好的抗乙烷裂解能力.在400 ℃时,Zr-Ni-O-sg催化剂可获得最高的乙烯收率为36.2%.

