转基因莱茵衣藻中白藜芦醇的提取工艺
马伯宁,韦航涛,刘 佳,项 晨,杨明峰
(北京农学院 生物与资源环境学院/农业部华北都市农业重点实验室,北京 102206)
白藜芦醇(Resveratrol)是一种广泛存在于葡萄、虎杖等植物或果实当中的二苯乙烯类多酚化合物,难溶于水,易溶于乙醇等极性溶剂[1]。自1940年日本学者从毛叶黎芦根部分离得到白藜芦醇开始[2],发现它不但是一种植保素,而且有保护心血管、抗肿瘤、抗氧化等作用[3-4]。
目前生产白藜芦醇的主要途径是通过生物系统表达、化学合成或从天然植物材料中提取[5]。生物系统表达法和天然植物材料提取法产量相对较低,主要是受到生物量和提取工艺的限制。化学方法合成此类天然产物虽产量高,但是合成过程中会引入有害化学物质[5]。
天然植物材料中的白藜芦醇常用辅助溶剂提取法获得。张焕丽等采用超声波辅助溶剂提取法,从巨峰葡萄皮中提取白藜芦醇,但是溶剂提取和超声辅助条件因植物种类不同而异[6]。陶志杰等利用酶解辅助和乙醇提取花生芽茎白藜芦醇,分析了酶用量、酶解时间、酶解温度、酶解pH值等因素对提取效率的影响,发现酶解辅助提高了1.8倍白藜芦醇提取量,但酶解时间过久反而导致提取量下降[7]。
莱茵衣藻(Chlamydomonasreinhardtii)是一种单细胞藻类,具有培养条件简单、生长迅速、光合效率高等特点,常在植物代谢研究时作为模式材料使用[8-9]。本研究旨在探索一种从莱茵衣藻中提取白藜芦醇的有效方法。
1 材料与方法
1.1 试验材料
植物材料为能够积累白藜芦醇的转基因莱茵衣藻[10]。
1.2 试验方法
1.2.1 莱茵衣藻的培养 使用TAP培养基对莱茵衣藻进行培养。TAP培养基:25 mL/L TAP盐、2.42 g/L Tris、1 mL/L磷酸缓冲液(pH=5.0)、1 mL/L精氨酸、1 mL/L微量元素,加去离子水定容后,用冰醋酸将pH调至6.0左右。莱茵衣藻在温度为25 ℃、光照强度为30 μmol/m2·s、光周期 16 h/8 h(光/暗)的条件下在TAP培养基中培养,每7 d继代1次。
1.2.2 白藜芦醇的提取 衣藻藻液4 ℃下8 000r/min离心5 min,收集1 g藻体备用。在pH=6.0左右的条件下,进行5组试验。每组中加入相同量的纤维素酶,并分别进行3、6、9、12 h的酶解。酶解后用200 mL体积分数为60 %的甲醇作为提取剂在60 ℃条件下提取6 h。接着进行减压抽滤并在4 ℃、800 r/min条件下离心5 min。吸取适量上清到2 mL离心管中并稀释,用0.22 μm的滤膜过滤、超声除气泡后,使用高效液相色谱法分析白藜芦醇含量。第二组对照试验用以上试验方法测定体积分数为40%、50%、70%的甲醇对白藜芦醇提取量的影响。第三组试验在其他条件为预设值时,测定提取温度为40、50、70 ℃白藜芦醇提取量。第四组按照同样的方法测定提取时间3、9、12 h时的白藜芦醇提取浓度。最后按照以上分析得到的最佳方案进行两组试验:对照组不添加底物,试验组加入一定量的底物肉桂酸,以测定底物对莱茵衣藻中白藜芦醇提取率的影响。
1.2.3 高效液相色谱法测定白藜芦醇产量 使用Waters 1525高效液相色谱仪,并使用Angilent ZORBAX SB-C18 250 mm反相色谱柱进行检测,柱温设定25.0 ℃。高效液相色谱方法:流速0.8 mL/min,流动相为甲醇(A)和水(B)。使用浓度为10%~70%的甲醇梯度洗脱30 min,接着保持甲醇浓度70 %洗脱10 min。白藜芦醇检测波长为305.6 nm。 白藜芦醇标品配制成100 μg/mL的母液,然后稀释成5个浓度梯度:2.5、5、12.5、25、50 μg/mL,过滤分装后进行超声除气泡并各取10 μL依次进样,绘制标准曲线。根据孙同天的N+(N-1)规则进行试验设计[11]。共有4个因素,分别是:酶解时间、甲醇体积分数、提取温度和提取时间。每个因素分别进行了4个水平的检测。试验指标定为白藜芦醇提取浓度。通过查阅文献[12],暂定本试验最佳的提取方案为:取一定量的莱茵衣藻进行9 h酶解后超声萃取30 min,接着用60%的甲醇溶液在60 ℃条件下提取6 h(表1)。

表1 试验结果表Tab.1 Experimental results
注: ±表示暂定的最佳试验方案;DW 表示干重
Note:± indicates the provisional best protocol;DW indicates dry weight
2 结果与分析
2.1 白藜芦醇标准曲线的绘制
通过高效液相色谱法检测配制的白藜芦醇标品,其质量浓度为2.5~100 μg/mL,记录白藜芦醇质量浓度与检测峰面积的数据,并绘制标准曲线,得到相关性方程:y=666 50x-439 16,R2=0.999 5。公式中y为峰面积,x为白藜芦醇质量浓度(μg/mL),由此公式可以将液相色谱中的峰面积数据转化为白藜芦醇质量浓度。白藜芦醇的出峰时间约为12 min(图1)。

图1 白藜芦醇标品(100 μg/mL)高效液相色谱结果Fig.1 High performance liquid chromatography results of standard resveratrol samples (100 μg/mL)
2.2 酶解时间对莱茵衣藻中白藜芦醇提取率的影响
在其他提取条件一定的情况下,考察提取反应中酶解时间对白藜芦醇产量的影响,在第12 min时出现产物峰(图2-A,B,C,D)。
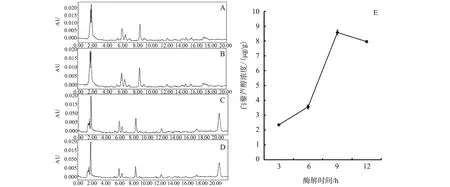
A.酶解时间3 h;B.酶解时间6 h;C.酶解时间9 h;D.酶解时间12 h;E不同酶解时间时的白藜芦醇提取浓度图2 酶解时间高效液相色谱结果A,time of enzymatic hydrolysis for 3 hours; B,time of enzymatic hydrolysis for 6 hours; C,time of enzymatic hydrolysis for 9 hours; D,time of enzymatic hydrolysis for 12 hours;E,concentrations of resveratrol at different enzymatic hydrolysis timeFig.2 High performance liquid chromatography results of various enzymatic hydrolysis time
在其他条件一定的情况下,酶解时间9 h时,提取的产物浓度最高,白藜芦醇浓度为8.57 μg/g DW (图2-E)。提取时间在3~9 h时,产物浓度随提取时间增加而增加,并且在9 h左右,产物浓度达到最大值,之后随时间增长而下降。由此可以看出在酶解时间为9 h左右时,莱茵衣藻细胞壁完全被酶解,细胞内的产物完全释放,白藜芦醇的提取量达到最大值。有研究表明,白藜芦醇在日光照射一定时间后,306 nm处吸光值下降[13]。本试验中莱茵衣藻的酶解反应在室内无日光直射的条件下进行。随着酶解时间的增长,莱茵衣藻细胞壁被酶解,白藜芦醇从细胞内释放出来所以检测到白藜芦醇提取量逐渐增加。但是9 h后细胞内白藜芦醇全部酶解到反应液中,在室内光照条件下白藜芦醇也会发生变化,所以导致306 nm处吸光度值下降,提取浓度降低。由以上分析最终选择9 h作为酶解时间的条件。
2.3 甲醇体积分数对莱茵衣藻中白藜芦醇提取率的影响
在其他提取条件一定的情况下,考察提取介质中甲醇体积分数对白藜芦醇产量的影响。经过高效液相色谱检测发现,甲醇体积分数60%时提取的产物浓度达到最大值,306 nm处峰面积最大,白藜芦醇浓度为8.57 μg/g (图3-A)。因此选择使用甲醇体积分数为60%作为该项因素的最佳浓度。

A.甲醇体积分数;B.提取温度;C.提取时间;D.是否添加底物,试验组别中1、3、5、7为对照组,不添加底物;2、4、6、8为试验组,添加10 μg/mL肉桂酸作为底物图3 不同条件下的白藜芦醇提取浓度A, methanol concentrations; B,extraction temperatures; C, extraction time; D, with and without substrate; the control group 1,3,5,and 7 without substrate; the experimental groups 2,4,6,and 8 with 10 μg/mL cinnamic acid as a substrateFig.3 Concentration of resveratrol with different extraction conditions
2.4 提取温度对莱茵衣藻中白藜芦醇提取率的影响
在其他提取条件一定的情况下,考察提取温度对白藜芦醇产量的影响。结果发现在60 ℃温度条件下,产物提取量最大,可达8.57 μg/g DW(图3-B)。随着提取温度的提升,产物浓度降低。由此可知虽然温度提升时,白藜芦醇溶解度增加,但是温度过高白藜芦醇会因为自身的热不稳定性导致提取浓度降低[13],所以提取温度60 ℃为宜。
2.5 提取时间对莱茵衣藻中白藜芦醇提取率的影响
在其他提取条件一定的情况下,考察提取时间对白藜芦醇产量的影响。经过HPLC检测后发现提取时间为9 h时,得到的白藜芦醇产量最高,最大值为8.95 μg/g DW (图3-C)。此后增加提取时间却发现白藜芦醇产量并没有太大变化。分析可能是由于提取时间为9 h时产物被完全提取出来,所以增加提取时间不会导致产物的量发生明显变化。
2.6 肉桂酸对莱茵衣藻中白藜芦醇产量的影响
对在其他条件一定的情况下进行两组试验,分别为对照组和加入底物试验组。由图中可以看出编号为2、4、6、8的添加底物试验组中白藜芦醇提取量高于其他的对照组,其提取浓度最大值为15.31 μg/g DW (图3-D)。
白藜芦醇在植物体内由苯丙烷代谢途径合成,其中肉桂酸是合成白藜芦醇的重要底物。莱茵衣藻能通过自身代谢反应得到的底物肉桂酸产量不多。当存在白藜芦醇合酶的条件下,白藜芦醇合酶要利用该底物,可能存在对底物的竞争从而导致底物不足的情况。因此为了增加白藜芦醇产量,加入一定量的底物肉桂酸是一种有效的方法。
3 讨 论
自从1940年首次从毛叶藜芦的根部分离得到了白藜芦醇开始,揭开了人们对这个植物次生代谢产物的探究。1963年Nonomura等认为某些草药中治疗炎症和心血管相关疾病的有效成分可能是白藜芦醇[14]。1976年又发现,白藜芦醇在植物受到机械损伤或紫外线照射时表达量会大量增加,因此被称为植保素[15]。
目前己经在21科、31属的72种植物中发现产生了白藜芦醇,而这些植物多为常见的药用植物[16]。由于白藜芦醇是植物次生代谢产物,目前主要是从葡萄籽、葡萄皮、中药虎杖中提取白藜芦醇,通过不同的方法从植物中提取白藜芦醇也成了当下生物合成白藜芦醇关注的热点。前人文献报道了溶剂提取法、酶法提取、微波萃取、超临界CO2萃取、超声波提取等方法提取白藜芦醇。生物合成法获得白藜芦醇的主要制约因素是生物量和提取方法。本试验使用的转基因莱茵衣藻能够代谢产生白藜芦醇,并且莱茵衣藻具有生长繁殖快、周期短、生物量大等优点,所以通过转基因衣藻可以大量并且快速产生白藜芦醇。
在提取方法上,本研究参考已报道的试验方法,考虑到试验可行性、简便程度、提取效率等因素,根据白藜芦醇提取产量优化提取方法 (表1)。编号为12的试验组得到的白藜芦醇浓度最高,其酶解时间、甲醇体积分数、提取温度三个因素与预期最佳水平结果一致,因此这三个因素的水平确定为预设值。提取时间的最佳水平为9 h并非之前预设的6 h,但提取时间为9 h时得到的白藜芦醇浓度为8.95 μg/g DW,与6 h提取得到的白藜芦醇浓度8.57 μg/g DW并没有明显的增加。本着节约试验时间的原则,选定6 h作为提取时间的条件。
综合试验结果,针对转基因莱茵衣藻探索出了一套完整的白藜芦醇提取方法:收集藻液进行9 h酶解处理后,超声萃取30 min,使用60%甲醇溶液作为提取剂,在60 ℃条件下提取6 h,从莱茵衣藻中提取出的产物白藜芦醇的量为8.57 μg/g DW。添加终浓度为10 μg/mL肉桂酸作为底物,则提取白藜芦醇的产量可达15.31 μg/g DW。总之,本研究优化得到了一种从藻类植物中提取白藜芦醇相对高效的方法,为研究转基因莱茵衣藻的白藜芦醇相关代谢提供了基础,也为转基因莱茵衣藻中提取白藜芦醇提供了一种有效的方法。

