草莓不同生育期根际微生物的动态变化
仝利红,高 洁,靳永胜 *
(1.北京农学院 a.植物科学技术学院;b.生物科学与工程学院,北京 102206;2. 农业农村部华北都市农业(北方)重点实验室,北京 102206)
根际是植物根系的表面与土壤亲密接触,并相互产生影响,围绕在根系表面几毫米的那部分区域。该区域微生物种群结构和数量的变化会直接影响植物的生长发育,以及对病虫害不良环境的抵抗能力[1]。根际微生物的多样性及其丰富度,是植物的第二大基因库,与植物健康联系密切。根际微生物是土壤肥力的指标之一。有不少研究表明根际微生物受植物类型及生长发育阶段影响显著,其微生物数量变化随植物生长发育阶段呈现一定的动态变化[2]。
草莓长期连作会使土壤养分失调、微生物区系失衡、土传病害增加。有研究表明,草莓土传病害的发生与植物根际微生物群体变化有密切关系[3,4]。研究和掌握不同生育时期草莓根际微生物群体的动态变化规律,有助于及时采取适当的农艺措施防止草莓土传病害的发生,促进草莓生长。目前还没有发现关于在草莓不同生育时期根际微生物动态变化方面的研究。本研究中采用 Illumina Miseq 高通量测序技术研究了草莓5个生育时期根际微生物区系的变化规律,为防治草莓土传病害,保证土壤生态环境的良性循环提供理论依据和实践指导。
1 材料与方法
1.1 样品的采集
土壤样品在2015年11月-2016年5月采自中国农业大学(北京市海淀区上庄镇)长期种植草莓‘红颜’定位试验的温室大棚内。分别在草莓的恢复生长期、现蕾期、开花和结果期以及盛果期(S1、S2、S3、S4和S5)在大棚内按“S”型挑选9株草莓连根拔起,抖掉根系周围土壤后装于灭菌袋内带回实验室。每3株视为1个重复,共3个重复。回到实验室后,将每个重复的根际土用毛刷轻轻分别刷入灭菌袋内,然后将3个重复土样混合,对角线取一半将其作为土壤待测样品用于分析。将收集的土样置于-20 ℃保存,用于高通量测序分析。CK则在草莓种植前在温室内多点采集土壤表层样品,进行混合后四分法取一半于-20 ℃保存,用于土壤微生物的测定。土壤pH采用电位法测定(水土体积比为5∶1);土壤有机质采用重络酸钾—外加热法测定;土壤全氮测定采用硫酸—高氯酸消煮—凯氏定氮仪法[5]。试验地土壤有机质含量26.54 g/kg,全氮含量1.43 g/kg,pH 为7.3。
1.2 土壤DNA提取
称取0.5 g的土壤使用FastDNA SPIN Kit For Soil(MP Biomedicals,LLC)试剂盒提取基因组DNA,并通过1%琼脂糖凝胶电泳检测,条带明亮、完整则可直接用于后续试验。
1.3 MiSeq及数据分析
PCR采用 TransGen AP221-02,PCR为20 μL的反应体系。5×FastPfu Buffer (4 μL); 2.5 mol/L dNTPs (2 μL); 5 mol/L Forward Primer (0.8 μL); 5 mol/L Reverse Primer (0.8 μL); Template DNA (10 ng); FastPfu Polymerase (0.4 μL),补ddH2O至 20 μL。
1.3.1 细菌16S rDNA PCR扩增反应 用于测序细菌的16S rDNA PCR扩增引物Prime338F:5′-ACTCCTACGGGAGGCAGCAG-3′,Prime806R:5′-GGACTACHVGGGTWTCTAAT-3′。PCR反应程序:95 ℃ 3 min,27次循环(变性95 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 45 s),最后72 ℃ 10 min,10 ℃保存。
1.3.2 真菌18 SrDNA PCR扩增反应 用于测序真菌18S rDNA PCR扩增引物Prime0817F 5′-TTAGCATGGAATAATRRAATAGGA-3′,Prime 1196R 5′-TCTGGACCTGGTGAGTTTCC-3′。PCR 反应程序:95 ℃ 3 min,35次循环(变性95 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 45 s),最后72 ℃ 10 min,10 ℃保存。
1.3.3 序列分析 利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。原始测序序列使用Trimmomatic 软件质控后,使用Usearch (http://drive5.com/uparse/)软件将97%的相似水平下的OTU进行生物信息统计分析。按照97%相似性对非重复序列进行OTU聚类,在聚类过程中去除嵌合体,得到OTU的代表序列。利用RDP classifier (http://rdp.cme.msu.edu/) 对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%,然后利用mothur (http://www.mothur.org/wiki/Schloss_SOP#Alpha_diversity)软件对Ace、Chao1和Shannon指数进行分析。采用R语言vegan包,vegdist和hclust进行距离计算和聚类分析,然后利用R语言进行绘图。
2 结果与分析
2.1 生物学信息分析
对6个土壤样本的细菌进行测序后共获得23.7203万条序列,平均每个样本获得3.953 4万条序列;真菌测序后共获得23.84万条序列,平均每个样本获得3.973 3万条序列。使用mothur version v.1.30.1 软件进行指数分析,用于指数评估的OTU相似水平97%。
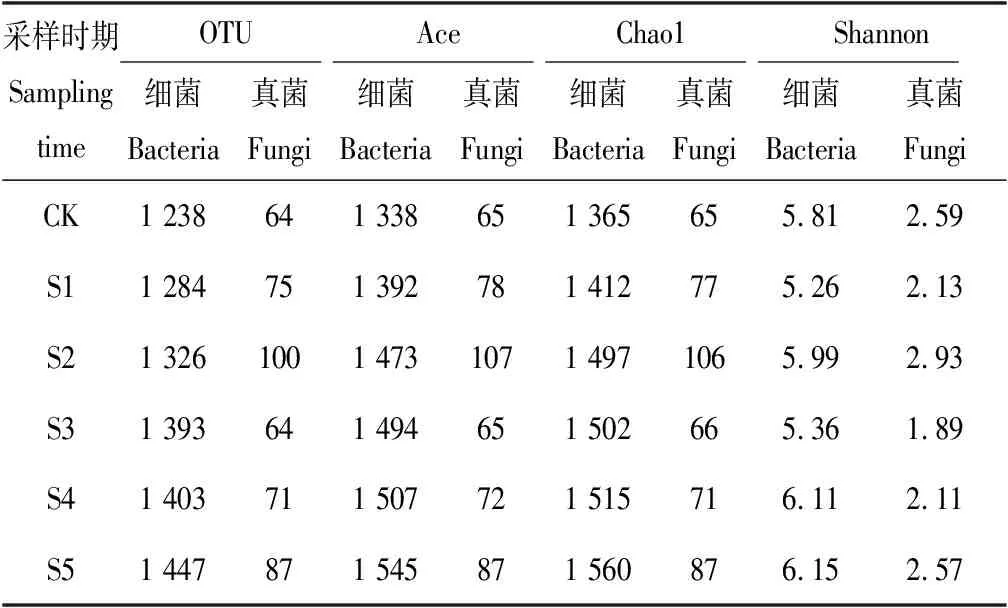
表1 细菌和真菌多样性指数统计表Tab.1 Bacteria and fungi diversity index statistics
由表1可知,细菌Chao1丰富度指数表明土壤中细菌的物种数量随草莓生长发育的变化而逐渐增多。与对照相比,土壤细菌Shannon指数表明在S1和S3时期下降,在S2、S4和S5时期时上升。细菌Ace指数表明,细菌群落均匀度随草莓的生长发育逐渐上升。真菌丰富度指数Chao1表明各生育期土壤真菌群落的物种数量与对照样本相比都有不同程度的增加,尤其在S2时期达到了整个生育期的最大值。真菌Shannon指数表明,只有S2时的真菌群落多样性升高,其他生育期的真菌群落多样性都有不同程度的下降。草莓大部分时期的真菌Ace指数均有不同程度增加,特别是在S2时Ace指数达到了整个生育期的最大值,这表明在S2时土壤真菌群落中某些真菌种群发育较好,在群落中的优势度上升。
2.2 草莓不同生育期根际土壤细菌相对丰度的变化
将草莓 6个土壤样品质控后序列按97 %相似性进行聚类,共得到 8 091个 OTUs。统计结果分析表明,6个土壤样品中一共检测到35个土壤细菌门、82个纲、158个目、283个科、450个属、818个种。在门水平上,土壤细菌共分为14个类群,整个生育期中细菌相对丰度较高的有Proteobacteria、Acidobacteria、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)。随着草莓的生长发育,土壤细菌主要菌群的相对丰度也发生了明显变化。与对照相比,Proteobacteria的相对丰度随着草莓的生长发育而逐渐升高,Acidobacteria的相对丰度随草莓生育期的变化出现不同程度的下降。
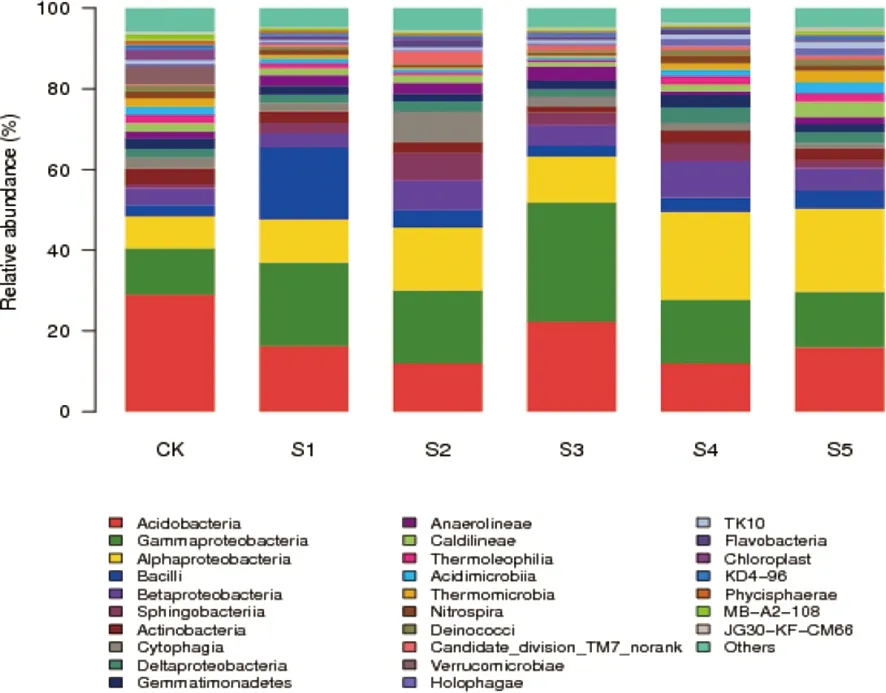
图1 细菌纲水平柱状图Fig.1 Bacteria level histogram
如图1所示,6个样品中共检测到82个纲。相对丰度较高的有酸杆菌纲(Acidobacteria)、γ-变形菌纲(Gammaproteobacteria)、α-变形菌纲(Alphaproteobacteria)、芽孢杆菌纲(Bacilli)、β-变形菌纲(Betaproteobacteria)。与对照相比,Acidobacteria的相对丰度随生育期的变化出现不同程度的下降。但是Gammaproteobacteria的相对丰度随生育期的变化出现不同程度的增加,在S3时期相对丰度达到最高为29.5%。Alphaproteobacteria的相对丰度同样随生育期的变化出现不同程度的增加,在S4时期相对丰度达到最高为21.8%。Bacilli的相对丰度只有在S1时期显著增加,相对丰度达到17.7%,在其他生育时期变化不明显。Betaproteobacteria的相对丰度只有在S4时期显著增加,相对丰度达到9.1%,在其他生育时期变化不明显。
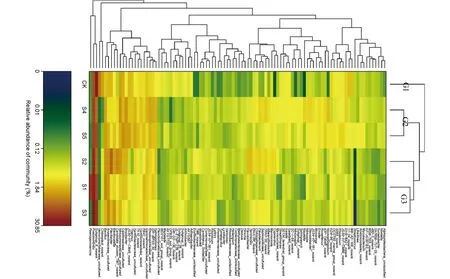
图2 细菌热图Fig.2 Bacteria relative abundanceheatmap
由图2可知,依据6个样品细菌分布丰度特征,从属的水平上进行聚类,分成3类:CK聚成一类(Gl);S4和S5聚成一类(G2);S1、S2、S3聚成一类(G3)。从这一结果可以看出各生育时期草莓根际细菌的丰度与非种植草莓的对照土壤有显著的差异。图2表明,草莓在整个生育期的细菌具有相似性。在G1土样中Subgroup_6_norank的相对丰度最高,为26.1%。G2的两个土样中,Pseudomonas的相对丰度最高,分别为12.7%和12.1%。另外Bryobacter和Rhodospirillaceae_uncultured多种菌属在G2的相对丰度也较高,并且这几种菌属的相对丰度比其他两组的丰度高。在G3的3个土样中Pseudomonas的相对丰度最高,相对丰度分别为18.1%,21.5%和30.9%,而且比其他两组的相对丰度都要高。在G3的3个土样中相对丰度较高的还有Bacillus和Flexibacter等,且其相对丰度比其他两组的丰度高。在G2和G3中,Pseudomonas的相对丰度均是最高,并且G3中的Pseudomonas相对丰度达到了整个草莓生育期的最高。除Pseudomonas外,在G2和G3中分别有多种菌属的相对丰度比其他两组要高,属于其独特的优势菌属。Pseudomonas在草莓整个生育期内都属于优势菌,其丰度随草莓生育期的变化而变化。因此可知,该菌属在草莓生长发育的不同时期都可能起到重要作用。
2.3 草莓不同生育期根际土壤真菌相对丰度的变化
将草莓不同时期的 6 个土壤样品质控后序列按97%相似性进行聚类,共得到 23.84万个 OTUs。6个样品共检测到33个土壤真菌门(Phylum)、49个纲(Class)、72个目(Order)、83 个科(Familiy)、95 个属(Genus)、98个种(Species)。6个样品共检测到4个已知真菌门,Ascomycota、担子菌门(Basidiomycota)、纤毛亚门(Ciliophora)和Choanomonada。6个样品中,Ascomycota的相对丰度最高,其次分别是Basidiomycota和Ciliophora。Ascomycota的相对丰度随草莓生育期的变化呈现波动性变化,尤其在S2时期时相对丰度显著下降。Basidiomycota和Ciliophora的相对丰度随草莓生育期的变化出现不规则变化,Basidiomycota的相对丰度在S4时期最高;Ciliophora的相对丰度在S2时期最高。
6个样品中共检测到51种真菌纲。由图3可知:相对丰度较高的有粪壳菌纲 (Sordariomycetes)、Ascomycota_unclassified、散囊菌纲(Eurotiomycetes)、盘菌纲(Pezizomycetes)、伞菌纲(Agaricomycetes)。与对照土样的相对丰度相比,Sordariomycetes的相对丰度随草莓生育期的变化出现无规律变化,其相对丰度在S3时期达到最大值为67.3%,在S2时期处于最低值,为35.3%。Ascomycota_unclassified的相对丰度随生育期的变化逐渐下降。Eurotiomycetes只有在S5时期相对丰度显著增加(19.6%),而在其他生育时期无明显变化。Pezizomycetes在S4时期时相对丰度处于最大值(10.3%),在S3时期处于最低值(1.6%)。Agaricomycetes在S2和S4时期时相对丰度增加,并且在S4时期时显著增加达到最大值17.5%。

图3 真菌纲水平柱状图Fig.3 Fungi level histogram
将6个样品依据真菌分布丰度特征,从属的水平上进行聚类,通过图4可以看出,6个样品明显地分成3类:CK聚成一类(Gl);S4、S1和S3聚成一类(G2);S2和S5聚成一类(G3)。CK聚为一类,而草莓整个生育期聚在一起,表明草莓在整个生育期的真菌具有相似性。在G1中Ascomycota_unclassified和Microascaceae_unclassified相对丰度较高而且比其他两个组中的相对丰度还要高。相对丰度最高的区域分布在G2;Chaetomium在G2的3个土样中相对丰度最高,而且比其他两组的丰度都要高;Chaetomium在G2中的相对丰度达到了草莓整个生育期的最大值,其相对丰度分别为42.4%,45.7%,56.1%。在G3的2个土样中Chaetomium的相对丰度最高,但丰度低于G2,相对丰度分别为21.1%和26.8%。Chaetomium在草莓整个生育期内都是优势菌属,其丰度随草莓生育期的变化而变化。因此可知,毛壳属(Chaetomium)对草莓的生长发育有其重要作用。
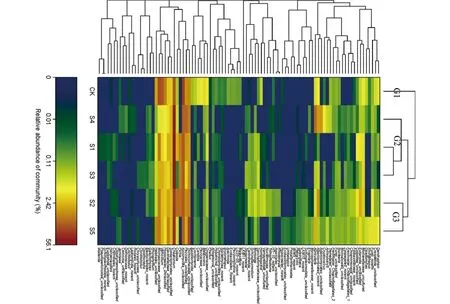
图4 真菌热图Fig.4 Fungi relative abundance heatmap
3 讨论和结论
植物不同生长发育期根系分泌物不同,从而对根际微生物群落结构产生影响,并且随生育期的变化也呈现一定的动态变化。孙晓棠等采用PCR-DGGE技术对不同生育期番茄根际细菌多样性进行研究,结果表明根际细菌种类和数量在初花期发生较为显著的变化,初果期根际群落多样性指数(H)和物种丰度(S)值都达到最高,微生物最丰富[6]。本研究结果发现土壤细菌和真菌的群落丰富度和多样性、主要种群的相对丰度随草莓的生长发育均发生了变化。细菌丰富度随生育期的变化而逐渐上升;细菌群落多样性在恢复生长期和开花期时期时下降,现蕾期、结果期和盛果期上升。真菌丰富度和多样性都在S2时期时显著升高。这可能是由于在草莓不同生育期根系分泌物的含量和组成不同,使根际微生物的结构和数量发生了改变。草莓生长前期细菌群落多样性的下降和真菌群体的增加,会导致草莓土传病害的发生。根据这个现象,在草莓生长前期采取措施促进根际细菌的数量和群体,有利于防止草莓土传病害的发生。
草莓根际土壤中细菌的相对丰度较高的有Proteobacteria和Acidobacteria。变形菌门的相对丰度随着草莓的生长发育而逐渐升高,酸杆菌门的相对丰度随草莓生育期的变化出现不同程度的下降。真菌相对丰度最高的是Ascomycota。Ascomycota的相对丰度随草莓生育期的变化呈现波动性变化,尤其在S2时期时相对丰度显著下降。根据土壤细菌热图分析,土壤细菌在草莓整个生育期都聚在一起,表明在整个生育期内草莓根际的细菌具有相似性。而且Pseudomonas在草莓整个生育期内都属于优势菌。由此推断,该菌属在草莓生长发育的不同时期都起到重要作用。Pseudomonas在农业生态系统中发挥着重要作用[7]。它在抑制多种作物疾病[8],促进植物生长发育[9],降解多种用于植物保护的杀虫剂[10]等方面均有作用。但是一些假单胞菌也表现出对植物的致病性[11],使农作物减产。土壤真菌热图显示草莓在整个生育期的真菌具有相似性,并且Chaetomium在草莓整个生育期内都是优势菌属。毛壳菌(Chaetomiumspp.)已经被广泛用于防治由Rhizoctoniasolani和Fusariumoxysporium等引起的松苗猝倒病、Venturiainaequalis引起的苹果黑星病、Valsamali引起的苹果树腐烂病[12]。因此,Chaetomium对草莓的生长发育有其重要作用。

