CCDC69在乳腺癌中的表达及其临床意义
刘显胜,王振国,高温杰,于晓双,任贵兵
乳腺癌是全球范围内女性发病率和死亡率均排首位的恶性肿瘤[1]。据统计,仅2018年新发病例为208.9万例,死亡62.7万例[2]。近年来,随着新一代测序技术和突变基因检测技术在乳腺癌中的应用与发展[3],不断有新的癌基因和抑癌基因被发现[4, 5],为乳腺癌精准治疗提供了新的方向。然而部分患者因确诊时间晚、病理分型差、对治疗不敏感等原因,预后仍不甚理想[6],因此亟待进一步深入研究乳腺癌的发病机制及特异性标记物。卷曲螺旋结构域蛋白(coiled-coil domain-containing protein,CCDC)是一种由两个或两个以上的卷曲螺旋结构域组成的同寡聚体或寡聚体序列蛋白,可通过基因转录、调控细胞周期、介导细胞凋亡、影响细胞侵袭能力等多种途径参与癌症的发生发展过程[7]。近年来研究发现,CCDC蛋白在肺癌、甲状腺癌、胃癌、结肠癌等多种恶性肿瘤中发挥抑癌作用[8-11]。卷曲螺旋结构域蛋白69(coiled-coil domain-containing protein 69,CCDC69)是近年来新发现的CCDC家族成员,定位于5号染色体长臂5q33.1,由296个氨基酸构成。研究发现,CCDC69能够通过维持纺锤体的正常形态和功能,进而影响细胞分裂的准确性[12]。CCDC69可通过促进细胞周期依赖性激酶抑制蛋白(alternative reading frame,p14ARF)的表达和抑制p53蛋白的降解,增强卵巢癌细胞对化疗的敏感性,并诱导细胞凋亡[13]。目前,关于CCDC69与乳腺癌的相关性研究尚不深入。本研究利用癌症基因组图集(the cancer genome atlas, TCGA) 数据库,探讨CCDC69在乳腺癌组织中的表达情况及潜在作用,为寻找乳腺癌的新的分子诊断途径和靶向治疗方案提供证据。
1 资料与方法
1.1 资料数据来源及预处理 从TCGA数据库(https://www.cancer.gov/)下载了1108例女性乳腺癌组织样本和112例癌旁组织样本的mRNA表达谱及相关临床数据。利用R语言分析包edgeR(http://www.bioconductor.org/packages/release/bioc/html/edgeR.html)对原始mRNA表达数据进行基于加权截尾均值化M值(trimmed mean of M-values,TMM)标准化[14, 15],并进行log2转换用于后续分析。
1.2 数据筛选及分组 筛选出同一患者的癌组织及癌旁组织基因表达信息的病例111例,用于癌组织及癌旁组织的差异表达分析。筛选出具有完整临床信息(年龄、TNM分期、肿瘤体积、淋巴结转移、远处转移、雌激素受体、孕激素受体、人类表皮生长因子受体2、生存信息)的病例818例,用于临床相关分析。根据CCDC69的表达量进行排序,选取中位值将818例患者分为高表达组和低表达组,用于预后相关分析。
1.3 基因集富集分析 使用基因富集分析(Gene Set Enrichment Analysis,GSEA)软件,选择“h.all.v6.2.symbols.gmt” 为参照基因集,根据1108例乳腺癌组织CCDC69的表达量建立连续表型,按默认加权富集统计(default weighted enrichment statistic)的方法,设置置换次数为1000次, 计算CCDC69与参照基因集的皮尔森相关系数,并按照相关系数大小进行基因排序,计算富集系数,设置标准化P<0.05, 错误发现率(false discovery rates, FDR)<0.25为显著性富集标准。
1.4 统计学处理 使用 SPSS 25. 0 进行统计分析。癌组织与癌旁组织的差异分析用配对t检验。临床病理参数相关性分析采用独立样本t检验。生存分析采用 Kaplan-Meier 法和Log-rank 检验。单因素和多因素分析采用Cox比例风险回归模型分析,并计算风险比(HR)及其95%可信区间(Cl),P<0.05为差异有统计学意义。
2 结 果
2.1 CCDC69在癌组织与癌旁组织中的差异表达 CCDC69在同一患者的癌组织中的表达水平(9.922±1.126)低于癌旁组织(12.571±1.388),差异具有统计学意义(P<0.001)。提示在乳腺癌的发生发展过程中,CCDC69的表达可能受到抑制(图1)。

图1 CCDC69在乳腺癌组织和癌旁组织的表达量比较
2.2 CCDC69表达水平与乳腺癌患者临床病理指标的相关性 CCDC69的表达水平与患者的年龄(P=0.020)、肿瘤体积(P=0.027)密切相关,而与TNM分期、淋巴结转移情况、远端转移情况、雌激素受体(ER)表达情况、孕激素受体(PR)表达情况和人类表皮生长因子受体2(Her-2)表达情况等指标无明显相关性(P>0.05,表1)。

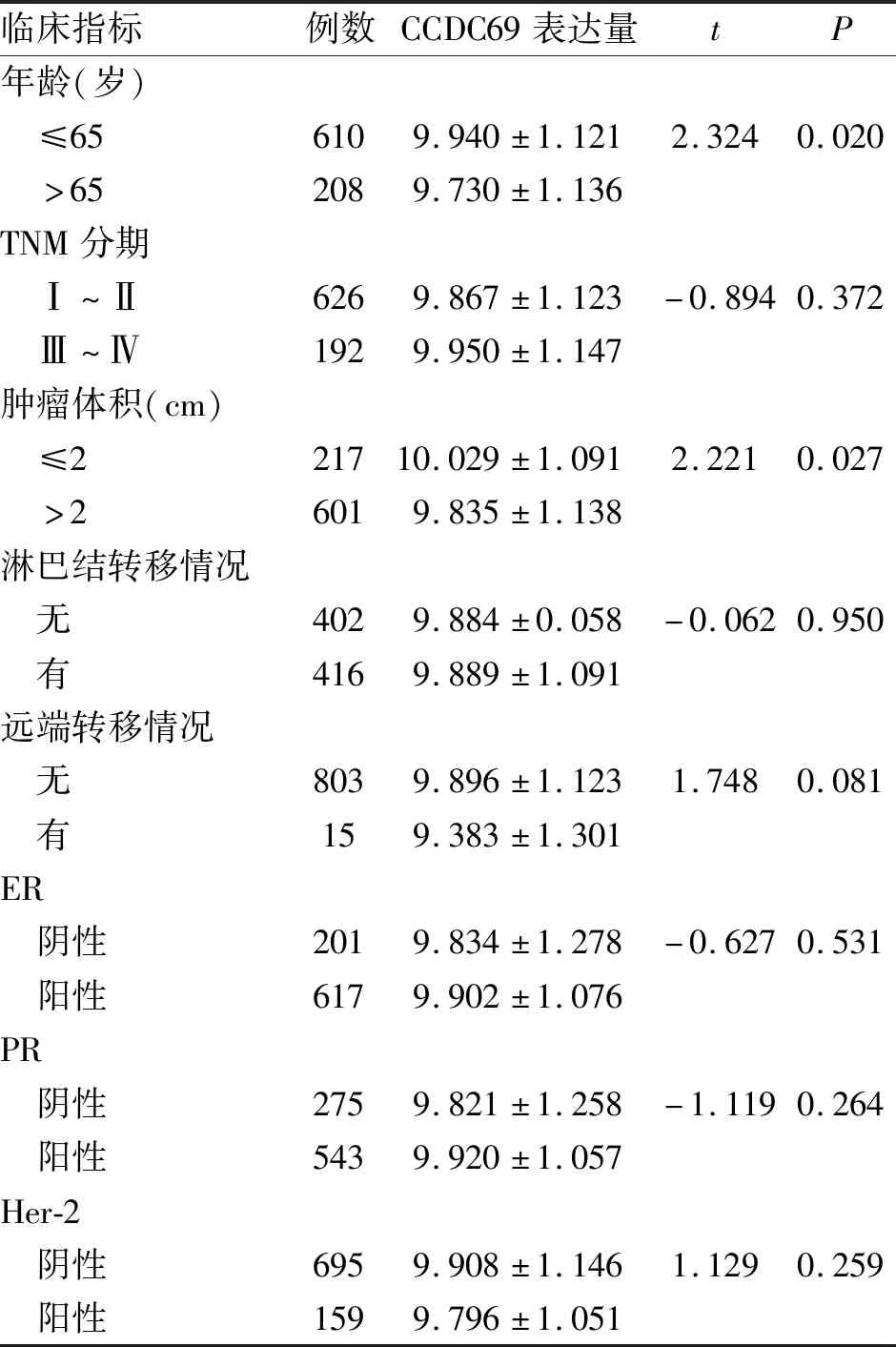
临床指标例数CCDC69表达量tP年龄(岁) ≤656109.940±1.1212.3240.020 >652089.730±1.136TNM分期 Ⅰ~Ⅱ6269.867±1.123-0.8940.372 Ⅲ~Ⅳ1929.950±1.147肿瘤体积(cm) ≤221710.029±1.0912.2210.027 >26019.835±1.138淋巴结转移情况 无4029.884±0.058-0.0620.950 有4169.889±1.091远端转移情况 无8039.896±1.1231.7480.081 有159.383±1.301ER 阴性2019.834±1.278-0.6270.531 阳性6179.902±1.076PR 阴性2759.821±1.258-1.1190.264 阳性5439.920±1.057Her-2 阴性6959.908±1.1461.1290.259 阳性1599.796±1.051
2.3 CCDC69表达水平与乳腺癌患者预后的相关性 CCDC69的表达水平与乳腺癌患者总体生存期相关(P=0.004),高表达组患者总体生存期明显长于低表达组患者,提示CCDC69低表达可能是一种不良预后因素(图2)。在单因素分析中,CCDC69的表达量、患者年龄、TNM分期、肿瘤体积、淋巴结转移、远端转移能影响患者预后(P<0.05)。多因素分析提示CCDC69的表达量、患者年龄、TNM分期、远端转移是影响患者预后的独立危险因素(P<0.05,表2)。

图2 CCDC69表达水平与乳腺癌患者预后的相关性

表2 影响乳腺癌患者预后的单因素和多因素分析
2.4 CCDC69功能富集分析 GSEA提示, 在乳腺癌样本中,CCDC69富集到MYC信号通路、E2F信号通路、未折叠蛋白反应、糖酵解基因集,且与上述基因集呈负相关,说明CCDC69可能通过调节以上4条通路发挥抑制乳腺癌作用(表3)。
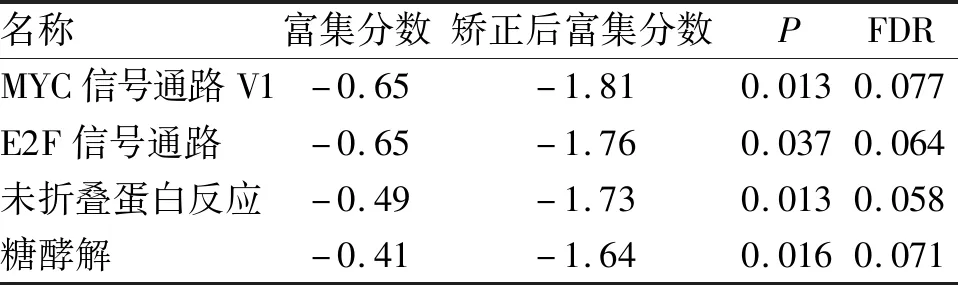
表3 CCDC69负相关的乳腺癌样本富集的基因集
3 讨 论
乳腺癌是女性最常见的恶性肿瘤,需要根据TNM分期和ER、PR、Her-2的表达情况及其他基因检测结果,选择个体化的治疗策略,并为患者复发风险和生存质量评估提供指导。随着对CCDC蛋白家族研究的深入,越来越多的证据表明CCDC蛋白在一些恶性肿瘤中发挥着重要作用,其中CCDC170与雌激素受体1基因融合可增加乳腺癌的侵袭性和复发率[16],CCDC8在乳腺癌组织中的表达量低于良性组织,可能起到抑制乳腺癌发生发展的作用[17]。
本研究基于TCGA数据库,首次探讨了CCDC69与乳腺癌的相关性。通过111例癌组织与癌旁组织配对样本基因表达数据发现CCDC69在乳腺癌组织中的表达量较正常乳腺组织下降。基于818例具有完整临床资料的患者样本基因表达数据,发现CCDC69的表达量与患者年龄和肿瘤体积相关,且CCDC69高表达的患者总体生存期明显长于低表达患者,Cox回归分析进一步证实CCDC69 mRNA低表达是影响总生存期的独立危险因素,说明CCDC69在乳腺癌的发生发展过程中可能起到抑制作用。
此外,本研究通过对1108例乳腺癌样本中全基因测序数据进行基因富集分析,进一步探讨了CCDC69抑制乳腺癌的可能机制。研究表明,MYC基因是乳腺癌中重要的原癌基因,与肿瘤细胞迁移和免疫逃逸密切相关[18]。E2F转录因子家族是调控细胞周期的重要蛋白,可通过调节靶基因的转录来控制乳腺癌细胞增殖及凋亡[19]。另外,肿瘤细胞生长过程中需消耗大量的营养和氧气,普遍存在着微环境缺氧、营养匮乏、pH改变等情况,而未折叠反应和糖酵解途径有利于肿瘤在此环境中生存[20-22]。因此,结合GSEA结果,CCDC69可能通过抑制MYC信号通路、E2F信号通路、未折叠蛋白反应和糖酵解途径发挥抑制乳腺癌作用。
综上所述,本研究利用生物信息学方法揭示了CCDC69作为乳腺癌预后标志物的潜在可能性,并对CCDC69在乳腺癌中的作用机制提出假设,为临床诊治乳腺癌提供新的思路。

