微球囊辅助脑造通器在神经内镜下手术治疗基底节区脑出血中的应用*
胡永珍,文世宏,张立阳,龙青山,谭杨劲,温一奇,魏小兵,余永强,李雪松
(惠州市第三人民医院 神经外科,广东 惠州 516002)
高血压脑出血外科治疗的前瞻性、多中心、随机对照研究不多,其结果也缺少对手术治疗的支持[1-3]。目前,高血压脑出血的手术方式及治疗时机尚存在争议,但尽早清除血肿、减轻继发性损伤是高血压脑出血治疗的共识[1]。神经外科医生需不断提高微侵袭的手术方法,在精准外科理念下更好地发挥外科手术的优势。近年来,采用神经内镜颅内清除血肿的报道越来越多,为减轻内镜进出手术通道所带来的一系列损伤,许多医师自制各种手术通道,如:透明导管鞘、无菌橡胶指套包裹胶片作为神经内镜通道等[4-8]。为进一步证实并推广微球囊辅助脑造通器在神经内镜手术的可视性及安全性,达到微侵袭神经外科所要求的以最小创伤取得最佳手术效果的目的,并扩大神经内镜在神经外科领域的应用范围及临床应用价值[8],2017年8月-2018年7月本院采用微球囊辅助脑造通器在神经内镜辅助下治疗基底节区脑出血,清除血肿效果良好。本研究前瞻性分析微球囊辅助脑造通器在神经内镜下手术治疗自发性基底节区脑出血的手术效果,并与同期骨瓣(或骨窗)开颅显微镜下清除血肿的手术病例进行比较。现报道如下:
1 资料与方法
1.1 一般资料
选取本院2017年8月-2018年7月收治的自发性基底节区脑出血患者97例为研究对象,随机分为治疗组和对照组。治疗组46例,行微球囊辅助脑造通器在神经内镜下清除血肿,其中男27例,女19例,平均年龄(59.5±7.5)岁,术前血肿量为(56.5±18.2)ml,格拉斯哥昏迷评分(Glasgow coma score,GCS)为(8.7±2.8)分;对照组51例,行传统骨瓣(或骨窗)开颅显微镜下清除血肿,其中男30例,女21例,平均年龄(61.8±9.6)岁,术前血肿量为(59.5±17.5)ml,GCS评分为(8.5±3.0)分。两组患者术前的一般情况进行比较,差异均无统计学意义(P>0.05),具有可比性。
向所有患者介绍该治疗方案情况并获得其书面同意,本研究获医院伦理委员会认可及批准。所有患者诊断均符合自发性基底节区脑出血的诊断标准[1]。
1.1.1 纳入标准①符合自发性脑出血诊断标准;②根据临床表现和影像学资料明确为基底节区出血;③不存在影响基底节区出血的干扰因素;④年龄为35~70岁,性别不限;⑤出血量≥50 ml,病情较为稳定。
1.1.2 排除标准①由脑外伤、脑肿瘤、脑动脉瘤、脑血管畸形、烟雾病、血液病或凝血功能障碍和系统性疾病等引起的颅内出血患者;②全身情况较差,重要脏器功能不全,不能耐受手术;③年龄<35岁或>70岁;④急性脑干出血患者;⑤出血后病情进展迅速,短时间内陷入深昏迷者。
1.2 血肿量计算
根据多田公式计算血肿量[9]。V(出血量)=a×b×c×1/2。a:最大血肿面积层面血肿的最长径;b:最大血肿面积层面上与最长径垂直的最长径;c:CT片中出现出血的层面数。根据患者术前及术后头颅CT所示血肿,利用多田公式计算血肿量,根据脑内血肿清除率评定手术疗效,计算血肿清除率=(术前血肿量-术后残留血肿量)/术前血肿量×100%。
1.3 手术方法
1.3.1 治疗组手术过程见图1。患者均采用全身麻醉的手术方式。气管插管全麻后仰卧位,头偏健侧。根据CT体表定位,以血肿最大层面为中心,采用直切口,长度5 cm。乳突牵开器牵开皮肤肌肉及骨膜组织,暴露颅骨,应用铣刀铣取骨孔约为3 cm×4 cm,硬膜放射状剪开后,牵向周边,暴露脑皮层。球囊导管(深圳市擎源医疗器械有限公司生产)连接卡口注射器,进行冲洗、排气等操作,避开皮层血管切开皮层1 cm并电凝止血。脑组织用球囊导管扩张,扩张前要预先测量好置入深度,按照设定好的穿刺路径扩张穿刺通道。缓慢多次反复由外向内扩张,每次球囊直径控制在2 cm以内,扩张间歇1 min,扩张结束后,球囊引导置入透明脑造通器(深圳市擎源医疗器械有限公司生产)达血肿腔,拔出内芯,使用德国STORZ 0°神经内镜观察血肿腔壁情况,进行血肿清除,如发现有血管活动出血,给予双极电凝血管止血。血肿腔反复冲洗,残腔用止血纱布覆盖,放置引流管,缝合硬膜,骨瓣复位后应用钛连接片固定颅骨,缝合头皮各层,术毕。

图1 微球囊辅助脑造通器在神经内镜下清除基底节区脑出血的手术过程Fig.1 Surgical procedure of microsphere-assisted brain opener under neuroendoscopy of intracerebral hemorrhage in basal ganglia
1.3.2 对照组患者均采用全身麻醉的手术方式。气管插管全麻后患者仰卧位,患侧额颞部骨瓣开颅,颅骨钻孔后,用铣刀铣下直径约3~5 cm的骨瓣,骨窗尽量靠近中颅底,脑疝患者采用患侧额颞顶部大骨瓣开颅。悬吊硬脑膜后剪开硬脑膜,在显微镜下分开外侧裂的后1/3至岛叶,于大脑中动脉M2或M3分叉部切开岛叶即可进入血肿腔,边清除血肿边止血。所有患者均找到明确的出血动脉。当脑组织压力下降满意及血肿腔无活动性出血后,血肿腔予以止血纱布覆盖,生理盐水冲洗血肿腔至冲洗液清亮后,缝合硬脑膜。无脑疝患者予以骨瓣复位,脑疝患者予以去除骨瓣减压,分层缝合肌肉及各层皮肤,术毕。开颅血肿清除并骨瓣减压典型病例的术前和术后CT见图2。
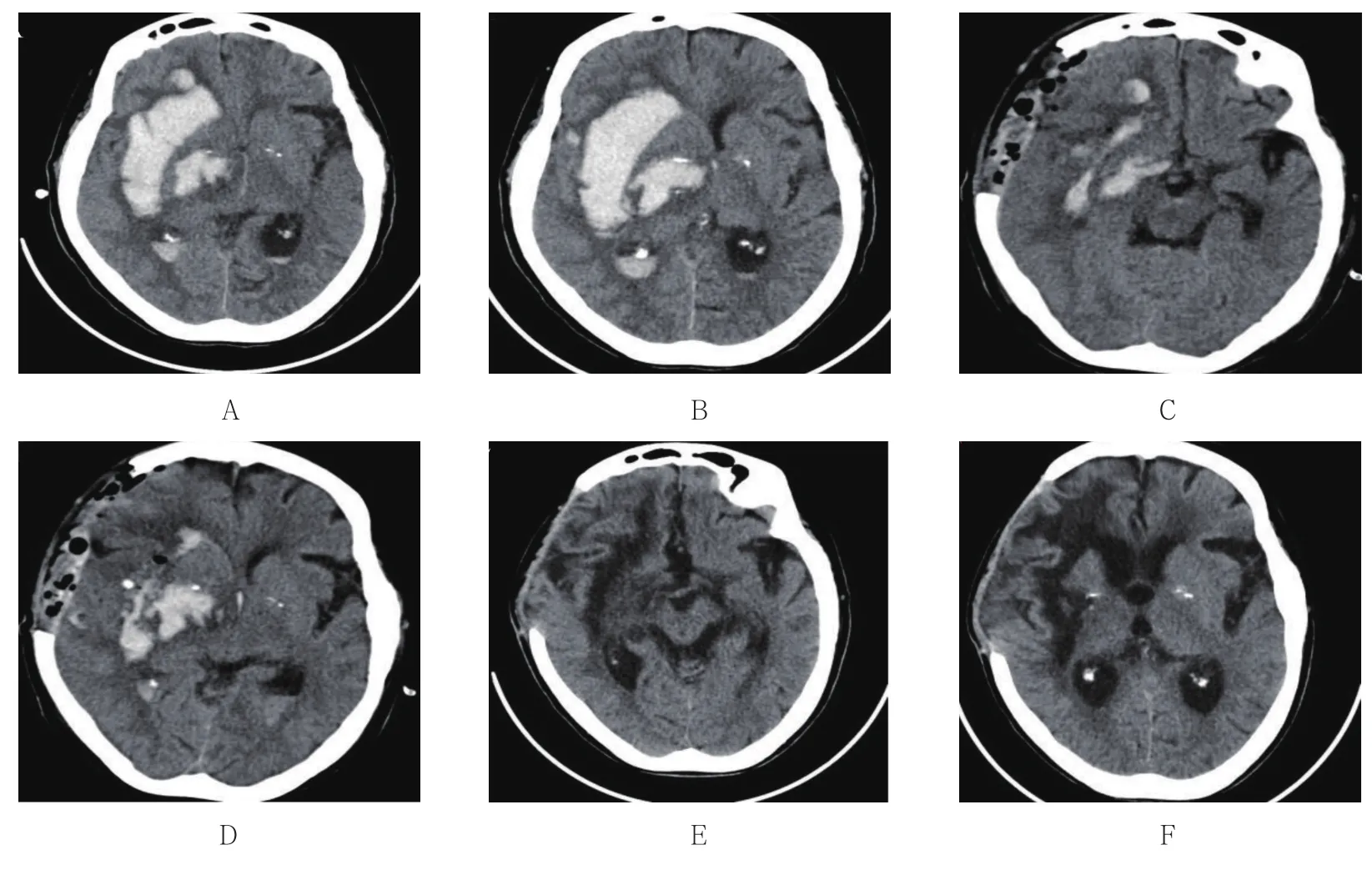
图2 开颅血肿清除并骨瓣减压典型病例的术前及术后CTFig.2 Preoperative and postoperative CT imaging of typical cases who underwent evacuation of craniotomy hematoma with bone flap and decompressive craniectomy
1.4 术后处理
行常规处理,密切观察患者生命体征,控制血压及颅内压,预防并发症。记录手术时间、术中出血量并做好记录;术后当天和次日进行CT扫描,查看血肿清除情况,观察两组患者血肿清除率。根据血肿清除情况决定拔管时间,如残留血肿较多,可经引流管注入尿激酶促进血凝块溶解排出,根据病情恢复情况进行适当康复(高压氧、肢体推拿按摩、针刺物理治疗等)治疗。
1.5 疗效评价
所有患者术后随访6个月,以患者的日常生活能力(activities of daily living,ADL)作为疗效评价指标。①Ⅰ级:完全恢复家庭日常生活能力;②Ⅱ级:有独立日常生活能力并恢复部分社会生活;③Ⅲ级:日常生活需他人帮助;④Ⅳ级:保留意识,但卧床不起,日常生活需要他人帮助;⑤Ⅴ级:植物生存状态;死亡。Ⅰ~Ⅲ级为效果良好,Ⅳ~Ⅴ级及死亡为效果不良。
1.6 统计学方法
使用SPSS 17.0统计软件进行分析,计量资料采用均数±标准差(±s)表示,比较采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术时间和术中出血量比较
两组患者手术情况比较,治疗组手术时间和术中出血量明显低于对照组,差异均有统计学意义(P<0.05)。见表 1。
2.2 两组患者血肿清除率比较
所有患者术后1 d行常规CT检查以了解血肿清除情况。治疗组平均清除率为(90.5±5.3)%,对照组平均血肿清除率为(78.7±11.3)%,治疗组明显高于对照组,差异有统计学意义(P<0.05)。见表2。
表1 两组患者手术情况比较 (±s)Table 1 Comparison of operative situation between the two groups (±s)
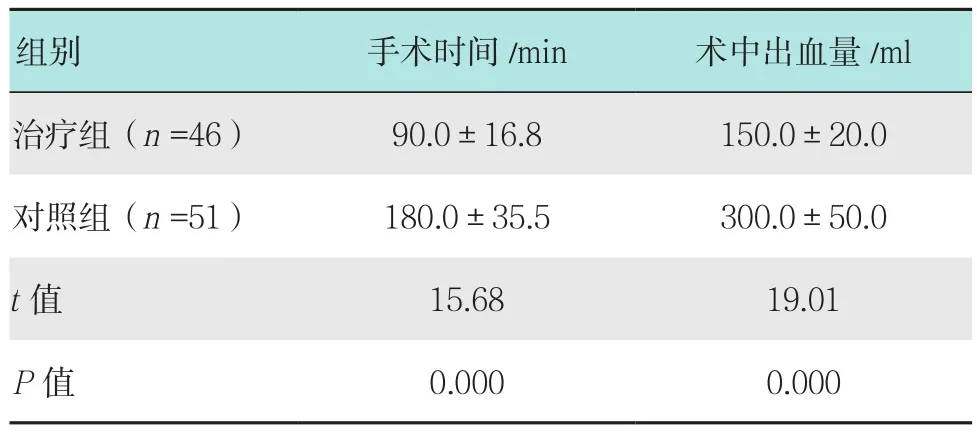
表1 两组患者手术情况比较 (±s)Table 1 Comparison of operative situation between the two groups (±s)
组别 手术时间/min 术中出血量/ml治疗组(n =46) 90.0±16.8 150.0±20.0对照组(n =51) 180.0±35.5 300.0±50.0 t值 15.68 19.01 P值 0.000 0.000
表2 两组患者血肿清除率比较 (±s)Table 2 Comparison of hematoma clearance rate between the two groups (±s)
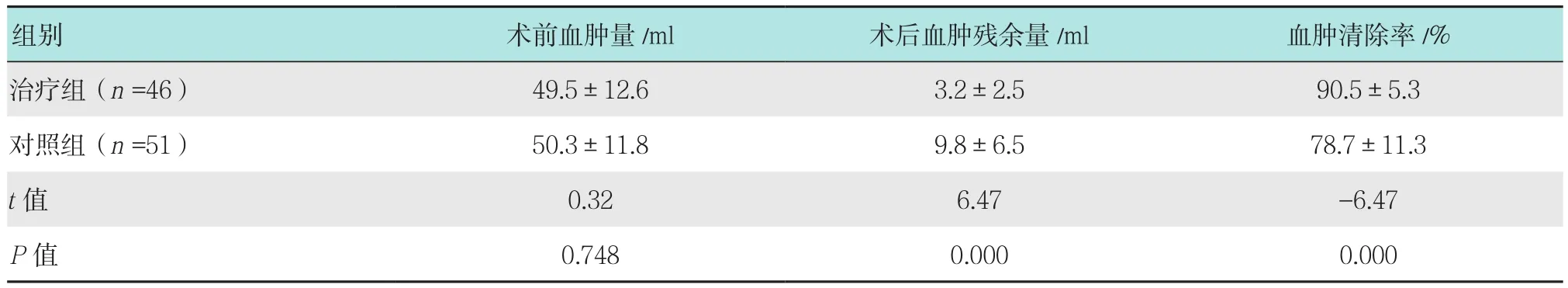
表2 两组患者血肿清除率比较 (±s)Table 2 Comparison of hematoma clearance rate between the two groups (±s)
组别 术前血肿量/ml 术后血肿残余量/ml 血肿清除率/%治疗组(n =46) 49.5±12.6 3.2±2.5 90.5±5.3对照组(n =51) 50.3±11.8 9.8±6.5 78.7±11.3 t值 0.32 6.47 -6.47 P值 0.748 0.000 0.000
2.3 两组患者预后比较
患者术后随访6个月,以ADL作为疗效评价指标。治疗组ADLⅠ级4例,Ⅱ级15例,Ⅲ级14例,Ⅳ级13例,死亡0例;对照组ADLⅠ级5例,Ⅱ级10例,Ⅲ级11例,Ⅳ级25例,死亡0例。治疗组ADL效果良好33例(Ⅰ~Ⅲ级),效果不良13例(Ⅳ~Ⅴ级)。对照组ADL效果良好26例(Ⅰ~Ⅲ级),效果不良25例(Ⅳ~Ⅴ级);两组恢复良好率分别为71.7%(33/46)和51.0%(26/51),治疗组预后优于对照组,差异有统计学意义(P<0.05)。
3 讨论
近年来,随着显微神经外科技术及精准神经外科的发展,脑出血的治疗逐步走向“微创化”“精准化”,其手术目的是尽早清除血肿,降低颅内压,使受损的神经元有恢复的可能性,防止和减轻出血后一系列继发性病理变化导致的继发性神经损伤,打破危及生命的恶性循环,最大限度恢复正常脑功能,从而降低患者的病死率和致残率[10]。应根据患者年龄、身体状况、发病时间、血肿进展情况、血肿量、血肿形态、出血部位、瞳孔变化及术前意识障碍程度等多因素综合考虑手术方式,进行个性化治疗[11]。
脑叶出血的手术治疗Ⅱ期随机临床研究(STICHⅡ)[2]评价自发性脑出血患者,该研究的目的是确定对于幕上脑叶出血的患者是否手术治疗优于保守治疗,并更好地限定早期手术指征,结果显示,早期手术并没有降低术后6个月的死亡或残疾率,对于血肿扩大而进行性恶化的患者和没有脑室扩张的血肿浅表患者来说,手术是有益的,除此之外,仍没有找出哪些患者适合手术治疗,死亡率也没有太大改变。有研究认为[2-3,11],外科手术难以规范,多中心的研究难以得出结论,所以都瞄准了微创。由于临床STICH试验[3]和STICH Ⅱ期试验[2]结果存在显著差异,高血压相关性脑出血患者的治疗时机和手术方式的选择仍有分歧,其手术治疗方式较多,至今尚未形成一种公认的最佳方式。在合适的手术时机进行治疗,为了获得外科实践更高的确定性,需要用好当前先进的医疗设备,例如:影像设备(多排CT和高场强MRI)、神经内镜设备、立体定向系统、计算机导航系统和术中彩超等。可视化技术配合精准的手术规划和精细的手术操作,使原来的大骨瓣开颅手术转变为小骨窗开颅手术、锁孔入路手术、立体定向血肿引流术、神经导航及B超引导下显微手术和神经内镜手术等,让外科医生可以准确控制清除范围,最大化地清除血肿,提升血肿清除的精准性。为患者提供量体裁衣式的外科手术服务,来提高高血压脑出血患者的手术有效治愈率,从而降低死亡率[11-12]。
大骨瓣(骨窗)开颅脑内血肿清除手术创伤相对较大,头皮及肌肉剥离面大,对正常脑组织侵扰大,且手术操作的时间较长、出血多,有时候通过皮层造瘘需要脑压板长时间的牵拉,易导致局部脑组织缺血,或由于脑压板移位导致脑组织的切割伤,加重神经功能缺失。由于高血压脑出血多发生于中老年人,常合并心、肺等其他重要器官的损害,对大手术耐受能力差,可能会影响预后[12]。在显微镜下操作,由于照明技术的限制,血肿清除率低、损伤大,当大部血肿清除后,周边脑组织挤压塌陷,显微镜的光线随着景深的加大会出现盲区,术后可能会出现血肿残留,或者因为有时候为追求血肿彻底清除,需要过度地牵拉脑组织,对周边正常脑组织造成进一步的损伤。而本研究是在微球囊引导下逐步扩张形成一通道,然后再在球囊引导下置入脑造通器,形成真正的“手术通道”,清除血肿过程中,对周边脑组织侵扰小,额外损伤轻微。因此,借助神经内镜的光源直视下清除血肿,对周边脑组织的侵扰较显微镜下手术小。
研究证实[13],立体定向血肿引流术与内镜血肿清除较开颅血肿清除术有明显的优势,内镜手术拥有更高的血肿清除率及安全性,对神经功能恢复有利,并发症及死亡率较低。早期内镜下清除幕上脑内血肿是一种安全有效的治疗措施,其再出血率、致残率和死亡率均低于传统的开颅血肿清除术,同时可改善患者的预后。也有研究[14]使用神经内镜颅内血肿清除术与软通道血肿穿刺引流术治疗高血压性脑出血,并比较两种方式的临床疗效与预后,发现神经内镜微创术可提高血肿清除效果,微创钻孔引流术可缩短手术时间,减少术中出血量,两者均安全、可靠,且预后较好。
有一项Meta分析[15]结果表明,神经内镜手术治疗幕上高血压性脑出血的安全性和有效性均优于显微镜手术,神经内镜手术血肿清除率高,手术时间短,术中出血少,住院时间和入住ICU时间短,并发症发生率及病死率低,术后6个月恢复良好率高。与内镜相比,显微镜进行直线观察尚好,进行带角度观察时观察范围比较有限[4]。显微镜的优点是不占用工作通道的空间,而通过微球囊辅助脑通道系统进行手术时,应用显微镜比应用内镜更有利于显微外科双手操作。微球囊辅助脑通道系统可连续缓慢弧形扩张脑组织,扩张压力平均分布于周围脑组织,狭小的工作通道可减少对血肿周边脑组织的损伤,减少大脑皮质和脑白质的损伤。
本研究使用脑造通球囊,利用球囊的扩张方式进行脑组织牵开,并在脑组织中形成管状通道。首先,此通道形成的创口很小、手术通道稳定,逐步将压力平均分配给周围脑组织,直接减少手术牵拉对病灶周边正常脑组织的损伤。既往脑自动牵开器将压力局限于脑压板下方的较小区域,对局部脑组织压力较大,不仅会影响局部脑组织的血流,导致局部脑血流灌注降低诱发脑水肿,还可能直接损伤周围脑组织导致脑挫裂伤,手术时间较久时,脑压板直接牵拉所致的周边正常脑组织的损伤就更严重,本研究使用脑造通球囊避免了这种情况。其次,在清除脑深部血肿时,手术操作会损伤血肿周边正常脑组织,而脑造通器是透明塑料材质的牵开器,优点是可清晰观察到血肿周围的脑组织,在保护血肿周边脑组织的情况下更有利于手术进行。最后,由于脑造通球囊利用球囊连续缓慢扩张的方式,扩张压力平均分布于周围脑组织,减小脑组织的损伤,尤其在清除深部脑血肿时,与自动牵开器相比更具有优势。
在血肿垂直距离最近处作小骨窗开颅切开硬脑膜,经皮层用脑探针探查血肿腔,穿刺证实血肿部位后,采用微球囊反复缓慢扩张形成手术通道,目的是扩创和推移周围脑组织和血管,再将脑造通器经扩创通道置入达血肿部位后,拔出内芯,形成手术通道。该方法创建手术通道时创伤小,空间相对较大,在神经内镜的光源下能够清晰地显示深部血肿腔的情况,减少了因手术对通道周边脑组织损伤引起的出血,提高了手术的有效率和安全性。脑造通器对周围脑组织和血管有良好保护,置入方向与深度可根据血肿部位灵活调整,有时可在不同角度内镜的引导下,清除不同方位的血肿,并彻底止血[8]。但是,脑造通管鞘需要助手固定,可能由于人为因素引起相关损伤,能够固定可能会更优。内镜只用于照明与观察,清除血肿时由血肿中心向周边扩展,观察过程中用生理盐水适时冲洗,随着脑的不断搏动,有利于周边血肿与周围脑组织分离,当见到灰白色脑组织时,表明已经到达血肿周边,可以停止清除。此操作可以不直接使用吸引器清除周围血肿,避免了因吸力控制不当损伤正常脑组织及小穿支血管引起的新鲜出血,故脑通道系统可以解决此种缺点[16]。手术过程中改变脑造通管鞘方向,可以直视下完全清除脑内血肿并彻底止血,创面贴附止血纱布,必要时使用明胶海绵。有时宁可残留少许牢固的血凝块,清除血肿后在血肿腔内留置引流管,术后复查CT,如残余血肿较多,可以经引流管注入尿激酶促进血块溶解排出。
综上所述,神经内镜技术的进步推动了神经内镜手术在自发性基底节区脑出血中的临床应用。神经内镜手术相比于显微镜手术治疗自发性基底节区脑出血,临床疗效显著,手术时间缩短,术中出血量减少,血肿清除率提高,再出血发生率低,并发症发生率降低,可以改善患者预后,安全性较高。微球囊辅助脑造通器提高了神经内镜手术的可视性及安全性,在保证降低手术人为创伤的条件下,达到了微侵袭神经外科所要求的以最小创伤取得最佳手术效果的目的,进一步扩大了神经内镜在神经外科领域的应用范围,具有较高的临床应用价值。最后,必须强调:脑出血手术的主要目的是降颅压、减低血肿的损伤,而不能为了清血肿而清血肿,追求影像学的完美,而使正常脑组织的意外损伤。

