小浆果中食源性甲型肝炎病毒和诺如病毒流行状况及检测方法的研究进展
冯华炜,艾海新,2,杨天舟,齐梦园,谭燕妮,麻丽丹,刘宏生,2,*
(1.辽宁大学生命科学院,辽宁 沈阳 110036;2.辽宁省生物大分子模拟计算与信息处理工程研究中心,辽宁 沈阳 110036;3.丹东出入境检验检疫局,辽宁 丹东 118000)
食源性甲型肝炎病毒(hepatitis A virus,HAV)和诺如病毒(norovirus,NoV)(基因型I(GI)和II(GII))可以引起人类非细菌性胃肠炎或传染性肝炎,甚至导致死亡,是全世界重要的公共卫生问题之一[1-2]。HAV属微小核糖核酸病毒科(Picornaviridae),NoV属杯状病毒科(Caliciviridae)。HAV和NoV均属单股正链RNA病毒,无包膜,主要通过粪-口途径传播,也可通过人-人接触传播,或通过受污染的水和食物进行传播[3-6]。食源性HAV和NoV具有低剂量感染(10~100 颗粒[7])和强传染性等传播特性,其中,HAV和NoV在粪便中的颗粒数可达106~1012个/g[8-9],1 个NoV颗粒引起的感染率可达50%,超过了已报导的任何一种食源性病毒[10]。此外,食源性HAV和NoV还具有很高的环境适应性,在低温下可存活数月[11-12],在60 ℃和68 ℃的高温下可分别存活30 min和20 min[13],对高压、低pH值以及某些消毒剂也具有一定抵抗力[14-15]。通常,这两种病毒可以通过煮沸快速失活,因此,生的或未煮熟食物极易成为传播食源性HAV和NoV的载体。
草莓、树莓、蓝莓等小浆果被誉为“第三代”水果,因含有丰富的保健营养成分,受到广大消费者的青睐[16]。但是,随着全球小浆果消费量的持续增长[17],新鲜和冷冻小浆果中与食源性HAV和NoV有关的感染事件也在逐年上升。据调查,1983—2014年间,欧洲范围内与冷冻小浆果有关的HAV和NoV污染事件分别达到1 400 起和32 起[18-19]。2012年,德国发生了全球最大规模的食源性NoV感染冷冻草莓事件,感染人数达10 952 人,涉及到400多所学校和日托中心,使得小浆果这一食源性病毒传播载体得到了全世界的高度重视[20]。在对该次爆发事件的污染来源调查中,相关研究的病毒回收率仅在0%~1%之间[21],暴露出受污染小浆果在食源性病毒检测中存在缺陷。
为确保小浆果类食品的安全,本文拟从以下3 个方面进行综述:1)调查食源性HAV和NoV在小浆果中的流行状况,为甲型肝炎和腹泻性疾病的爆发预警提供数据;2)提出食源性HAV和NoV的提取和核酸检测方法的最新知识,为完善食源性HAV和NoV的检测方法提供思路;3)阐述检测过程控制在食源性病毒检测中的应用情况,为准确评估检测结果、合理解释检测数据提供帮助。
1 与小浆果有关的HAV和NoV的流行状况
小浆果靠近地表面生长,无法运用机械采摘,极易受气候条件、灌溉水、土壤环境、采摘人员的影响[9]。新鲜小浆果极易腐烂,通常不进行清洗或消毒处理[22],具有潜在的污染风险。此外,某些食源性病毒可与小浆果表面的土著微生物(如Bacillus spp.、Erwinia spp.、Pseudomonas spp.)分泌的胞外聚合物进行特异性结合,进一步增强了它们的污染能力[23]。大量的研究表明,小浆果已成为传播食源性病毒的重要媒介[19],其中食源性NoV和HAV为污染小浆果的两种重要病原菌[18,24]。

图1 1988—2017年RASFF数据库中HAV和NoV的在小浆果中的爆发和分布情况[29]Fig. 1 Outbreak and distribution of HAV and NoV in berries based on RASFF database from 1988 to 2017[29]
在欧洲,第一例小浆果中HAV和NoV的感染事件分别发生于1983年[25-26]和1987年[27]。根据食品与饲料快速预警系统(rapid alert system for food and feed,RASFF)的数据[28-29](图1),在1998—2017年间,欧盟小浆果中污染NoV的通告数达69 条,污染HAV的通告数达9 条,污染呈逐年增长趋势。作为欧洲小浆果的主要生产国,2013—2014年间意大利因HAV污染小浆果引发的病例数达到1 803 起[5]。由于HAV和NoV在冷冻后仍具有完整基因和结构,因此在所有受污染的小浆果产品中,冷冻类型的浆果成为潜在的高风险食物,如冷冻树莓的污染占所有农产品的23.7%[9-10,28]。1998年,第一例与小浆果有关的HAV和NoV感染事件分别发生于美国的艾奥瓦州和得克萨斯州[30]。根据美国疾病与预防控制中心(Centers for Disease Control and Prevention,CDC)的数据[30](图2),1988—2016年间,HAV和NoV在小浆果中爆发达22 次,导致673 人患病,67 人住院。其中,2013年爆发的HAV污染小浆果事件规模最大,涉及美国十几个州,感染人员达150 人,住院人数比例达44%[9]。在所有污染的食物中,小浆果混合食物(如含小浆果的沙拉或甜点)占主要位置,其次为小浆果单独引起的污染,如HAV和NoV在草莓中引起的感染次数分别为2 次和3 次[30]。
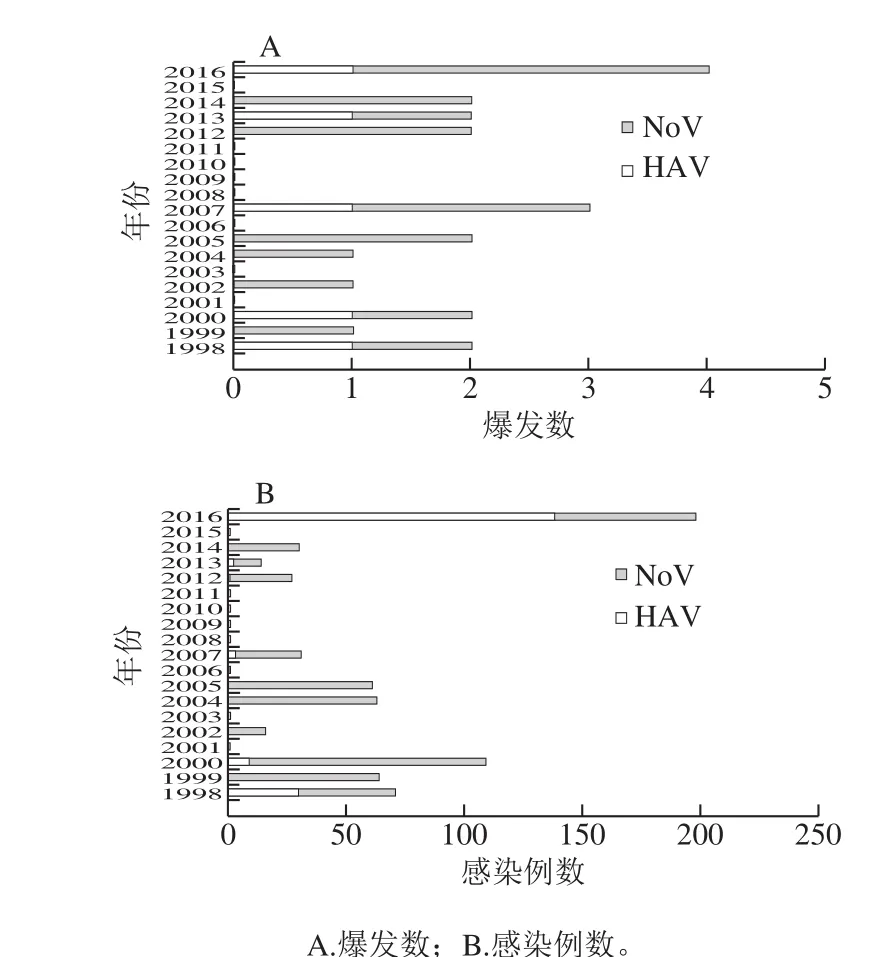
图2 1998—2016年美国小浆果产品中的HAV和NoV引起的食源性疾病[30]Fig. 2 Outbreak of foodborne diseases caused by HAV and NoV in American berry products from 1998 to 2016[30]
在中国,食源性HAV和NoV已成为威胁人们健康的巨大隐患。从“大中华食品安全信息库”(http://kwanlab.bio.cuhk.edu.hk/FS/)[31-32]中搜索的结果显示(图3),2006—2017年间,关于食源性NoV和HAV的新闻和论文分别为278 条和43 条,其中,2013—2015年广东省NoV爆发了52 次[33],2014—2016年青岛市食源性NoV爆发了23 次[34]。国内食源性HAV和NoV的溯源调查显示,贝类产品为主要的污染源,小浆果作为污染源的数据很少[35-36]。但是,这并不能说明我国的小浆果产品是安全的,房保海等[37]对果蔬产品(216 份)中HAV的风险评估结果显示,小浆果产品的阳性率占到了1.85%。根据1998—2017年RASFF的通报数据显示,中国出口小浆果污染NoV达8 例,引发的食物中毒爆发3 次,反映出我国小浆果具有潜在的病毒感染风险[29]。现有研究状况显示,由于病毒检测技术不成熟,无法对具有潜在污染的高风险食品进行检测,从而给中国小浆果产品的污染监测和评估带来困难[34]。
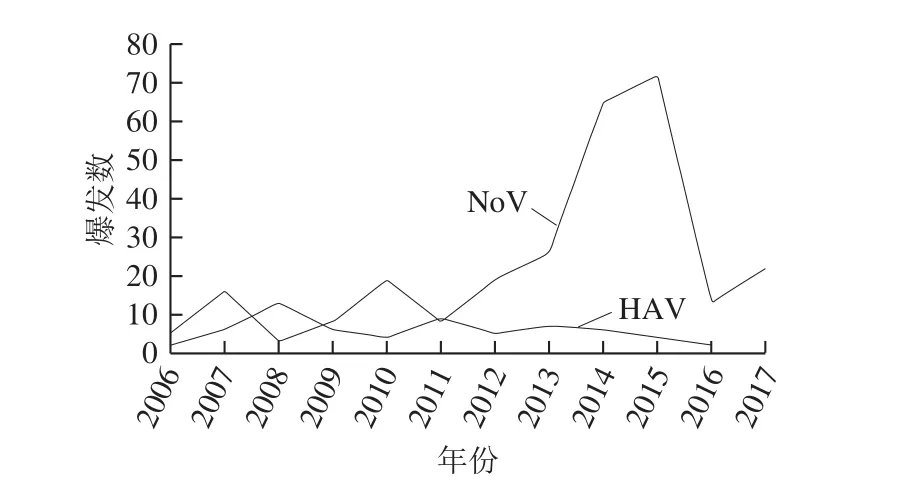
图3 中国食源性HAV和NoV的发生情况[32]Fig. 3 Occurrence of foodborne HAV and NoV infections in China[32]
2 小浆果中食源性病毒的检测方法
2.1 病毒提取方法
2.1.1 病毒洗脱-浓缩法
在食源性病毒的提取方法中,基于病毒洗脱-浓缩的方法在小浆果中得到广泛应用,其中碱性洗脱结合聚乙二醇(polyethylene glycol,PEG)沉淀的方法应用最广。病毒洗脱-浓缩法主要包括两个关键步骤:1)从食品基质中洗脱释放病毒;2)从洗脱液中浓缩病毒。
完整的病毒洗脱是保证病毒颗粒完整提取的重要基础。在小浆果样品的病毒洗脱过程中,大量果胶的存在会抑制小浆果样品中病毒的提取效率,在草莓中加入果胶酶可将HAV的检测灵敏度提高3 倍[38],在含蓝莓的沙拉中加入果胶酶可将NoV GI和NoV GII的回收率提高2~6 倍[39]。不同洗脱液在食源性病毒检测中应用效果已有评估[38,40](表1),常用洗脱液为国际标准化组织(International Organization for Standardization,ISO)/欧洲标准化委员会标准中的Tris-甘氨酸-牛肉浸提物洗脱液(Tris-glycine-beef extract,TGBE)[21,38-39,41],在该洗脱液中,Tris可以保持洗脱液的缓冲能力,甘氨酸用来减少病毒颗粒对食物成分的非特异性吸附。王飞等[42]的研究表明Tralk洗脱液在草莓中的洗脱效果优于TGBE洗脱液和NaOH洗脱液。也有研究指出,食品表面产生的气泡有助于病毒粒子在食品表面进行充分释放,进而提高病毒的洗脱效率[43-44]。Summa等[45]认为以碳酸盐为基础的缓冲液可以在树莓表面形成气泡,对NoV具有更高的洗脱效率。研究表明,聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)可有效去除小浆果中的多酚物质。Hida等[46]在TGBE洗脱液中加入PVP,使得葡萄中鼠诺如病毒-1(murine norovirus 1,MNV-1)的回收率提高了5 倍。
洗脱后的病毒颗粒存在于大体积的洗脱液中,对病毒滤液进行浓缩以获得高浓度、高纯度的完整病毒颗粒对于之后的核酸提取极其重要。尽管有研究表明超滤法[39]和超速离心法[46]在病毒的浓缩中具有良好的病毒回收率,但从总体来看,具有高亲水性的高分子聚合物PEG,可以通过吸收洗脱液中的水分来减少病毒之间的距离,对食源性病毒具有更好的浓缩效果[21,41,47-48]。但在食源性病毒提取过程中,PEG沉淀法会产生许多与病毒无关的小分子物质沉淀,对聚合酶链式反应(polymerase chain reaction,PCR)产生强烈的抑制效应[49-50]。Bartsch等[41]在PEG沉淀病毒后采用MobiSpin S-400 columns对冷冻草莓中NoV提取物进行抑制剂去除,NoV GI的检出率从22.3%提升至59.1%,NoV GII的检出率从40.1%提高至90.9%,有效提高了TGBE-PEG沉淀法的提取效率。
2.1.2 直接提取病毒法
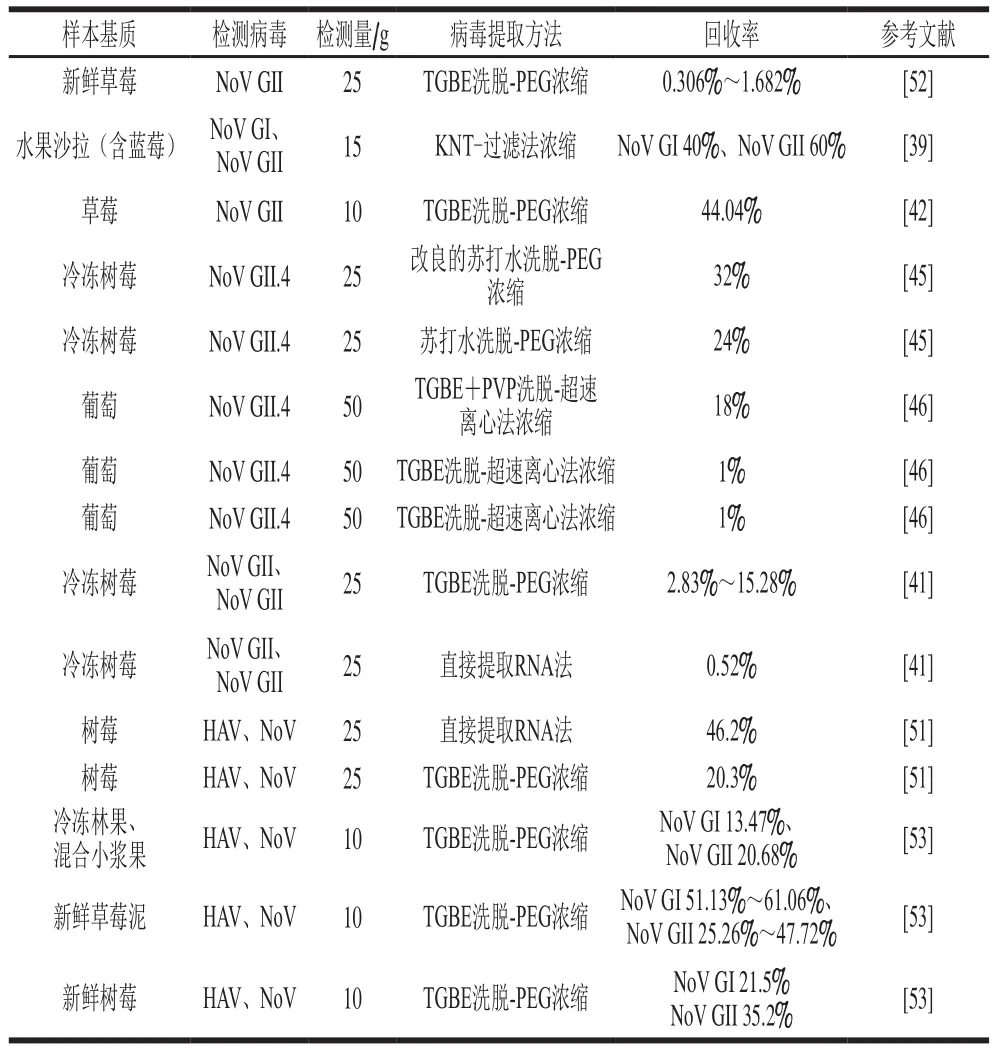
表1 不同病毒提取方法的比较Table 1 Comparison of different virus extraction methods
病毒洗脱-浓缩法通常较为复杂,尤其是针对容易释放大量酸性物质的小浆果时,需对洗脱液的pH值进行反复调节,同时进行多次孵育来释放病毒,完成病毒提取所需的理论时间大约为150 min。目前,直接向小浆果样品表面添加裂解液的病毒提取方法得到了一定应用(表1),具体步骤为:1)样品中添加裂解液,室温孵育5 min;2)室温条件下15 000×g离心5 min,提取病毒RNA。该法操作步骤简单,将病毒提取时间缩短了15 倍,具有很好的病毒提取效率。Perrin等[51]采用该法对树莓样品进行检测,病毒回收率为46.2%,显著高于病毒洗脱-浓缩法(20.3%)。Summa等[45]对直接提取病毒法进行了改良,即收集1 mL的解冻树莓汁液后加入250 μL PEG/NaCl溶液(含50 g、100 mL PEG 8000、1.5 mol/L NaCl)进行沉淀,该法对9 份自然污染的冷冻树莓(100 拷贝数)进行检测时,NoV GII.4的阳性检出率可达44.4%,提取效率(32%)高于病毒洗脱-浓缩法(24%)。受抑制物的影响,直接提取病毒法仍无法应用于其他类型小浆果的检测,该法在草莓中的病毒提取率仅为0.52%[41]。
2.2 病毒检测方法
2.2.1 RT-PCR方法
采用非特异性的置入染料或者特异性探针在“实时”方式下检测病毒RNA的实时反转录PCR(reverse transcription-PCR,RT-PCR)法是食源性HAV和NoV检测的“金标准”,广泛应用于草莓、树莓、蓝莓等小浆果样品的检测[16,39,54]。在食源性HAV的检测过程中,高度保守的5’NCRs是设计HAV引物探针的理想区域[55-61](图4)。目前,很多食源性HAV操作规程都依据该区域设计RTPCR引物和探针[62-64],最佳的RT-PCR引物探针对已被纳入ISO标准。开放式阅读框(ORF)1-ORF2连接区域是NoV最保守的区域,对NoV所有的基因型具有高水平的核酸序列一致性[49,65-66](图5),这个特征使得(ORF)1-ORF2成为设计NoV实时RT-PCR引物的理想区域[16,62-63]。在食源性NoV的检测过程中,不同的实验室采用不同的方法、不同的样本,都会影响实时RT-PCR的检测结果。此外,NoV的高度变异性及持续进化性也会影响NoV的检测灵敏性[67];因此,实时监测和修订实时RT-PCR中的引物探针就变得极其重要。Yoo等[68]对常用的4 种NoV GII和NoV GII引物探针对进行了评估,结果表明在探针中加入ZEN猝灭剂后可有效增加病毒的检测灵敏度,同时降低PCR检测过程中的背景信号。
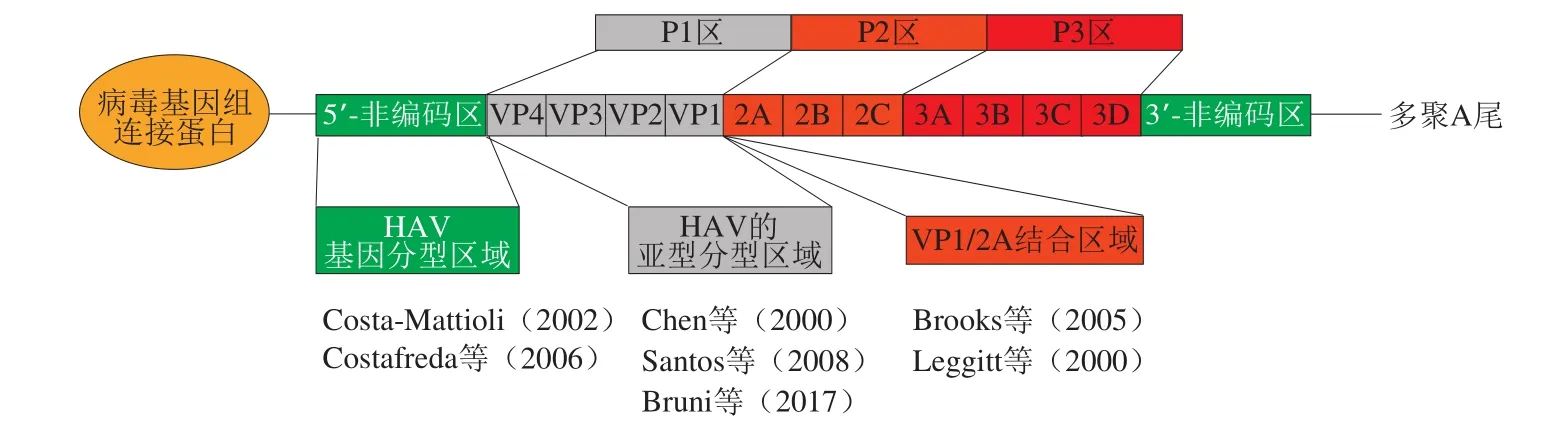
图4 HAV基因组的示意图以及在HAV检测和基因分型中常用的引物和探针的位置[55-61]Fig. 4 Schematic diagram of HAV genome and location of primers and probes commonly used in HAV detection and genotyping[55-61]
在单重定量RT-PCR(RT-quantitative PCR,RT-qPCR)法中,一个样本在检测不同的病毒时,检测所需的核酸量取决于待检病毒的种类,检测效率较低,不适用于检测食源性疾病爆发中的稀有样品。在同一反应管中进行多重病毒检测的多重实时RT-PCR检测技术(multiplex RT-PCR,MRT-PCR)的应用进一步提高了病毒的检测效率,与单重RT-qPCR相比,MRT-PCR可缩短50%的检测时间,显著降低试剂耗材费用。但是受PCR荧光检测通道的影响,病毒在MRT-PCR扩增过程中会产生相互抑制作用,在NED、FAM和VIC荧光通道中,草莓样品中HAV、NoV GI和NoV GII的检测灵敏度分别为31.4 CCID50/20 g、56.2 RT-PCR50/20 g和31.6 RT-PCR50/20 g[69]。为了解决这种缺陷,微流体定量PCR(microfluidic quantitative PCR,MFQPCR)技术进一步得以发展。在MFQPCR技术中,一个芯片上可以同时进行多个纳升级(10-12L)的qPCR,例如,一个96.96 Dynamic Array芯片上可同时进行9 216 个qPCR,可对96 个样品中的96 种病毒同时进行检测[70]。Ishii等[71]采用MFQPCR技术对11 种肠道病毒进行了检测,并从污水中检测出NoV GI、NoV GII和轮状病毒。Oshiki等[72]采用MFQPCR技术对临床和食品中的11 种肠道病毒进行分型,该法在牡蛎中的检测灵敏度为102~105拷贝数/g。目前,MFQPCR技术在食源性肠道病毒的高通量检测与分型中得以应用,在小浆果的食源性病毒调查中应用较少。
2.2.2 数字PCR方法
基于相对基因组定量的RT-qPCR方法需要采用标准品(DNA或RNA)进行校准,定量结果容易产生偏差,对弱阳性样本(Ct值≥40)难以进行定量,且存在严重的RT-PCR抑制效应[73-75]。采用微量核酸直接测定基因拷贝数的数字RT-PCR(digital RT-PCR,dRT-PCR)技术可以解决这一缺陷[76]。dRT-PCR方法通过将样本(微升体积)稀释分配到微流体芯片或微液滴中,采用与RT-qPCR相同的引物和探针进行大量单独的荧光PCR扩增,使得每个反应中包含1 个或0 个目标核酸拷贝数,最后通过泊松分布计算原始样本中核酸的拷贝数[77]。目前,dRT-PCR技术主要应用于细菌性食源微生物的定量检测,少量应用于食源性肠道病毒的定量检测[78-79]。由于dRT-PCR是在RT-PCR终点进行阳性扩增的计数统计,对小浆果中的RT-PCR抑制物具有更高的耐受性。Fraisse等[80]对冷冻草莓、冷冻树莓和冷冻混合莓进行dRT-PCR和RT-qPCR检测,结果显示dRT-PCR(0%~96%)的抑制效率显著低于RT-qPCR(4%~77%),过程控制在dRT-PCR反应体系中无需进行10 倍体积稀释。此外,dRT-PCR具有较高的检测灵敏度,在草莓样品中NoV的检测限为185 拷贝数/25 g,高于RT-qPCR法的257 拷贝数/25 g[81]。在检测低水平拷贝数样品时精确度和重复性更优,适用于混合感染小浆果食物及其加工制品中的食源性病毒检测,但是dRT-PCR法的最低检测限在低污染小浆果中的实际应用价值尚需进一步验证[80]。2.2.3 下一代测序技术
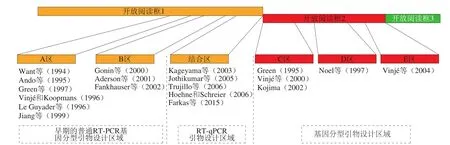
图5 NoV基因组的示意图以及在NoV检测和基因分型中常用的引物和探针的位置[49,65-66]Fig. 5 Schematic diagram of NoV genome and location of primers and probes commonly used in NoV detection and genotyping[49,65-66]
基于PCR的方法扩增片段较小(小于100 bp),且高度依赖引物探针,因此不能区分食源性病毒的感染性与非感染性,对病毒的基因分析也受到一定限制[82]。利用下一代测序技术(next-generation sequencing,NGS)对病毒的宏基因组进行分析,不仅有利于对食源性致病菌达到分子水平上的整体深入认识,同时也给食源性病毒的快速检测提供了更灵敏、更特异的技术可能。NGS的原理类似于Sanger测序,即在DNA模板重新合成一个片段的过程中,对每一个小片段DNA的碱基序列的实时识别。NGS以一种大规模并行的方式将这个过程扩展到数百万个反应中,实现了病毒全基因组的高通量快速测序。在合适的测序深度下(食源性病毒基因组较小,测序结果中注释到病毒的序列较少,所需测序深度可达上百倍),NGS可以完成食品样品中常见和罕见的NoV变异序列的分析[83]。Imamura等[84]采用NGS技术对日本牡蛎中NoV的多样性进行分析,共发现5 种NoV基因型(GII.3、GII.4、GII.13、GII.16和GII.17),同时区分了NoV的感染性与非感染性。NGS技术还具有很高的灵敏度,可以从人工污染的芹菜检测出低于103拷贝数的HAV和NoV[85]。作为一种无目标的方法,NGS技术可用于食源性疾病爆发事件的污染源调查。Bartsch等[81]采用该技术对2012年德国爆发NoV感染事件中的冷冻草莓进行检测,成功检测出2 株NoV(NoV GII.P16和NoV GII.13)。目前的研究表明,测序过程中产生大量与植物相关的序列(87.06%)使得与病毒相关的序列(0.01%)相对较少,是目前限制NGS用于小浆果中食源性病毒检测的障碍。未来仍需通过各种方法对NGS技术进行完善,例如通过样品的DNases处理去除测序过程中产生干扰序列。
3 检测过程控制
基于PCR的方法在食源性病毒的检测中分为3 个步骤:1)病毒提取;2)病毒RNA提取;3)RT-PCR检测。在病毒检测过程中,抑制效应发生于各个检测阶段。首先,食品样品基质中存在大量的RT-PCR抑制物会影响食源性病毒的有效提取,如小浆果中存在的果胶、鞣质酸会影响病毒的浓缩;其次,病毒RNA提取过程中提取试剂、食品基质成分的残留同样会对RT-PCR产生抑制作用,如来自小浆果中的酚类、多糖物质,可随病毒RNA的提取共同被提取出,对RT-PCR扩增造成干扰[86];最后,RT-PCR检测中,RNA提取试剂的残留、引物探针和酶的质量也会影响病毒的扩增效率。针对各检测阶段中抑制物的去除方法已有大量研究[87-88],如RT-PCR扩增前使用One-StepTMPCR Inhibitor Removal Kit去除抑制剂。但是没有一种方法能够彻底去除病毒检测中存在的抑制物质,因此需在病毒检测过程中建立完善的质量控制(过程控制),来判定病毒检测结果的可靠性。依据添加位置的不同,过程控制被分为3 个类型(图6):1)全程过程控制(whole process controls,WPCs):在病毒提取前加入;2)分子过程控制(molecular process controls,MPCs):在核酸提取前加入;3)RT-PCR控制:在RT-PCR扩增前加入。另外,过程控制的提取效率需满足一定的水平,通常将病毒RNA的提取效率分为3 个水平:低(小于1%)、可接受(1%~10%)和良好(超过10%)[89]。当RNA提取效率小于1%时,需重新进行病毒富集或病毒RNA的提取。
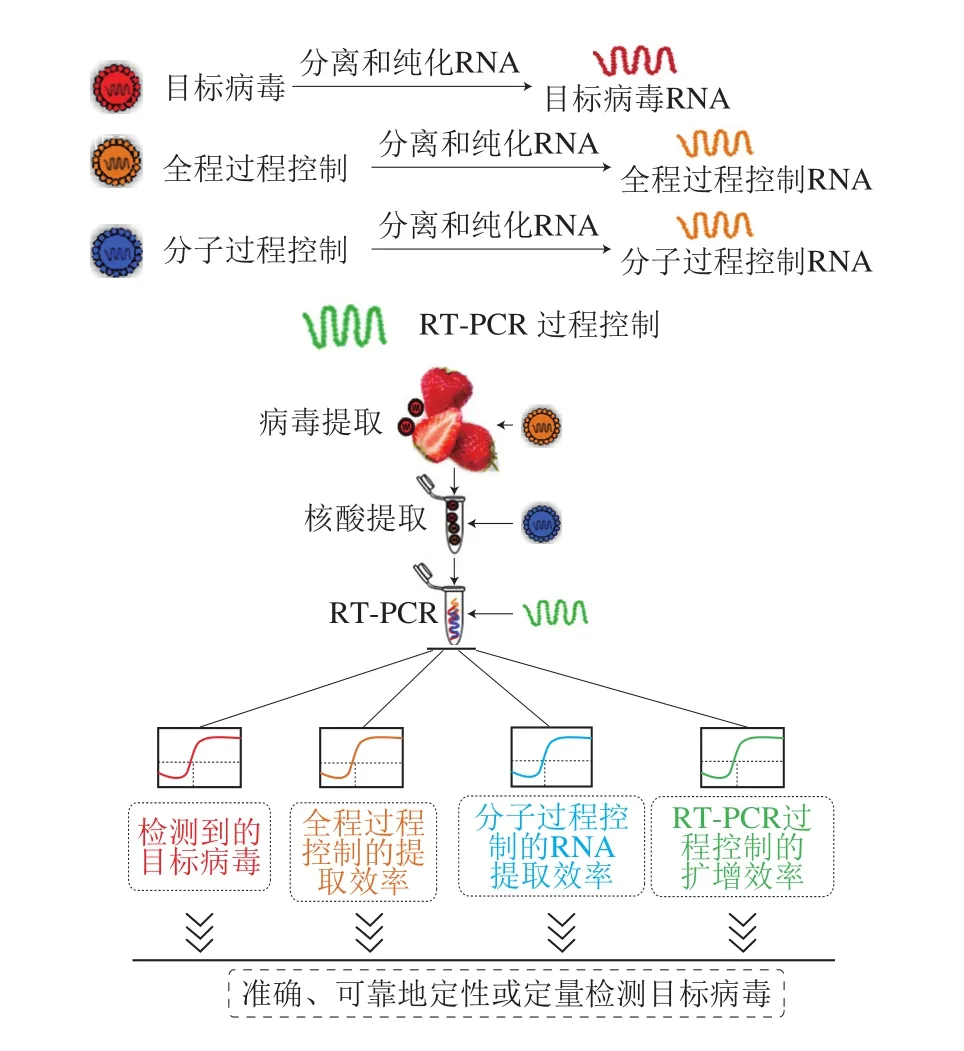
图6 过程控制在食源性病毒检测过程中的应用框架图Fig. 6 Framework of process controls used for virus detection in foods
3.1 全程过程控制
在确定目标病毒的提取效率时,在样本中加入一定量的过程控制可以反映目标病毒的回收效率。这种过程控制的回收率既受浓缩效率的影响,也受RNA提取效率和RT-PCR的影响。因此接种于样品中的过程控制是一个典型的WPCs。可培养的病毒颗粒是评估食源性病毒提取效率的理想WPCs(表2),这些病毒与待检目标病毒具有相似的形态、遗传、环境持久性,更不会出现在待检的污染样品中[48,90]。WPCs在食源性HAV和NoV检测中的应用研究显示,WPCs和目标病毒的相关性主要取决于食品基质的类型。如MNV可以有效指示NoV GI和NoV GII在小浆果中的回收率[91],但不能指示瓶装水或半干番茄中NoV GI的回收率[92]。同一WPCs在不同类型的食品中也具有不同的回收率,如MNV在草莓中的回收率为(20.69±2.89)%,在树莓中的回收率却为(17.36±1.57)%[39,93]。此外,病毒提取过程中发生的大量损失也是影响WPCs回收率的主要原因之一。不同WPCs的损失位置也有很大差异,MNV-1和MS2噬菌体的损失主发生在病毒浓缩过程中,杜兰病毒(Tulane virus,TV)的损失发生在病毒洗脱和浓缩过程中[94]。在指示目标病毒的提取效率时,WPCs的加入量应大于或等于WPCs在待检样品中的检测限。例如,当MNV-1在瓶装水、西红柿和生菜中的检测限分别为106、107、108拷贝数时,该WPCs在样品中添加量应大于108拷贝数[92]。
3.2 分子过程控制
WPCs的指示效率容易受下游操作的影响(如病毒RNA提取和RT-PCR扩增中存在的抑制效应),从而导致同一WPCs在相同的样品中表现出不同的提取效率,因此针对不同检测阶段采取不同的过程控制极为重要。在提取好的病毒沉淀或溶液中加入一定量的MPCs进行共同提取(原倍MPCs与10 倍体积稀释的Ct值之差在3.3左右[95]),可以有效指示病毒RNA提取过程中发生的抑制效应。WPCs的添加量需进行准确评估,含量过高会抑制目标病毒,含量过低会降低检测限。研究表明,MS2的含量为104拷贝数/mL时,对目标病毒的影响可以忽略不计[96]。
基于基因相似的病毒具有相似的核酸提取效率的理论,门哥病毒(Mengo virus,MgV)常用来指示食源性HAV的RNA提取效率[62-64,92,97]。在ISO标准中,MgV也被用作指示食源性NoV RNA提取效率的MPCs[62-63]。此外,MNV和TV也是小浆果样品中检测NoV常用的MPCs[98]。但是,MNV和NoV在临床表现、宿主受体发病机制和感染的细胞类型等方面还有一些差别[99]。由于MNV的功能受体为唾液酸[100],而NoV的功能受体为组织血型抗原(histo-blood group antigens,HBGA)[101],因此能够识别A型和B型HBGA作为受体进行感染的TV似乎更适合作为NoV的MPCs[102]。作为过程控制的天然病毒具有致病性,对实验室条件有很高的要求,因此采用包被特定病毒基因的装甲RNA技术得到发展,其中采用该技术构建的MS2噬菌体样病毒颗粒得到广泛应用,可以对食源性HAV和NoV的RNA提取和浓缩效率进行有效控制[96]。
与相似理论不同的是,基因相似的MPCs似乎不能一直具有相同的核酸提取效率,核酸的提取效率多取决于待检病毒类型及待检食品类型。Hennechart-Collette等[92]的研究表明,MNV-1适用于检测瓶装水、西红柿和生菜中的HAV,不适于检测瓶装水和生菜中的NoV GI和NoV GII,而MgV更适用于检测瓶装水和生菜中的NoV GI和NoV GII。因此,在实际检测工作中,需针对不同类型的食品基质,采用不同的MPCs进行核酸提取效率的监控。
3.3 RT-PCR过程控制
在RT-PCR阶段,核酸反转录的平均效率仅为20%[103],同一个RT-qPCR反应也会出现不同的扩增效率,因此在含有WPCs的核酸溶液中加入特定的DNA或RNA,是评估目标病毒RT-PCR抑制效应的有效方法。当RT-PCR过程控制的抑制指数小于2.0时,表明WPCs具有良好的提取效率,也表明RT-PCR扩增效果良好[90]。在食源性病毒的检测中,各种类型的DNA或RNA可以作为RT-PCR过程控制(表2)。其中,靶病毒的DNA质粒或RNA序列经常被用作RT-PCR控制[104-106],这种控制可以和目标病毒采用相同的引物和探针进行检测。但是,当反应体系中存在抑制物质时,过程控制和目标病毒在同一反应管的扩增效率就很难准确计算。此外,使用该类RT-PCR控制容易引起待检核酸样品的污染,导致“假阳性”检测结果的产生。此外,在PCR反应体系中加入外部扩增控制也可以指示RT-PCR的抑制效应。该类过程控制与目的基因序列共用同一对扩增引物,通过扩增产物大小或荧光标记与靶病毒进行区分,避免了在PCR反应体系中多对引物间的相互作用,可用小浆果样品中病毒RT-PCR抑制效应的监测[64,80]。

表2 食源性HAV和NoV检测过程中常用的过程控制类型Table 2 Types of process controls used in the detection of foodborne HAV and NoV
4 结 语
食源性HAV和NoV引发的小浆果产品感染已成为全球重要的公共卫生问题之一,而且已经有愈演愈烈的趋势。流行病学调查数据显示,受污染小浆果主要集中于欧盟地区,感染类型为草莓和树莓,由于检测技术的限制在中国少有报道统计。然而,已有的资料仅仅是冰山一角,由于缺乏合适的检测方法对低剂量病毒感染的食物进行的检测,使得50%的病毒引起的食源性感染不为人们所知[111],这意味着小浆果产品中食源性病毒的快速检测仍然面临巨大的挑战。针对爆发的食源性HAV和NoV污染物的检测结果显示,HAV和NoV在小浆果中分布不均匀,同一批次样品存在比例不同的阴性和阳性样本,进一步加大了食源性病毒检测检测难度[49],而国际权威的ISO标准只对检测所需的取样量进行规定,缺乏小浆果批次产品的采样标准[62-63]。因此,建立可靠的采样标准和检测方法是解决污染小浆果产品农产品中低剂量HAV和NoV不均匀分布的问题的有效途径。
在食源性HAV和NoV的检测中,病毒提取、核酸检测和检测过程控制是三大关键因素。在病毒提取中,洗脱-浓缩法成为常规提取方法,在洗脱缓冲液中加入PVP、果胶酶等物质可以减少食品基质效应的影响,利用食品表面产生的气泡充分释放吸附于食品表面的病毒颗粒,采用直接提取病毒RNA法在特定浆果中也有一定应用,但是如何尽可能地去除提取过程中产生的抑制物质、完善病毒提取方法的适用性仍然面临挑战。在核酸检测方面,基于PCR的方法是食源性病毒检测的“金标准”,其中,单重RT-qPCR和MRT-qPCR方法检测效率低,不适用于大样本的检测;MFQPCR可以实现小浆果产品中食源性病毒的高通量检测与分型,但是尽可能地去除PCR抑制物质仍然是研究人员需要努力的方向;绝对定量的数字PCR技术对抑制物的耐受性强于RT-qPCR方法,具有很高的灵敏度,适用于高抑制剂食物的无标定量检测,但是该法的最低检测限在弱阳性小浆果样本中的实际应用价值还需进一步验证;采用NGS技术对病毒宏基因组进行分析,不但可以实现未知病毒的定量检测与分型,还可以判断病毒的感染性,已在NoV的病毒学监测[112]和环境监测[113]中得到一定应用,是最有前景的食源性病毒分析方法之一,但是有效去除干扰序列是下一步所期待解决的问题。在检测过程中评估病毒回收率的过程控制可分为3 种类型:WPCs、MPCs和RT-PCR控制,也有各种类型的过程控制应用于各个检测阶段,但迄今为止还未建立既可用于控制又能保持适当回收率的过程控制“金标准”;其次,在评估检测过程的整体性能时,不仅需要考虑单个样本的回收率,更要考虑样本的平均回收率,才可以实现检测数据的准确解释;最后,利用装甲RNA技术构建非致病性的病毒样颗粒可以对病毒的检测效率进行指示,但在实际检测过程中,仍需考虑病毒样颗粒对目标病毒的适用性。
源头控制是食源性疾病防控的一个重要手段,通过建立可靠的采样标准和良好的检测方法,可以快速溯源爆发中可疑的污染源。此外,建立小浆果食源性HAV和NoV爆发数据库,利用大数据分析方法建立食源性HAV和NoV爆发预测模型,从时间、空间、生产链等方面对小浆果产品中可能发生的食源性病毒感染进行精准预测,进而从源头上防控食源性HAV和NoV病毒的爆发和感染。

