基于GFP-nanobody的纯化酵母表达RIIIJ-GFP蛋白研究
郑 磊, 田发安, 樊海平, 缪 颖, 伍炳华
(1. 福建农林大学生命科学学院分子细胞和系统生物学中心, 福建 福州 350002; 2. 福建省淡水水产研究所, 福建 福州 350002)
0 引言
纳米抗体(nanobody)是在羊驼中发现的一种缺失轻链和CH1恒定区的重链抗体(heavy chain Abs, HCAbs)[1]. 体外克隆其可变区得到重链单域抗体, 即纳米抗体[2]. 纳米抗体具有分子量小、 体内组织渗透性好、 易穿过血管或组织到达靶部位、 与常规抗体的最佳结合能力相近的特性, 这些特性使得纳米抗体被广泛地用于疾病诊断与治疗等[3-7]. 纳米抗体也可作为蛋白纯化的亲和配基, 如抗人类特异性免疫球蛋白的纳米抗体可用来纯化血液中半衰期短的免疫球蛋白[8].
高纯度绿色荧光蛋白(green fluorescent protein, GFP)蛋白免疫羊驼淋巴细胞, 采用噬菌体展示等技术可获得GFP-nanobody蛋白基序[9], 从而可将其反译, 获得基因片段, 进行体外的克隆与重组表达. GFP-nanobody 可以在体内和体外与GFP结合, 从而在亚细胞定位、 蛋白质活性、 蛋白质相互作用等方面广泛应用[10-13]. GFP与GFP-nanobody结合蛋白复合物晶体的研究揭示了其特异性, 即GFP-nanobody与GFP、 YFP能结合, 与CFP、 mRFP、 mCherry、 mOrange 不能结合[13-14]. 因此, GFP-nanobody可作纯化的亲和配基, 纯化GFP标签蛋白.
RIIIJ是由25个氨基酸残基组成的芋螺小肽, 可做电压门控钾通道Kv1.2的阻断剂[15]. 本研究采用大肠杆菌体外重组表达GFP-nanobody, 将其制备成凝胶株, 即GFP-nanotrap[13]. 由于GFP-nanobody具有抗体的特异性, 因此, 采用GFP-nanobody纯化酵母分泌表达的融合蛋白RIIIJ-GFP, 期望获得高纯度的融合蛋白, 为研究RIIIJ蛋白的结构和功能奠定基础.
1 材料与方法
1.1 材料
1.1.1菌种和质粒
E.coliBL21 (DE3) 、 表达质粒pET-28a均由本实验室保存; 毕赤酵母分泌表达融合蛋白RIIIJ-GFP工程菌由本实验室构建.
1.1.2试剂
EcoRI、HindIII、 PageRuler Prestained Protein Ladder购自美国Thermo Fisher公司; T4 DNA连接酶购自日本TaKaRa公司; 质粒提取试剂盒、 琼脂糖凝胶回收试剂盒购自天根生化科技(北京)有限公司; 镍柱与NHS活化羧基琼脂糖凝胶购自美国GE公司; 10 ku超滤离心管购自德国Millipore公司; 异丙基-β-D-硫代半乳糖苷(IPTG)购自北京索莱宝科技有限公司.
1.1.3培养基
LB培养基: 0.5%(质量分数, 下同)酵母粉, 1%蛋白胨, 1%氯化钠.
BMGY培养基: 1%酵母粉, 2%蛋白胨, 100 mmol·L-1的磷酸缓冲液(pH=6.0), 1.34%YNB, 0.000 4%生物素, 1%(体积分数)甘油.
BMMY培养基: 1%(质量分数, 下同)酵母粉, 2%蛋白胨, 100 mmol·L-1的磷酸缓冲液(pH=6.0), 1.34%YNB, 0.000 4%生物素, 0.5%(体积分数)甲醇.
1.2 方法
1.2.1GFP-nanobody表达载体的构建
将GFP-nanobody(NCBI蛋白ID: 3OGO_E)蛋白序列, 反转成大肠杆菌密码子偏好基因序列. 全合成GFP-nanobody基因与EcoRI 、HindIII双酶切的pET-28a用T4 DNA连接酶连接, 转化至感受态E.coliBL21 (DE3), 涂布 LB ( Kan 50 μg·mL-1)平板. 挑选单克隆, 接种LB ( Kan 50 μg·mL-1)液体培养基, 37 ℃, 200 r·min-1培养过夜. 用质粒小提试剂盒提取质粒. 采用双酶切及测序进行质粒阳性鉴定.
1.2.2重组GFP-nanobody的诱导表达及纯化
将阳性克隆接入LB ( Kan 50 μg·mL-1) 的培养基中, 37 ℃, 200 r·min-1培养至 OD600达到 0.6~0.8, 加入 IPTG 至终浓度 0.5 mmol·L-1. 于 16 ℃, 200 r·min-1诱导表达12 h后, 4 ℃, 6 934 r·min-1离心收集菌体. 加入 10 mL PBS重悬菌体, 超声破碎(功率25%, 超声时间 2 s, 间隔时间 5 s , 超声15 min). 破碎后的液体, 12 753 r·min-1离心10 min, 收集上清. 采用镍柱对破碎上清进行纯化, 并用 SDS-PAGE 检测重组蛋白的纯化效果.
1.2.3重组RIIIJ-GFP的诱导表达
挑取RIIIJ-GFP毕赤酵母工程菌单菌落接入BMGY培养基, 30 ℃, 200 r·min-1振荡培养. 培养菌体浓度至OD600=2~6, 更换为BMMY. 每隔24 h, 补加甲醇至终浓度为0.5%(体积分数). 发酵96 h, 5 371 r·min-1离心10 min, 收集上清液. 采用10 ku超滤离心管浓缩上清液, -80 ℃保存备用.
1.2.4GFP-nanotrap的制备及对融合蛋白RIIIJ-GFP的纯化
纯化后重组蛋白GFP-nanobody 10 mg与2 mL NHS活化羧基琼脂糖凝胶按照说明书进行偶联. 将节1.2.3制备的50 mL浓缩发酵液与2 mL GFP-nanotrap珠子混合, 4 ℃低速震荡3 h后, 3 101 r·min-1离心5 min, 去除上清. 加入40 mL PBS 缓冲液洗脱未结合的蛋白, 重复5次. 取20 μL珠子荧光显微镜下观察.
收集沉淀转移至5 mL柱子, 用5倍柱体积 PBS 缓冲液洗脱未结合的蛋白. 用0.2 mol·L-1Gly (pH =3.0)洗脱3个柱体积, 并分别收集洗脱液. 取20 μL洗脱后珠子荧光显微镜下观察.
洗脱后的柱子用5倍柱体积 PBS 平衡, 取20 μL平衡后珠子荧光显微镜下观察. 加入2倍柱体积20%(体积分数)乙醇, 4 ℃保存.
1.2.5SDS-PAGE胶上直接观察GFP荧光
60 μL样品和20 μL上样缓冲液混合后, 37 ℃、 温浴5 min. 采用SDS-PAGE检测融合蛋白. 跑胶结束后, 切除溴酚蓝条带. 采用GBox Chemi XT4荧光化学发光成像系统观察胶上荧光[16].
2 结果与讨论
2.1 GFP-nanobody蛋白表达与纯化
构建的重组质粒pET-28a-GFP-nanobody, 转入E.coliBL21获得重组菌. 重组菌接种LB培养基, 加入IPTG诱导, 收集菌体, 进行重组蛋白纯化.
SDS-PAGE电泳图(见图1)表明, IPTG诱导后菌体破碎液的与诱导前菌体破碎液相比, 在16 ku左右明显有表达条带; 纯化后的融合蛋白GFP-nanobody较纯. 重组GFP-nanobody蛋白的相对分子质量约为16 ku, 与理论预测值相同.
2.2 GFP-nanobody纯化RIIIJ-GFP蛋白的荧光观察
含有RIIIJ-GFP基因的酵母表达菌在BMMY培养, 加入甲醇诱导, 收集发酵液上清液. 采用GFP-nanotrap纯化上清液. 荧光显微镜观察GFP-nanotrap珠子洗脱前后的荧光强度变化, 结果如图2所示.
图2显示, 制备的GFP-nanotrap珠子呈圆形, 大小约为45~160 μm. 在Gly溶液洗脱前, GFP-nanotrap发出强绿色荧光, 表明GFP-nanotrap成功结合融合蛋白RIIIJ-GFP. 原核表达的GFP-nanobody具有生物活性. 加入Gly (pH =3.0)洗脱后, 珠子无荧光发出; 加入PBS(pH =7.4)再次平衡后, 珠子有弱荧光. 这表明在pH=3.0时RIIIJ-GFP蛋白部分变性, 无荧光发出[17]; 在pH=7.4时, RIIIJ-GFP蛋白复性, 又有荧光发出. 同时也表明Gly (pH=3.0)不能完全洗脱结合的RIIIJ-GFP蛋白, 部分蛋白仍结合在珠子上.

图1 SDS-PAGE分析GFP-nanobody蛋白表达与纯化Fig.1 SDS-PAGE analysis of purified recombinant GFP-nanobody
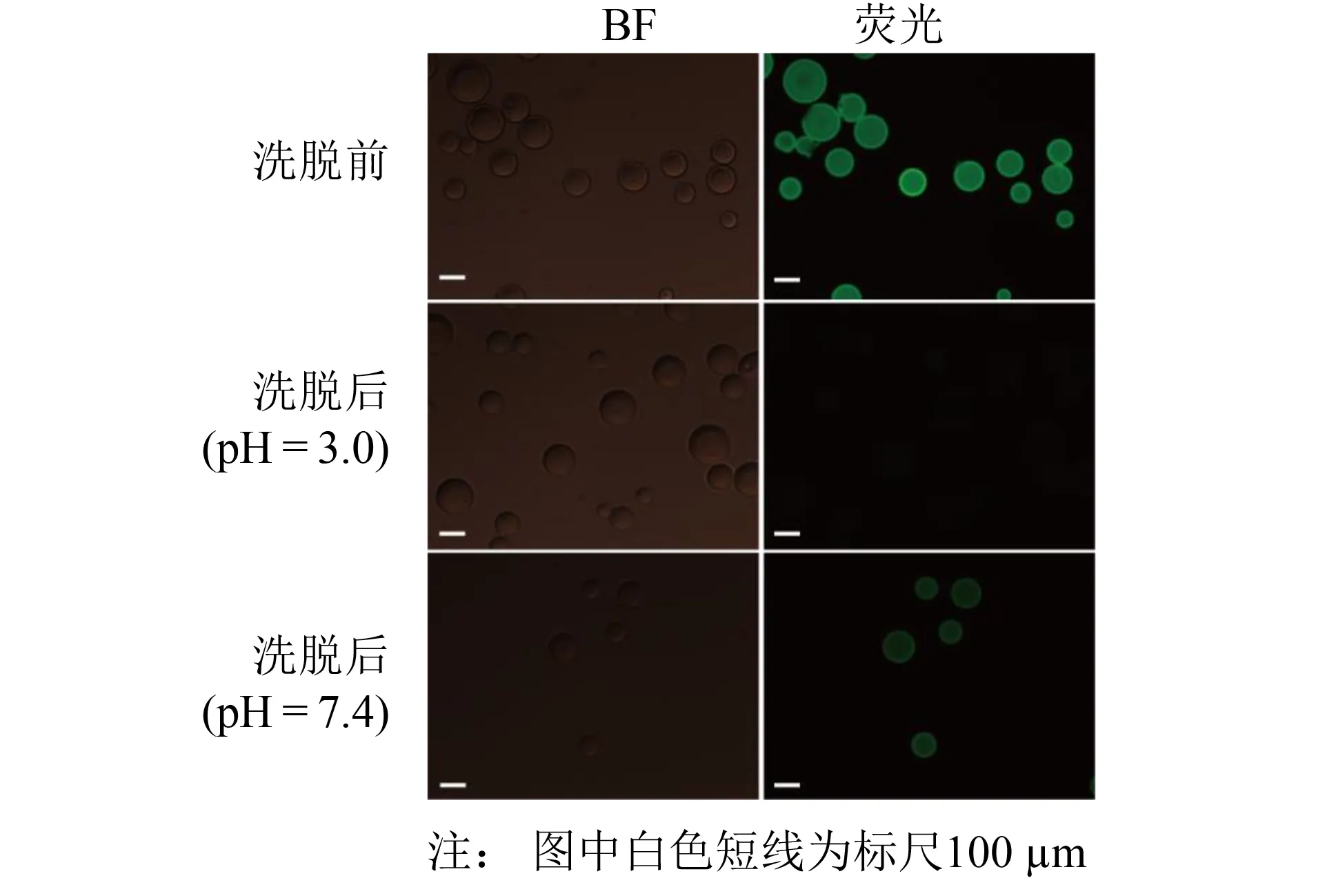
图2 GFP-nanobody珠子纯化RIIIJ-GFP的荧光观察 Fig.2 Fluorescent observation of recombinant RIIIJ-GFP purified by GFP-nanotrap
2.3 SDS-PAGE分析纯化的RIIIJ-GFP

图3 SDS-PAGE分析纯化的融合蛋白RIIIJ-GFP Fig.3 SDS-PAGE analysis of purified fusion protein RIIIJ-GFP
采用SDS-PAGE分析Gly洗脱的蛋白, 电泳结束后, 分别进行考马斯亮蓝染色和胶上直接荧光观察GFP荧光, 如图3所示.
GFP-nanotrap纯化后的蛋白, 采用荧光化学发光成像系统直接观察SDS-PAGE胶上荧光, 呈现单一绿色荧光条带, 表明融合蛋白RIIIJ-GFP成功纯化(见图3(a)). 纯化后的融合蛋白RIIIJ-GFP染色后呈单一条带, 纯度达到电泳纯(见图3(b)). RIIIJ-GFP重组蛋白相对分子质量约为32 ku, 与理论预测值基本相同.
此外, 融合蛋白RIIIJ-GFP分别进行37 ℃(见图3
(a))和100 ℃(见图3(b))的处理, 导致跑胶后蛋白大小不同. 煮沸样品的迁移速率小于37 ℃温浴样品.
3 结语
研究将GFP-nanobody蛋白序列反转成基因序列, 全基因合成后克隆至表达载体pET-28a, 并在E.coliBL21(DE3)中诱导表达. 采用镍柱纯化重组GFP-nanobody的相对分子质量为16 ku. 重组GFP-nanobody与NHS活化羧基琼脂糖凝胶偶联后制备成特异性GFP-nanotrap. 酵母工程菌在BMMY培养基上诱导表达融合蛋白RIIIJ-GFP, 收集的上清液浓缩后与GFP-nanotrap混合. 采用Gly (pH=3.0)洗脱凝胶珠后进行SDS-PAGE分析. 结果显示得到的融合蛋白RIIIJ-GFP纯度高, 达到电泳纯. 原核表达的GFP-nanobody具有生物活性. 在SDS-PAGE胶上直接观察到GFP绿色荧光, 表明在pH=3.0洗脱下的GFP融合蛋白未变性.
由于纳米抗体具有抗体高特异性的特点, 相对镍柱亲和纯化组氨酸标签蛋白的方法, 纳米抗体的纯化方法具有纯化蛋白纯度高的特点, 因此, 基于纳米抗体的纯化方法特别适用于制备高纯度蛋白. 本研究建立GFP-nanotrap纯化酵母分泌表达蛋白的方法, 获得高纯度融合蛋白RIIIJ-GFP, 为进一步研究其结构和功能奠定基础.

