P2型锰基钠离子正极材料的制备与改性
周苗苗 , 李婷婷 , 黄吉丽 , 郭乾坤 , 钟盛文
(江西理工大学,a.材料冶金化学学部;b.江西省动力电池及材料重点实验室,江西 赣州 341000)
近几年来,锂离子电池被贴上了能量密度高,循环寿命较长,性能稳定的标签[1].可是锂的资源含量在地球上相对稀少[2],同时它的价格较为昂贵,对于目前离子电动汽车[3]行业来说这是其成本稳高而不降的主要原因,大大限制了人们购买电动汽车的欲望,限制了LIBS大规模的应用[4].相对比锂源,钠源在地球上资源丰富.尤其在最近的几年中,钠离子电池的使用和发展得到突飞猛进[5].它被贴上了具有较高的能量密度,长循环寿命和性能稳定的标签[6].在众多的电池产品中得到了应用.尤其在电动车的领域有着广阔的应用前景.大多数研究者采用碳酸盐共沉淀法合成的(Mn0.75Ni0.25)CO3前驱体为Mn源、Ni源,以Li2CO3为锂源,通过高温固相法合成的0.5Li2MnO3·0.5LiMn0.5Ni0.5O2,该材料具有较高的放电比容量[6].
钠元素与锂元素在主族位置相同,周期又相邻[7].在工作原理上,钠离子电池(SIB)与锂离子电池相似,其安全性较锂高[7].在地球上,钠相对于锂的资源来说,钠的资源相对丰富,钠属于地球上的四大元素,这一点大大的降低了电动汽车的投入成本[8].所以用钠作为LIBS的替代品,完全可以让人信服[9].由于钠离子有极大的优势和潜力,其发展较为迅速.钠离子电池通过钠离子在正负极电极材料中不断进行着嵌入,脱出,完成能量的存储和释放,ARMAND团队[10]在1980年首次提出这一原理,并将其形象地描述为“摇椅式电池”[11].锂离子半径(0.059 nm),钠离子半径(0.099 nm),钠离子半径较锂离子半径大,在电极材料中的钠离子嵌入和脱嵌过程相对困难,动力学性能欠佳.钠离子正极材料有许多结构.层状氧化物NaMO2是一种十分典型的钠离子正极材料.M为一些常见的过渡金属, 例如:Fe、Mn、Co、Ti和 Cr等[12].根据堆积方式的不同也可以分为O3型和P2型.即由氧原子的六方紧密堆积在O3结构中,共边的MO6结构和 NaO6结构分别形成了 MO2和NaO2层,而后由 NaO6堆积形成了3层不同的 MO2层结构,即 AB、CA和 BC,钠离子就位于这些MO2层形成的八面体空隙中[13].钠离子占据八面体位置.P2型层状金属氧化物以 P2型Na2/3MnO2为例,首圈的可逆容量约190 mAh/g,远远高于相同化学组成其他结构的钠离子电池正极材料[14].
ORCRETTE[15]团队制备出一类新的Na-Mn-O三元正极材料Na0.44MnO2,该类材料具有较大的S形孔道结构,因此又被称为‘Tunnel’型材料[9].开始使该材料的比容量约130 mAh/g,在0.50 C下循环100次后容量保持在70%左右.
傅正文团队[16]通过固相合成法合成了四元过渡金属层状氧化物 Na(NiCoFeTi)1/4O2,该材料具有十分优异的循环性能和较好的倍率性能.
CHEN团队[17]制备了一类缺钠O3型结构层状氧化物 Na0.8Ni0.4-xCo2xTi0.6-xO2,该类材料的容量较小,但是其循环稳定性十分出色,在0.1 C倍率下循环90圈后容量保持率为95%[16].
YANG团队[18]合成了一类具有超高比容量Na(FeCrMn)1/3O2材料,可逆容量为 187.19 mAh/g;掺杂Mn和Fe等元素则有利于提高材料的导电性能;掺杂Al、Mg等元素有利于稳定P2型结构,且具有十分理想的容量性能,在1.50~4.40 V电压区间内以0.10 C循环时具有210 mAh/g的可逆容量,循环50圈后仍保持80%左右.
本实验利用的是溶胶凝胶法[19]制备正极材料Na0.46Ni0.26Mn0.54O2,同时进行Fe的掺杂,控制相同的合成条件,制备Na0.46Ni0.13Fe0.13Mn0.54O2.根据对两种正极材料结构的测试、表面形貌图的对比、系列电化学测试对比得出结论,即不掺杂铁元素的正极材料Na0.46Ni0.26Mn0.54O2的结构属于P2型结构,表面形貌较好,电化学循环及CV的测试结构都较优于Na0.46Ni0.13Fe0.13Mn0.54O2正极材料.
1 实 验
1.1 试剂与仪器
本实验所用的试剂如下:乙酸镍 Ni(CH3COO)2·4H2O,乙酸锰 Mn(CH3COO)2·4H2O,以及无水碳酸钠(Na2CO3),草酸铁 Fe2(C2O4)3·5H2O 烧杯、量筒、瓷舟、真空干燥箱等.
1.2 Na0.46Ni0.26Mn0.54O2正极材料的制备
本实验采用的溶胶凝胶法合成正极材料,按照一定的化学计量比称取定量 Ni(CH3COO)2·4H2O、乙酸锰 Mn(CH3COO)2·4H2O,以及无水碳酸钠(Na2CO3)三者在去离子水中溶解,搅拌约15 min,加速并剧烈搅拌将一定量的一水合柠檬酸水溶液滴在已经配好的溶液中,时间约2 h.在滴加过程中添加氨水并控制pH稳定在8~9,待其形成溶胶.
水浴将烧杯中的溶液蒸干后将烧杯和样品放入80℃的真空干燥箱,约24 h,待其完全干燥后,对样品进行研磨,过筛,装进小瓷舟内放入管式炉.预烧400℃,保温5 h,然后升温至900℃.保温处理14 h.待其冷却至室温后对其进行研磨过300目 (0.055 mm)的筛,所得样品即为S1:Na0.46Ni0.26Mn0.54O2.
1.3 Na0.46Ni0.13Fe0.13Mn0.54O2正极材料的制备
依旧采用的是溶胶凝胶法合成该正极材料,在上述配制溶液的基础上按照一定的化学计量比称取相应的草酸铁 Fe2(C2O4)3·5H2O,将四者溶解在去离子水中.干燥后重复上述步骤进行煅烧,得到的样品S2即:Na0.46Ni0.13Fe0.13Mn0.54O2.
1.4 材料表征
采用日本理学产MiniFlex600型X射线衍射仪对收集到的样品S1和S2的结构进行分析,样品S1和S2的形貌则使用德国ZEISS产EVO/MA10型扫描电镜进行观察表征.
1.5 电池的组装与其电化学测试
本实验中电极材料的制备,按照90∶5∶5分别称取样品S1或S2、SP、和PVDF.放入烧杯中.加入一定量的NMP作溶剂进行溶解.放入玛瑙管中,行星磨球磨10 h后浆料充分混合均匀后,涂布在铝箔上,干燥后利用裁片机裁成正极片.在手套箱中进行电池的组装.电池制备完成后搁置24 h后,室温下进行循环伏安测试(CV)及首次充放电测试,后进行循环测试.
2 结果与讨论
2.1 S1,S2样品的结构测试
使用日本理学D/Max2500的X射线衍射仪,扫描速度为5°/min,X射线源为Cu靶Kα辐射,扫描范围为 10°~80°.合成的材料 S1 即:Na0.46Ni0.26Mn0.54O2与添加了草酸铁的S2即:Na0.46Ni0.13Fe0.13Mn0.54O2进行结构的分析.XRD如图1所示.将2个样品进行XRD分析,可以看出.样品S1即:Na0.46Ni0.26Mn0.54O2的 XRD 图谱的衍射角分别为 15.7°、31.7°、35.9°、39.4°、43.4°和 48.6°,分别对应于[002]、[004]、[100]、[012]、[103]和[104]的晶格面.

图1 相同合成条件下 样品S1、S2的XRD谱Fig.1 XRD patterns of samples S1 and S2 under the same synthesis conditions
S1样品的结构与层状P2型的结构 (PDF#54-0894-Na0.67Ni0.33MnO)完全符合对应,其空间群为P63/MMC(JCPDS PDF No.194).而且衍射峰很尖锐,说明通过溶胶凝胶法制备的样品具有P2型层状材料的结晶性较好,同时在保温时增加保温的时间,可使材料的晶体更好的生长,钠离子占据在棱柱位置,充放电的时候钠离子会从三棱柱的中心开始扩散,这会使两层的原子层的间距产生变化.
样品S2:Na0.46Ni0.13Fe0.13Mn0.54O2其衍射峰不仅有偏移,同时出现了许多的杂峰,这可能的原因是材料的面间距发生了变化,而导致衍射峰的产生.也有可能是存在铁离子使负电荷的静电斥力发生变化.该样品材料并不属于P2型结构.样品S1与S2的峰强对比数据如表1所列.

表1 S1、S2样品的第一强峰(002)的峰强对比Table 1 Peak intensity comparison of the first strong peak (002) of samples S1 and S2
2.2 S1,S2样品的形貌分析
扫描电镜的工作原理是电子束轰击样品的表面,在材料的表面产生二次电子,通过对材料产生的二次电子的收集和分析从而得到SEM图片.SEM可以将物质表面微观形貌反应出来.文中所制备的样品S1、S2 的形貌如图 2 所示.图 2(a)~图 2(d)分别是样品S1、S2在不同放大倍数下获得的 SEM图.图2(a)、图2(c)为样品 S1:Na0.46Ni0.26Mn0.54O2;图 2(b)、图 2(d)为样品 S2:Na0.46Ni0.13Fe0.13Mn0.54O2,可以看出,在正极材料的制备过程中,当同一煅烧温度为900℃,保温时间为14 h,合成物质中没有草酸铁的样品S1比合成物质添加草酸铁的样品S2的形貌更好.在大倍率的形貌图中合成物质加有草酸铁的材料S2团聚较S1明显,S2材料的片状较厚,聚集在一起也形成了一些微孔、介孔.
材料S1即:Na0.46Ni0.26Mn0.54O2微观形貌较为完整,样品颗粒较均匀.颗粒比较清楚,这在制作电池过程中,有利于电解液完全进入材料当中,使电池的性能更优化.

图2 正极材料样品S1、S2的SEM像Fig.2 SEM of sample S1 and S2 of anode material
2.3 样品S1、S2的电化学性能分析
图3所示分别为样品S1与样品S2的CV曲线,测试的室温为25℃.图3(a)是具有P2结构的样品S1的CV曲线,从图3(a)中可以看出,第1、第 2次的曲线重合较好,总体来说这两次的循环曲线重合较好,这是由于S1材料的循环性能较好,主要原因也是因为该材料具有 P2型结构即 S1:Na0.46Ni0.26Mn0.54O2具有较好的循环性能,结构稳定性较优.在电压为2.25~2.5 V时,CV曲线正在扫的时候Mn3+氧化成Mn4+,负扫时又将Mn4+还原成Mn3+;图 3(b)为样品 S2:Na0.46Ni0.13Fe0.13Mn0.54O2,第 1 次和第 2次的循环曲线不重合,说明首次存在了不可逆容量,存在了SEI膜,在3.0~4.0 V区间峰的面积较图3(a)材料S1,CV的面积有所减小,说明可能是添加了铁元素的S2材料并没有改善材料的稳定性.相反是使材料的电化学性能受到了影响.
样品S1、S2以25 mA/g的电流密度在 2.0~4.5 V的电压区间循环的交流阻抗图谱如图4所示,从图4中可以看出,电池的阻抗由高频部分和低频部分组成.高频部分对应的是半圆,低频部分则是由直线部分组成,随着循环进行,电池的电荷转移更多,从而使阻抗增加.S1的阻抗为300 Ω左右,而S2的阻抗约为700 Ω,所以,相比较,添加了草酸铁的材料阻抗较大,阻抗过大,电池的电化学性能不好.

图3 样品S1与样品S2的CV曲线Fig.3 CV curves of sample S1 and sample S2

图4 样品S1与样品S2的阻抗曲线Fig.4 Impedance curves of sample S1 and sample S2
图5所示为样品S1、S2的首次充放电实验测试.测量温度为室温25℃、电压的测试范围在1.5~4.2 V、电流为 0.1 C(1 C=180 mA/g),样品 S1所做扣电的首次充电电压为162.88 mAh/g,样品S2所做的扣式电池的首次放电比为124.6 mAh/g;可以看出,在前驱体的制备过程中,添加了Fe离子,不仅材料的结构发生了变化,不再是P2型层状结构、同时颗粒表面形貌也发生了变化.结构和形貌的改变均会使该材料制备电池的电化学的性能受到很大的影响.

图5 样品S1、S2的首次充放电性能Fig.5 First charge and discharge performance of sample S1 and S2
图6所示为样品S1与S2在0.1 C下的50次的循环测试图.从图6中可以看出样品S1的可逆容量较高,首次可逆比容量达到200 mAh/g左右,充放电效率为92%.随着循环次数的增加,该材料的放电比容量有微微的上升后开始下降.在循环50次后还有约180 mAh/g.充放电效率为85%.具有P2型结构的材料,Na0.46Ni0.26Mn0.54O2具有较好的循环性能,首次放电容量最大,容量下降趋势很快,循环稳定性还有待提高.在大电流的充放电下其性能有待提升.而样品S2即:Na0.46Ni0.13Fe0.13Mn0.54O2的首次可逆容量较低,只有约100 mAh/g,充放电效率为93%.在循环50次后还有约87 mAh/g,充放电效率为92.45%.初步来看其循环效率保持的比较好,但是该材料放电容量太低,今后需要进行研究,使其性能得到提升.
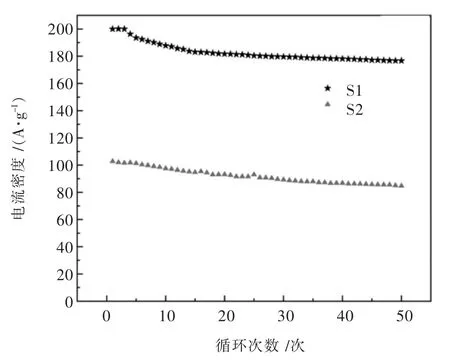
图6 0.1C下S1、S2的50次的循环测试图Fig.6 Test diagram of S1 and S2 for 50 cycles under 0.1 C
3 结 论
1)溶胶凝胶法合成材料Na0.46Ni0.26Mn0.54O2的合成温度为900℃,保温时间为14 h,所得材料具有六方层状P2型结构.
2)通过胶凝胶法合成材料Na0.46Ni0.26Mn0.54O2和材料 Na0.46Ni0.13Fe0.13Mn0.54O2.添加草酸铁的Na0.46Ni0.13Fe0.13Mn0.54O2的结构不属于六方层状P2型结构.
3)制备Na0.46Ni0.26Mn0.54O2材料的结构是六方层状P2型结构,SEM观察该材料,这种材料的颗粒为片状层状结构.该材料的表面还相对光滑,在制作电池的过程中,有利于电解液的进入.
4)Na0.46Ni0.26Mn0.54O2材料的首次可逆比容量达到200 mAh/g.循环50次后,其循环效率为85%.放电曲线光滑,阻抗较小,放电比容量很高.

