多壁碳纳米管/TiO2复合材料的合成及其光催化性能
杜瑞安, 马小帅, 张萌迪, 陈范云, 余长林
(江西理工大学材料冶金化学学部,江西 赣州 341000)
在过去的几十年中,二氧化钛由于其优异的物理和化学稳定性、低成本、无毒性而备受关注[1-3],特别是在新能源材料领域得到了广泛应用[4,5].例如能量转换[6]、能量储存[7]、有机污染物光降解[8,9]等.然而,低劣的电导率、快的电子空穴复合速率和有限的光响应严重阻碍了其在实际应用中的性能[10].为了提高TiO2的光催化性能,科研人员开发了多种方法,包括半导体异质节[11]、表面改性[12]、贵金属负载[13]、过渡金属离子负载[14]等,都可以较好地解决TiO2的缺点.
具有良好导电性的碳材料如碳纳米管、石墨烯等作为复合材料已经有过不少报道[15,16].碳纳米管的引入可以带来一定的潜在优势.第1,碳纳米管的高导电性可以提供电子的电子通道,从而增加电子湮灭长度,防止电子-空穴对的复合[17].第2,由于碳纳米管中sp2共轭双键和独特的二维结构使得其拥有了独特的电子特性,其中大π键上2pz方向电子垂直于界面,类似石墨烯的网络结构[18].第3,在TiO2晶格中引入杂质能级,可以拓宽TiO2可见光吸收范围,加速光生电子-空穴对的分离效率,从而提高TiO2的光催化活性[19].由于碳纳米管/TiO2复合材料独特的光学和电化学性质,对电子捐赠或接受较为敏感[20],使得其可用于环境治理等应用.为了提高碳纳米管/TiO2复合材料在实际应用中的价值,可以通过各种改性方法,来提高光催化活性.例如,福州大学的徐艺军团队[21]采用简单浸渍法制备了碳纳米管/TiO2纳米复合光催化剂,首次应用于苯的气相降解,并取得良好效果.李洋等[22]通过改善碳纳米管的电子导电性和增强碳纳米管与TiO2的界面接触的方法,合理地制备了高活性的碳纳米管/TiO2纳米复合材料,并成功将其运用于染料敏化电池上.张毅等[23]将多壁碳纳米管作为原料,经过表面预处理使碳纳米管表面氧化成膜,然后利用原子沉积法,将纳米二氧化钛沉积在碳纳米管上面,并探究了二氧化钛的成核机理.此外,Radek Zouzelka等[24]将碳纳米管/TiO2复合材料制备成多孔功能薄膜,并对降解的4-氯酚水溶液进行了光催化性能测试的实验研究,实验表明,当0.6%的碳纳米管负载TiO2光催化剂后,对4-氯酚的降解效果达到96%,远高于P25.
通过简单溶胶-凝胶法一步合成了碳纳米管/TiO2纳米复合光催化剂,详细考察了碳纳米管负载的量对纳米TiO2光催化活性的影响,同时也对其结构和形貌及光催化机理进行了分析探究.
1 实验部分
1.1试 剂
实验所用药品均为分析纯,使用前没有经过进一步纯化:钛酸异丙酯(AR,山东省鲁科化工有限责任公司)、无水乙醇(AR,西陇化工股份有限公司)、高纯羟基化多壁碳纳米管,质量分数>95%,长度50~100 nm(北京博宇高科新材料技术有限公司)、亚甲基蓝(AR,上海展云化工有限公司)、无水硫酸钠(AR,武汉强松精细化学品有限公司).
1.2 催化剂的制备
1.2.1 纳米TiO2的合成
实验采用溶胶-凝胶法合成纳米TiO2,具体步骤如下:量取17 mL的无水乙醇于烧杯中,加入50 μL的钛酸异丙酯(TTIP),剧烈搅拌1 h后,每隔5 min滴加300 μL去离子水,滴加10次共50 min(少量多次加入去离子水可以使TTIP缓慢水解).打开加热开关,在80°C条件下持续搅拌,直至溶液呈现凝胶状态.将产品洗涤过滤置于100°C干燥12 h,研磨后的产品即为白色纳米TiO2粉末.为了增强其结晶性能,将样品放入马弗炉400°C空气中煅烧4 h.
1.2.2 碳纳米管/TiO2复合材料的合成
用同样的方法合成碳纳米管/TiO2复合材料,具体步骤如下:量取17 mL的无水乙醇于5个烧杯中,分别加入 0.5 mg、1 mg、1.5 mg、2 mg 、4 mg (对应复合材料中的含量为0.5%、1%、1.5%、2%、4%,质量百分数)的多壁碳纳米管,超声分散1 h,待碳纳米管分散均匀,加入 50 μL的钛酸异丙酯(TTIP),剧烈搅拌1 h后,每隔5 min滴加300 μL去离子水,滴加10次共50 min.打开加热开关,在80°C条件下持续搅拌,直至溶液呈现凝胶状态.将产品洗涤过滤置于100°C干燥12 h,研磨后的产品即为灰色碳纳米管/TiO2复合材料.为了增强其结晶性能,将样品放入马弗炉400°C空气中煅烧4 h.
1.3 催化剂的表征
所制备样品采用扫描电镜(FEI Model MLA650F)进行形貌观测分析,傅立叶变换红外光谱采用型号为NICOLET-470的红外光谱仪在4000~450 cm-1频率范围进行分析,分辨率为4 cm-1.通过X射线衍射仪(Bruker D8-Advance)使用单色 Cu Kα 辐射(0.15418 nm)进行X射线衍射分析.催化剂的比表面积采用美国Micromeritics公司生产的ASAP2010物理吸附分析仪测得,结合BET方程计算催化剂的比表面积.拉曼光谱采用英国雷尼绍公司in Via型激光拉曼进行测试分析,紫外可见漫反射光谱采用紫外-可见漫反射(PerkinElmer Lambda 950)测试分析,所有样品的紫外可见吸收光谱在UV-2550型紫外可见分光光度计上测得.光电流测试采用CHI660D电化学工作站进行分析,以铂电极、标准甘汞电极和样品作为对电极、参考电极和工作电极.以0.1 mol/L硫酸钠溶液为电解液.工作电极的制备是将0.01 g催化剂分散到0.4 mL无水乙醇中,超声分散30 min,然后取20 μL悬浮液滴在FTO玻璃上作工作电极.可见光光源采用光强约为 100 mW/cm2的 500 W 氙灯(PLS-SXE300)来测试样品光电流.
1.4 光催化性能测试
以亚甲基蓝作为光催化降解对象,考察所制备光催化剂的催化活性.在活性测试中,将一定浓度的亚甲基蓝溶液(2.7×10-5mol/L,25 mL)和少量光催化剂(TiO2和碳纳米管/TiO2复合材料,15 mg)共同置于30 mL的石英烧杯中,在剧烈搅拌下,将光反应容器暴露于由12 W紫外灯产生的紫外光中(主波峰位于365 nm处,紫外灯位于容器30 cm处).反应开始前,将光反应容器在黑暗条件下保持40 min,整个光催化过程中,不存在其他光源的照射.使用紫外-可见分光光度计每隔20 min取样分析光催化剂的光降解活性.在光降解过程中,分散液的pH值保持在7,温度保持在20°C左右.
2 结果与讨论
2.1 XRD和比表面积分析
通过XRD分析技术来分析样品的晶相和结晶度.图1所示为不同负载量的碳纳米管/TiO2复合材料的 XRD图,从图 1中可以观察到,在 2θ=25.32°、37.87°、48.12°、53.94°、55.10°和 62.77°处的特征峰,分别对应于锐钛矿型 TiO2(JCPDS:01-073-1764)的(101)、(004)、(200)、(105)、(211)和(204)晶面[6],在图1中未出现杂质衍射峰,表明溶胶凝胶法制备的锐钛矿型TiO2纯度较高.当负载不同比例的碳纳米管后,随着负载比例的增大,复合材料在25.32°处的峰强度减弱,说明碳纳米管的引入能降低样品的结晶度.所制备样品的BET比表面积如表1所列.随着碳纳米管负载量的增大,复合材料的晶粒尺寸和比表面积逐渐增大,当负载量为2%时,样品比表面积达到最大值,继续增加碳纳米管负载量到4%,样品的比表面积稍微减少,这说明适量碳纳米管的存在有利于提高复合材料的比表面积,而当碳纳米管超过一定量后,容易破坏二氧化钛原本的形貌和孔隙结构,使得复合材料的孔径减小.
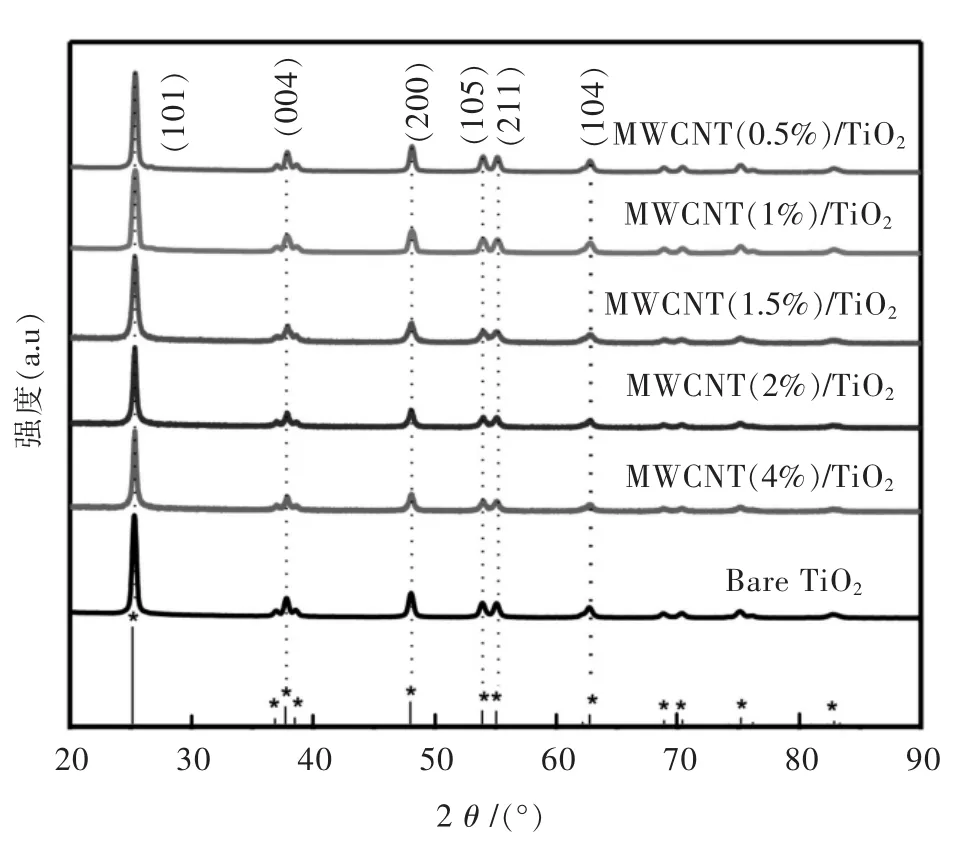
图1 不同比例碳纳米管负载的TiO2样品的XRD谱Fig.1 XRD patterns of TiO2,MWCNT(4%)/TiO2,MWCNT(2%)/TiO2,MWCNT(1.5%)/TiO2,MWCNT(1%)/TiO2,MWCNT(0.5%)/TiO2samples

表1 样品的比表面积Table 1 Specific surface areas of the prepared samples
2.2 形貌分析

图2 纳米TiO2和多壁碳纳米管的扫描电镜图像Fig.2 The SEM images of TiO2and MWCNT
通过扫描电镜分析制备样品的形貌.图2(a)所示为采用溶胶-凝胶法合成的TiO2的扫描电镜图(图2(a)和图2(b)中D值分别表示颗粒粒径和碳管直径长度).从图2(a)中分析得,溶胶-凝胶法制备的TiO2粒子颗粒大小均匀的纳米球,颗粒粒径为200~300 nm.图2(b)为多壁碳纳米管的扫描电镜图,可以清晰观察到,大量管状结构的碳纳米管相互交织在一起,构建出良好的三维导电网络框架,TiO2在碳纳米管(直径约50~100 nm)上生长可以有效增大复合材料的比表面积,为光催化反应提供大量的光催化活性位点,从而有效提高光催化性能[25,26].

图3 不同含量碳纳米管负载的TiO2样品SEM像Fig.3 The SEM images of samples:MWCNT(4%)/TiO2(a),MWCNT(2%)/TiO2(b),MWCNT(1%)/TiO2(c),MWCNT(0.5%)/TiO2(d)
图3所示为不同含量碳纳米管负载的TiO2样品SEM图.TiO2在碳纳米管上成核生长,使得2种材料构建出紧密的界面接触关系,有利于将光激发产生的光生电子转移到碳纳米管上,实现光生电子和空穴的快速分离.图3(a)为多壁碳纳米管负载量为4%的复合材料,从图3(a)中我们可以清楚地看到碳纳米管和二氧化钛紧密地生长在一起,并且引入碳纳米管后TiO2的形貌未发生改变,TiO2纳米球的颗粒粒径约为300 nm.对碳纳米管的横截面宽度测量后发现,复合材料中碳管比多壁碳纳米管更粗,这是由于部分TiO2纳米颗粒在碳纳米管上成核、生长并包裹所致.图3(b)~图 3(d)分别为碳纳米管负载的量为 2%、1%、0.5%的复合材料,从图3中可以观察到,当减少碳纳米管负载的量后,复合材料中管状结构明显减少,TiO2更加容易发生团聚导致比表面积的减小,这说明负载适量的碳纳米管可以提高TiO2的分散度和比表面积.
2.3 表面特性
利用傅里叶红外光谱可以对碳纳米管/TiO2复合材料进行分子结构的鉴定.图4所示为不同含量碳纳米管负载TiO2的傅里叶红外光谱图,对于TiO2,550 cm-1附近的吸收带属于TiO2的Ti-O-Ti键和Ti-O键的伸缩振动峰.在1630 cm-1处存在的一个小的吸收峰,是TiO2表面的O-H键弯曲振动引起.在3500 cm-1附近的吸收带是由于样品表面吸附的水分子中-OH基团振动引起,我们将其称之为“水峰”[27].对于负载不同比例碳纳米管的复合材料,在550 cm-1附近也存在Ti-O-Ti键和Ti-O键的伸缩振动峰,在1630 cm-1处附近存在的一个小吸收峰,同属于TiO2表面O-H弯曲振动峰[28].此外,负载碳纳米管后,在1400 cm-1处的振动峰增强,是由C-O键的伸缩振动所引起,纯TiO2并中不存在C-O键,这说明碳纳米管与二氧化钛以化学键的形式相连接,再次验证了SEM中碳纳米管与二氧化钛构建了紧密的界面接触关系.
图5所示为样品的拉曼光谱图,如图5(a)所示,在 144 cm-1、195 cm-1、394 cm-1、513 cm-1和 637 cm-1处的振动峰,分别从属于锐钛矿型TiO2的Eg(144)、Eg(198)、B1g(398)、A1g(515)和 Eg(640)的特征峰[29],拉曼表征证明本实验合成的TiO2基复合材料均为锐钛矿型TiO2.图5(b)中可以观察到除TiO2外所有样品在 1310 cm-1、1595 cm-1和 2612 cm-1处均具有吸收峰,其中在1310 cm-1处的吸收峰为碳纳米管的D带,是sp3杂化碳原子结构中C-C键扭曲振动引起的,表现为碳纳米管的结构缺陷;在1595 cm-1处的吸收峰为碳纳米管的G带,是sp2杂化碳原子结构中的C-C键振动引起,D带与G带的峰强比值表示碳纳米管微观结构的石墨化程度[30],随着碳纳米管质量分数的增大,样品的石墨化程度越高.在负载多壁碳纳米管后,在144 cm-1处的Ti-O键振动峰发生不同程度的偏移,根据拉曼位移和键长之间的关系[31]:ν=21349×exp(-0.19176RM-O)(其中 ν 为拉曼振动频率,单位为cm-1;R为金属原子和氧原子之间的M-O键长,单位为nm),得到负载多壁碳纳米管后各样品的Ti-O键长度变化如表2所列.通过计算可知,负载多壁碳纳米管后,Ti-O键的键长缩短,表明碳纳米管与二氧化钛构建出紧密的界面接触关系,有利于光生电子沿Ti-O键向碳纳米管迁移,进一步验证了SEM和FT-IR中的分析.

图4 不同比例碳纳米管负载(4%、2%、1.5%、1%、0.5%)的TiO2样品的FT-IR光谱图Fig.4 FT-IR spectra of TiO2,MWCNT(4%)/TiO2,MWCNT(2%)/TiO2,MWCNT(1.5%)/TiO2,MWCNT(1%)/TiO2,MWCNT(0.5%)/TiO2samples

图5 不同样品的拉曼光谱Fig.5 Raman spectra of the samples:(a) 0~1000 cm-1;(b) 1000~3000 cm-1

表2 样品的Ti-O键的键长Table 2 Ti-O bond length of samples
2.4 光吸收性能分析
图6(a)为TiO2及碳纳米管/TiO2样品的UV-vis DRS图.可以看出TiO2最大吸收波长为400 nm且对紫外光区域拥有强吸收.当负载碳纳米管后,样品的最大吸收边发生红移并极大地增强了可见光的吸收,随着碳纳米管负载比例的提高,碳纳米管/TiO2复合材料对可见光的吸收先增强再减弱,MWCNT(2%)/TiO2达到最强的可见光吸收.图 6(b)为样品的间接带隙图,当负载碳纳米管后,复合材料的带隙宽度会减小,且MWCNT(2%)/TiO2具有最小的光学带隙(见表 3).
2.5 电化学测试
运用电化学测试可以评价光催化剂的光电转换效率和电荷转移性能,从而揭示光生电荷和空穴在光催化剂上的动态特性.其中,较强的光电流强度说明催化剂具有优异的光吸收能力,而较小的交流阻抗表明催化剂表面光生电子-空穴对拥有更高的分离效率.由图7(a)所示,负载碳纳米管后,样品的光电流强度增大,表明样品的可见光响应能力和吸收能力得到提升,这与DRS分析结果相一致.随着碳纳米管负载比例的提高光电流强度也随之增强,且MWCNT(2.0%)/TiO2的光电流强度(4.46 mA/cm2)最强,为 TiO2的光电流(0.96 mA/cm2)强度的 4.64 倍.图 7(b)表明,负载碳纳米管后,较小的EIS圆弧反映了光生电子和空穴在工作电极和反应介质之间具有较小的界面阻力,表现出更高的光生电子和空穴的分离效率和转移效率.碳纳米管负载量越大,圆弧半径越小,说明碳纳米管负载TiO2后能有效提高光生电子和空穴的分离效率,有利于提高光催化性能.

图6 制备样品的UV-vis DRS及样品的间接带隙Fig.6 The UV-vis DRS of prepared sample;The indirect band gap of prepared sample

表3 制备样品的间接带隙Table 3 The indirect band gaps for preparing samples

图7 样品的光电化学测量Fig.7 Photoelectrochemical measurements of samples:(a) Transient photocurrent response of synthesized samples;(b) EIS Nynquist plots of prepared samples;(c) Bode-phase of the obtained samples;(d) Mott-Schottky plots the obtained samples
运用伯德相图揭示光生电子的寿命,由图7(c)表明,随着碳纳米管负载量提高,样品的中频半圆峰值(fmax)往低频率迁移,电子寿命(τ)增加,光生电子迁移加快.根据中频半圆峰值与电子寿命之间的关系τ=1/(2πfmax)[32].计算得到样品的电子寿命(τ)如表 4所列.其中 MWCNT(2%)/TiO2的电子寿命(0.52 μs)最长,为 TiO2电子寿命(0.34 μs) 的 1.52 倍,较长的电子寿命使得光生电子与溶液中的分子氧有较长的反应时间,生成大量的超氧自由基(·O2-),参与光催化降解有机污染物.图 7(d)表明,MWCNT(2%)/TiO2和TiO2的切线斜率均为正,表明所制备样品均为n型半导体.MWCNT(2%)/TiO2的平带电位比TiO2的平带电位更负,说明碳纳米管负载后,能有效分离光激发TiO2产生的光生电子,使光生电子大量聚集在碳纳米管上导致MWCNT(2%)/TiO2的平带电位更负,这与Raman分析中Ti-O的键长缩短有利于光生电子的分离的结论一致.

表4 样品的电子寿命Table 4 The electronic lifetimes(τ) of the synthesized samples
2.6 光催化性能测试
各样品的光催化性能通过在紫外光下降解亚甲基蓝来评价.图8(a)为样品在紫外光的照射下亚甲基蓝溶液浓度(Ct/C0)与光照时间t的变化曲线.其中暗反应说明亚甲基蓝溶液在没有光照的情况下相对稳定.当光照100 min后,负载2%碳纳米管的复合材料光催化活性最高,对亚甲基蓝的降解率达90.6%.含量为 0%、0.5%、1.0%、1.5%、2%和4%碳纳米管负载量的复合材料对亚甲基蓝的降解率分别为47.8%、63.7%、72.5%、88.1%、90.6%和 81.3%.如图 8(b)所示,随着碳纳米管负载量的提高,碳纳米管/TiO2复合材料对亚甲基蓝降解率与负载量呈线性关系,这表明适当的碳纳米管负载的TiO2可以提高原TiO2的光催化活性,且MWCNT(2%)/TiO2具有较优的光催化性能、最强的可见光吸收能力,最强的光电流响应和最长的光生电子寿命.
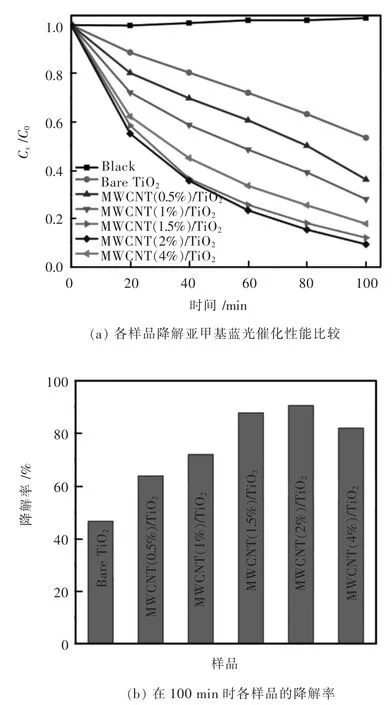
图8 光催化活性测试Fig.8 (a) Comparisons of the photocatalytic degradation of methyl blue of the different photocatalysts;(b) The histogram of the degradation rate of different photocatalysts at 100 min
2.7 光催化机理分析
纳米TiO2及其复合材料广泛应用于光电催化、电池、生物等研究领域,为了使其在材料应用中得到更好的发展,对其光催化性能机理进行研究.众所周知,TiO2属于宽带系半导体,只能吸收占太阳光4%的紫外光[33].当纳米TiO2在光照条件下,能产生光生电子和空穴,但产生的光生电子和空穴极易发生复合,两个缺陷极大地制约了TiO2的进一步应用.如图9所示,当碳纳米管负载TiO2后,TiO2表面产生的光生电子能快速转移到碳纳米管上,有效地抑制光生电子-空穴对的复合,光生电子和空穴分别与溶解氧和水发生反应生成大量活性自由基,提高材料的光催化活性[34].羟基化的碳纳米管表面拥有大量含氧基团,可以为TiO2纳米粒子的原位生长提供了大量成核位点,使得石墨烯和TiO2纳米颗粒可以有效地进行化学键相连.纳米TiO2作为光催化剂降解有机物时的具体反应历程如式(1)~式(4):光激发半导体产生光生电子(e-)和空穴(h+),光生电子转移到碳纳米管使溶液中的分子氧发生反应生成超氧自由基(·O2-),留在价带上的空穴则与H2O发生反应生成羟基自由基(·OH),在 h+、·O2-、·OH 的强氧化还原作用下将亚甲基蓝分解成CO2和H2O.
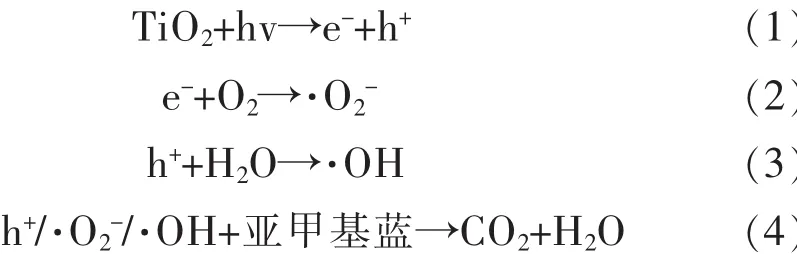
3 结 论
光催化剂通过转化太阳能来降解有机污染物,减少了能源的消耗.TiO2作为光催化剂为应用最广泛的商业化催化剂,研究其性质和特征可以使其得到更广泛的应用.本文采用溶胶-凝胶法合成了碳纳米管/TiO2复合光催化剂,有效提高了碳纳米管/TiO2催化剂的光催化活性,具体结论如下:
1)使用简单的溶胶-凝胶法成功制备出TiO2和碳纳米管/TiO2复合光催化剂.
2)借助 X 射线粉末衍射(XRD)、比表面积(SEM)、扫描电子显微镜(SEM)、傅里叶红外光谱分析(FTIR)、激光拉曼(Raman)等表征测试来对碳纳米管/TiO2复合材料进行形貌结构分析.并成功构建出二者的界面接触,使得Ti-O键的键长缩短,有利于光生电子-空穴对的分离.
3)紫外可见漫反射(UV-vis DRS)和电化学测试结果表明:碳纳米管负载TiO2可以有效地增强TiO2的可见光响应和光吸收能力,具体表现为:MWCNT(2.0%)/TiO2光电流强度(4.46 mA/cm2)为 TiO2光电流(0.96 mA/cm2)强度的 4.64 倍,MWCNT(2%)/TiO2的电子寿命(0.52 μs)为 TiO2电子寿命(0.34 μs) 的1.52倍.
4)负载碳纳米管后,样品的比表面积的增大,光生电子寿命增长,光催化性能显著提高,MWCNT(2.0%)/TiO2具有较优的光催化效果,100 min内对亚甲基蓝的降解率达到90.6%.

