成年大鼠心室和窦房结细胞急性分离方法和动作电位比较
范 茁
成年大鼠心室和窦房结细胞急性分离方法和动作电位比较
范 茁
(华南理工大学 生物科学与工程学院,广东 广州 510006)
介绍了急性分离成年大鼠心室肌细胞和窦房结细胞的方法。通过全细胞膜片钳实验技术分别检测了窦房结细胞的自发动作电位和心室肌细胞的诱发动作电位,比较了二者动作电位波形在形态上的差异,并通过计算比较了心室肌细胞和窦房结细胞动作电位时程和静息电位水平,分析了二者电生理特性差异形成的原因。
心室肌细胞;窦房结细胞;动作电位;动作电位时程;静息电位
心脏是人及动物重要的供血器官,它靠有规律的博动向周围器官和组织运输新鲜血液,供应氧气和各种养分,使其维持正常的代谢功能[1]。心脏规律性搏动的本质是动作电位的产生和传导引起的心肌细胞的扩布性舒缩[2-3]。窦房结(sinoatrial node,SAN)位于上腔静脉和右心房交界处的界沟上端,其作为心脏的起搏点,控制心脏正常的节律性活动,窦房结的起搏细胞(P细胞)产生自发兴奋性动作电位,并将冲动传至新房肌细胞、房室结,进而由房室束传至心室肌细胞,引起心室收缩[4-6]。在细胞水平研究心脏生理及病理条件下的功能、信号转导机制及药物作用机制在基础研究和临床应用领域都有很重要的作用。酶解法是获得成年大鼠心肌细胞的主要方法[7-9],膜片钳实验方法则是研究心肌细胞电生理的主要技术手段[10-12]。
本文介绍成年大鼠心室肌细胞和窦房结细胞的急性酶解分离方法,通过膜片钳技术手段记录二者的动作电位波形,并对二者动作电位形态、时程、静息电位等参数进行分析和比较。
1 溶液配置
(1)台式液(Tyrode, in mM):NaCl(120), KCl(5.4), HEPES(25), MgCl2(0.5), NaH2PO4(0.33), Taurine(10), Glucose(20). 室温调节PH值至7.2。
(2)KB液(in mM):KOH(80), KCl(40), NaH2PO4(25), MgSO4(3), L-glutanic acid(50), Taurine(20), EGTA(1), HEPES(10), Glucose(10). 室温调节PH值至7.2。
(3)电生理实验内液(in mM):KCl (130), NaCl (10), MgCl2.6H2O(5), HEPES(10), EGTA(0.5), Mg- ATP(5). 室温调节pH值至7.2。
(4)电生理实验外液(HBSS, Sigma; in mM): CaCl2(1.3), MgSO4(0.8), KCl(5.4), KH2PO4(0.4), NaCl(136.9), Na2HPO4(0.3), D-glucose(10) and NaHCO3(4.2). 室温调节pH值至7.2。
2 实验方法
2.1 成年大鼠心室肌细胞和窦房结细胞的急性分离
2.1.1 成年大鼠心室肌细胞的急性分离
成年SD大鼠(250 g左右,雌雄不限)经腹腔注射戊巴比妥钠(45 mg/kg)、肝素(250 U/kg)后,用75%的酒精消毒胸部皮肤,剪开胸腔并迅速取下心脏,放入预冷无钙台式液中,轻轻挤压出血液,然后将心脏主动脉插于langendorff灌注装置上,用动脉夹固定位置,并用缝合线扎紧主动脉。按以下步骤对心肌细胞进行酶解分离(灌流液温度控制在37 ℃):首先用无钙台式液灌流冲洗3~5 min,同时用镊子轻轻挤压心脏排出血液,至流出液变澄清;改用充氧的酶I(Tyrode + 0.8 g/L II胶原酶+1.0 g/L牛血清白蛋白+50 μM CaCl2)灌流消化2 min;然后用含蛋白酶的酶II灌流消化(Tyrode + 0.8 g/L II型胶原酶 + 0.1 g/L蛋白酶 + 1.0 g/L牛血清白蛋白,200 μM CaCl2),弃掉前2 min流出液;然后循环灌流消化,待心脏软塌时剪下心室,并在酶III(Tyrode + 0.8 g/L II型胶原酶 + 1.0 g/L牛血清白蛋白 + 600 μM CaCl2)中剪碎,振荡消化 3 min,200目金属网筛过滤后于500 r/min离心1 min,弃上清;然后将细胞悬浮于含1 mmol/L钙离子的台式液中(Tyrode + 1.0 g/L牛血清白蛋白 + 1 mmol/L CaCl2),静置10 min,弃去上清,用M199培养基混匀细胞,置于培养箱备用。
2.1.2 成年大鼠窦房结细胞的急性分离
按分离心室肌细胞同样的方法,将成年大鼠麻醉、消毒并取出心脏,然后在35 ℃含肝素(10 U/mL)的台式液中进一步分离出窦房结组织;之后将窦房结组织在含II型胶原酶(0.8 g/L)、蛋白酶(0.1 g/L)和弹性蛋白酶(0.1 g/L)的台式液中消化分离25~30 min;消化完后将窦房结组织转入35 ℃ KB液中,用玻璃吸管轻轻吹打分离细胞;梯度复钙后放入培养箱待用。
2.2 电生理实验
电生理动作电位记录采用膜片钳全细胞记录模式,信号放大器为HEKA系统EPC-9,采集软件为PatchMaster,采样频率为10 kHz和滤过频率为2.9 kHz。心室肌细胞动作电位需要由幅度为800 pA、时长为 5 ms的脉冲电流诱发,窦房结细胞则为自发动作电位,无需脉冲电流诱发。动作电位时长用APD50表示,即动作电位幅度复极一半时的时长。
数据分析统计使用的软件为Origin 8.0,统计方法采用单因素方差分析,统计结果采用Mean + SEM的方式表示。< 0.01表示具有极显著性差异,用**表示。
3 结果和讨论
3.1 心室肌细胞和窦房结细胞形态学观察
图1是急性分离的大鼠心室肌细胞和窦房结细胞在倒置显微镜下观察的图像,左边为心室肌细胞,右边为窦房结细胞。由图1可见,心室肌细胞和窦房结细胞在形态上有明显差异,心室肌细胞呈长杆状,轮廓清晰,细胞表面条纹清晰可见;窦房结细胞则呈梭形,两头尖细中间较圆,且无明显横条纹。

图1 急性分离的心室肌细胞(Ventricular)和窦房结细胞(SAN)
3.2 心室肌细胞和窦房结细胞动作电位比较
采用膜片钳电流钳模式分别记录了心室肌细胞和窦房结细胞的动作电位,结果见图2。图2(a)为心室肌细胞动作电位,由800 pA、5 ms脉冲电流诱发,在动作电位上升初期能看到刺激伪迹(stimulus artifact,SA),图2(b)为窦房结细胞自发动作电位,为一长串自发动作电位图形中截取的单个动作电位波形。二者在形态上存在如下差异:
(1)心室肌细胞受电流刺激后,动作电位迅速上升,很短时间达到峰值,而窦房结细胞自发动作电位上升缓慢,二者上升速率分别为(3.99 ± 0.81)V/s和(0.20 ± 0.01)V/s,差异显著(<0.01);
(2)复极化过程心室肌细胞有明显的平台期,窦房结细胞则没有明显平台期,窦房结细胞复极化过程相对心室肌细胞较快;
(3)心室肌细胞在刺激之前及复极化后能长时间保持静息化水平,窦房结细胞复极后迅速进入下一个自发动作电位过程(图2(c))。
心室肌细胞和窦房结细胞的动作电位时程和静息电位值比较见图3。心室肌细胞动作电位时程比窦房结细胞长,二者APD50值分别为(298.91±41.96)ms和(171.75±3.78)ms,有显著性差异(<0.01)。心室肌细胞静息电位水平相对窦房结细胞较低,二者分别为(-66.83 ± 2.38)mV和(-51.06 ± 1.31)mV,存在显著差异(<0.01)。
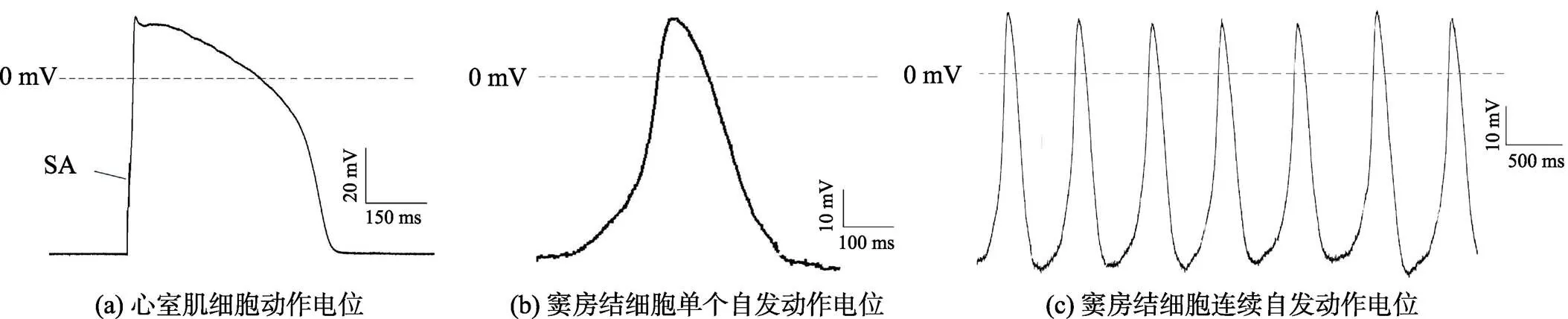
图2 心室肌细胞和窦房结细胞动作电位比较

图3 心室肌细胞和窦房结细胞动作电位时程和静息电位比较
4 结论
本文检测表明:心室肌细胞和窦房结细胞在形态上存在明显差异,心室肌细胞呈现长杆形状,而窦房结细胞则呈梭形;心室肌细胞表面有明显横纹,窦房结细胞表面光滑,无明显条纹。二者电生理特性也存在显著差异,表现在窦房结细胞有连续自发动作电位,心室肌细胞动作电位则需要脉冲电流刺激诱发;心室肌细胞动作电位时程较长,且有明显平台期,窦房结细胞动作电位时程较短,无明显平台期。此外,和窦房结细胞相比,心室肌细胞静息电位水平较低。心室肌细胞和窦房结细胞分离方法及电生理特性的差异与二者在结构上所处位置、大小、及心脏起搏过程扮演的角色不同有重要关系[13-14]。窦房结是心脏正常节律性活动的起搏点,其节律性活动通过房室结、房室束等组织最后传至心室,决定了窦房结细胞有自发连续动作电位,电位上升速率较慢,且静息时间较短等特点。
[1] 杜友爱,李红芳,苏莉芬.生理学[M]. 2版.北京:人民卫生出版社,2007.
[2] 沈建新,韩太真,程和平.心肌细胞兴奋-收缩偶联的微观机制[J]. 生理科学进展,2004, 35(4): 294–298.
[3] 周瑾. 心脏兴奋收缩偶联[J].中国分子心脏病学杂志,2002, 2(1): 55–56.
[4] HATEM S N, COULOMBE A, BALSE E. Specificities of atrial electrophysiology: Clues toa better understanding of cardiac function and the mechanismsof arrhythmias[J]. J Mol Cell Cardiol, 2010, 48(1): 90–95.
[5] TEN EICK R E, WHALLEY D W, RASMUSSEN H H. Connections: heart disease, cellular electrophysiology, and ion channels [J]. FASEB J, 1992, 6(8): 2568–2580.
[6] RAVENS U, WETTWER E, OHLER A, et al. Electrophysiology of ion channels of the heart[J].Fundam Clin Pharmacol, 1996, 10(4): 321–328.
[7] EGOROVA M V, AFANAS'EV S A, POPOV S V. A simple method for isolation of cardiomyocytes from adult rat heart [J]. Bull ExpBiol Med, 2005, 140(3): 370–373.
[8] 熊寿贵,余更生.成年大鼠心肌细胞的急性分离方法探讨[J].重庆医科大学学报,2008, 33(7): 864–867.
[9] 韦丽兰,莫书荣.成年大鼠心肌细胞的急性分离方法[J].中国组织工程研究,2012, 16(11): 1969–1972.
[10] MOLLEMAN A. Patch Clamping: An Introductory Guide To Patch Clamp Electrophysiology [M]. Hoboken, NJ: Wiley, 2002.
[11] BROWN A P, GREENBERG H Z. Patch clamp[J]. Br J Hosp Med (Lond), 2016, 77(5): C74–C77.
[12] 李妙龄,曾晓荣.膜片钳技术在心血管及药理学研究中的应用 [J].中国心血管病研究,2007, 5(9): 698–700.
[13] KALYANASUNDARAM A, LI N, HANSEN B J, et al. Canine and human sinoatrial node: differences and similarities in the structure, function, molecular profiles, and arrhythmia[J]. J Vet Cardiol, 2018, S1760–2734(18): 30099–30107.
[14] AMBESH P, KAPOOR A. Biological pacemakers: Concepts and techniques[J]. Natl Med J India, 2017, 30(6): 324–326.
Acute isolation of ventricular and sinoatrial node cells and comparison of action potential in adult rats
FAN Zhuo
(School of Bioscience and Bioengineering, South China University of Technology, Guangzhou 510006, China)
The method of acute isolation of ventricular myocytes and sinoatrial node cells from adult rats is introduced. The spontaneous action potentials of sinoatrial node cells and evoked action potentials of ventricular myocytes are measured by the whole cell patch clamp technique, and the morphological differences of action potentials waveforms between the two methods are compared. The action potential duration and resting potential levels of ventricular myocytes and sinoatrial node cells are calculated and compared, and the reasons for the difference in electrophysiological characteristics between the two cells are analyzed.
ventricular myocytes; sinoatrial node cells; action potential; action potential duration; resting potential
R-332
B
1002-4956(2019)10-0086-03
10.16791/j.cnki.sjg.2019.10.020
2019-02-21
华南理工大学校级教研教改项目(Y1180661);华南理工大学探索性实验项目(Y9180540)
范茁(1979—),女,河北定州,博士,实验师,研究方向为细胞电生理。E-mail: fanzhuo@scut.edu.cn
——从一道浙江选考生物学试题谈起

