高效液相色谱-荧光检测法测定发酵红肉制品中Neu5Gc
晏印雪, 朱秋劲*,2, 梁美莲, 周樱子, 常 瑞,李洪英, 徐阿奇, 刘春丽, 曾雪峰,2
(1.贵州大学 酿酒与食品工程学院,贵州 贵阳550025;2.贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳550025)
红肉一般指红色肌肉纤维比白色肌肉纤维多的动物肉。2015年10月26日,国际癌症研究机构将红肉列为 “可能对人类致癌”(2A类)致癌物质[1-3]。
红肉中非人类唾液酸Neu5Gc被报道为特有的致癌物质,外源性的Neu5Gc主要通过摄食红肉制品而在人体富集,继而机体产生抗Neu5Gc抗体,从而促发炎症和增加致癌风险[4]。Neu5Gc是唾液酸(Sialic acid,Sia)的一种,唾液酸又叫酰化神经氨酸,是一类具有9碳骨架的酸性糖类。大多数哺乳动物包括与人类相近的类人猿都可以自身合成Neu5Gc,但人类由于缺失可将CMP-Neu5Ac转化为CMP-Neu5Gc的CMAH羟化酶,所以健康的人体不能合成[4-6]。Neu5Gc通过代谢进入人体组织,含Neu5Gc的糖基复合物能够被Hanganutziu-Deicher(H-D)抗体特异性识别[7]。因此,Neu5Gc已成为食品安全检测与肿瘤诊断的新靶标,同时红肉及红肉加工制品中的Neu5Gc日益备受关注[8-13]。目前发酵红肉及制品主要研究微生物发酵降解胆固醇、杂环胺、亚硝酸盐以及其抗氧化性的特性[14-17],而对于红肉中特异性风险物质Neu5Gc研究鲜见报道。
迄今,对于唾液酸的检测方法常用的有:基于比色法的间苯二酚法、硫代己比妥酸 (2-Thiobarbituric acid,TBA)法;基于色谱法的高效液相色谱法 (RP-HPLC)、荧光高效液相色谱法(HPLC-FLD)等,传统的分光光度法只能检测总的唾液酸含量,有效检测Neu5Gc含量的方法有高效液相色谱法、HPLC-FLD和液相色谱-质谱法 (LCMS/MS)等,但主要针对在生鲜红肉[2,18-19]、动物内脏[18,20]、乳及乳制品[12,21-23]中 Neu5Gc 的含量,目前关于红肉在发酵环节和发酵制品中Neu5Gc含量测定未见报道。搭建发酵红肉及制品中Neu5Gc的检测方法对考察红肉发酵过程与Neu5Gc的消长规律具有重要作用。
1 材料与方法
1.1 材料与试剂
冷鲜猪肉、宣威火腿、广式香肠、川味香肠、美式火腿:购于贵阳市花溪区合力超市;传统土家特色酸鲊肉、接种发酵酸鲊肉:均为实验室自制。
Neu5Gc 标准品 (GC,≥99%)、DMB (GC,≥99%)、β-巯基乙醇(色谱纯):Sigma公司产品;甲醇(色谱纯):德国applichem公司产品。
1.2 仪器与设备
Agilent 1260高效液相色谱仪 (配有荧光检测器和自动进样器):美国安捷伦科技有限公司产品;LiChrosorb RP-18 色谱柱(150 mm×4.6 mm×5 μm):默克集团产品;ZORBAX Eclipse XDB-C18色谱柱(150 mm×4.6 mm×5 μm)、ZORBAX 300Extend-C18色谱柱(150 mm×4.6 mm×5 μm):美国安捷伦科技有限公司产品;CTFD-12S冷冻干燥机:青岛永合创信电子科技有限公司产品;S825-12DT超声清洗器:上海冠特超声仪器有限公司产品;DY89-II电动玻璃匀浆机:上海安亭科学仪器厂产品;AR224CN电子分析天平:奥豪斯仪器(贵州)有限公司产品;TG16-WS高速冷冻离心机:上海卢湘仪仪器有限公司产品;XMTD203数显恒温油浴锅:江苏科析仪器有限公司产品。
1.3 方法
1.3.1 Neu5Gc标准溶液配制 精确称量0.0825 g Neu5Gc标准品,用超纯水溶解于烧杯中,随后转移至250 mL容量瓶中,定容至刻度,即为1 mmol/L Neu5Gc标准品溶液。吸取1 mmol/L Neu5Gc标准品溶液配制成 10、25、50、100、200、300、400 μmol/L 等一系列浓度梯度的Neu5Gc标准溶液,待衍生。
1.3.2 样品溶液制备 取发酵红肉制品(我国传统酸鲊肉、发酵香肠、火腿等),根据发酵红肉制品的原料形状不同,分为块状及肉糜状发酵红肉制品。
1)肉糜状发酵红肉制品:剥去肠衣,精确称取1 g肉糜,用10 mL质量分数30%的饱和硫酸铵溶液匀浆以沉淀蛋白,并冷冻干燥去除硫酸铵。为使Neu5Gc游离出来,将冻干后的样品加入10 mL质量分数2 mol/L冰乙酸于80℃水浴锅中水解3 h,以12000 r/min的转速离心10 min取上清液,用0.45 μm膜过滤后进行二次冻干除去冰乙酸。冻干粉溶解于1 mL 0.1 mol/L的NaOH中,37℃水浴30 min,用 0.45 μm 膜过滤制得样品溶液,待衍生[24]。
2)块状发酵红肉制品:选取块状发酵红肉制品的精瘦肉部分,取1 cm以下的中间肉样1 g,制备方法同上。
1.3.3 DMB衍生剂溶液的配制及衍生反应 参考Martín 等[25]介绍的方法配制 8 mmol/L DMB、1.5 mol/L冰乙酸、0.25 mol/L硫代硫酸钠、0.25 mol/L亚硫酸钠、0.8 mmol/L β-巯基乙醇。
准确吸取900 μL的样品溶液或Neu5Gc标准溶液,加入100 μL DMB衍生试剂,于水浴锅中50℃避光衍生2.5 h后放入冰水混合液中快速冷却,用0.22 μm膜过滤后待测。
1.3.4 高效液相色谱条件的选择优化 采用默克LiChrosorb RP-18 色谱柱(150 mm×4.6 mm×5 μm)、安捷伦ZORBAX 300Extend-C18色谱柱 (150 mm×4.6 mm×5 μm)和安捷伦 ZORBAX Eclipse XDBC18 色谱柱(150 mm×4.6 mm×5 μm),荧光检测器激发波长373 nm、发射波长448 nm,柱温30℃,流量为0.9 mL/min,进样体积10 μL。以甲醇-水、甲醇-乙腈-水、乙腈-水为流动相,优化流动相配比。
2 结果与分析
2.1 色谱柱及流动相的确定
根据已报道的色谱条件[19,24]进行预实验,试验结果表明:现有的Neu5Gc检测方法只适用于鲜肉、牛奶、鸡蛋等未经发酵的食品中的Neu5Gc浓度检测,而不适用于发酵红肉制品中Neu5Gc浓度检测。如图1所示,经微生物发酵后的肉制品,因微生物发酵分解有机物,并产生代谢产物,在流动相为V(甲醇)∶V(乙腈)∶V(水)=8∶7∶85 条件下,发酵红肉样品的目标峰的峰形不对称并向左偏移,加标后目标峰的峰形向Neu5Gc标准品保留时间方向偏移,由此可知在Neu5Gc目标峰出峰时间内有杂质干扰,无法对发酵红肉制品中Neu5Gc的浓度进行测定。
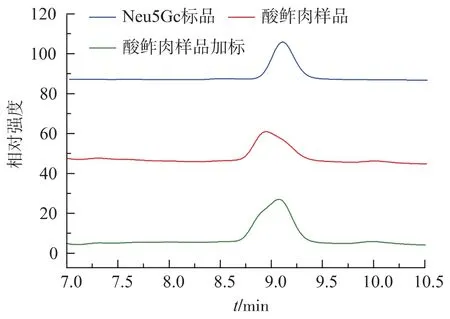
图 1 流动相为 V(甲醇)∶V(乙腈)∶V(水)=8∶7∶85 的 HPCL色谱图Fig.1 HPCL chromatogram of methanol-acetonitrilewater(8:7:85,V/V)
随后分别选择默克LiChrosorb RP-18色谱柱(150 mm ×4.6 mm ×5 μm)、 安 捷 伦 ZORBAX 300Extend-C18 色谱柱 (150 mm×4.6 mm×5 μm)和安捷伦 ZORBAX Eclipse XDB-C18色谱柱(150 mm×4.6 mm×5 μm),以甲醇-水、甲醇-乙腈-水、乙腈-水等流动相体系的不同体积配比,对样品的液相色谱检测条件进行优化。
通过不同色谱柱分离效果对比,发现使用安捷伦 ZORBAX Eclipse XDB-C18色谱柱(150 mm×4.6 mm×5 μm)分离效果最佳。通过初步流动相体系筛选,选用甲醇-水作为流动相体系,并对不同流动相体积分数配比进行优化,结果如图2所示。实验表明:当流动相A为超纯水,B为甲醇溶液,体积比为80∶20洗脱,能使Neu5Gc杂质的峰与主成分峰分离有效分离(分离度R>1.5),如图3所示;且峰形良好,Neu5Gc的保留时间为14.484 min,如图4所示。并且采用梯度洗脱能显著降低检测时间,提高检测效率,梯度洗脱程序如表1所示。

图2 不同流动相比例HPLC色谱图Fig.2 HPCL chromatogram of different mobile phase ratio

图3 传统发酵30 d酸鲊肉样品中Neu5Gc的HPLC色谱图Fig.3 HPCL chromatogram of Neu5Gc in traditional fermented 30-day Suanzharou

图4 Neu5Gc标准样品HPCL色谱图Fig.4 HPCL chromatogram of Neu5GC standard
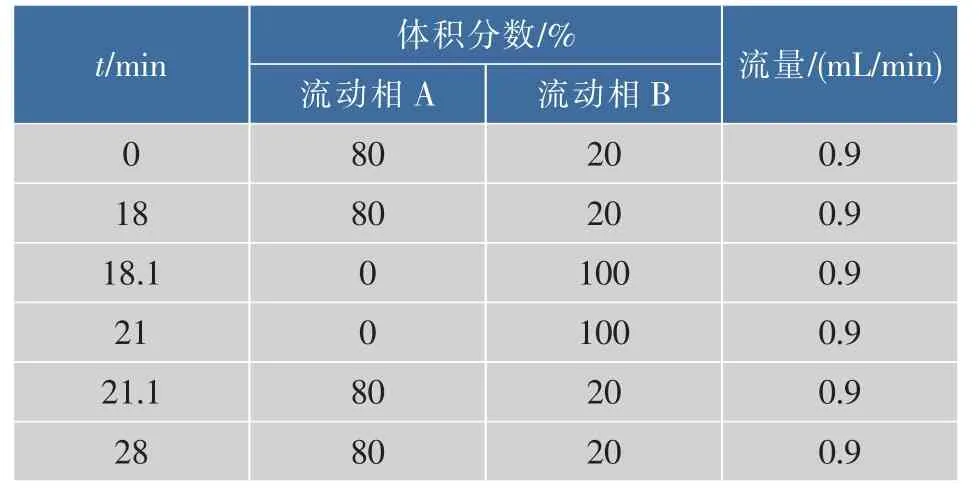
表1 流动相梯度洗脱条件Table1 Conditions for mobile phase by gradient elution
2.2 标准曲线的绘制
取 10、25、50、100、200、300、400 μmol/L 等一系列浓度梯度的Neu5Gc标准溶液,衍生后进样检测,不同浓度标准品溶液平行测定3次。以标准品浓度为横坐标,对应的色谱峰面积的平均值为纵坐标,绘制线性标准曲线,如图5所示。结果表明,在10~400 μmol/L线性范围内,Neu5Gc峰面积与浓度呈现良好的线性关系,符合测定要求。
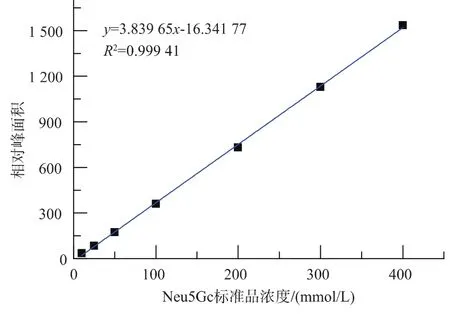
图5 Neu5Gc标准曲线Fig.5 Neu5Gc standard curve
2.3 检出限、定量限
取1 mmol/L Neu5Gc标准品溶液倍数稀释后衍生测定。实验结果表明:RSN=3时,最低检出限(LOD)为 0.001 μmol/L,高于 LC-MS/MS 测定 Neu5Gc的最低检测限 0.3 μmol/L[13];RSN=10 时,定量限(LOQ)为 0.003 μmol/L。
2.4 重复性、精密度
取同一发酵肉样,按照1.3.2样品溶液制备方法制备平行样品溶液5份,衍生后,依次进样检测。5份样品Neu5Gc浓度的RSD值为1.5%;取同一待测样品溶液连续进样6次,测得Neu5Gc峰面积的RSD为1.2%。结果显示,本实验方法具有良好的精密度和重现性。
2.5 Neu5Gc加标回收率测定
取3份已知Neu5Gc浓度样品,分别加入1、5、10 μmol/mL 3个浓度的Neu5Gc标准溶液进行加标回收实验,结果如表2所示,平均回收率在96.4%~99.07%之间。

表2 Neu5Gc加标回收率的测定Table2 Recovery of Neu5Gc in samples
2.6 样品检测结果
Varki等[25]检测得到生鲜猪肉中Neu5Gc质量分数为25.25 μg/g,而Chen等[20]测得生鲜猪肉中的Neu5Gc质量分数仅有5.6 μg/g。实验检测结果由图6可知,鲜肉原料 (S1)的Neu5Gc质量分数为(25.61±1.31)μg/g, 传统发酵 30 d 酸鲊肉 (S2)的Neu5Gc质量分数为 (17.14±0.92)μg/g, 接种发酵30天酸鲊肉 (S3) 的Neu5Gc质量分数为 (9.59±0.47) μg/g;Suna、Annie 等[18,26]分别测定了生长 3、38、180 d猪的新鲜猪肉、猪脾、猪腰、猪肺、猪心和猪肝和经过不同的加工方式加工的红肉制品中Neu5Gc质量分数,发现与猪肉相比,各个器官中Neu5Gc的质量分数较高,而不同的物理加工方式均显著改变了Neu5Gc质量分数以及Neu5Gc结合态与游离态的比例,其中有增加也有降低。对比鲜肉原料、传统发酵30 d酸鲊肉与接种发酵30 d酸鲊肉中的Neu5Gc质量分数可知,在发酵酸鲊肉与鲜肉原料之间Neu5Gc的质量分数存在显著性差异(p<0.05),发酵可显著降低红肉中Neu5Gc的质量分数,且接种微生物发酵酸鲊肉中Neu5Gc质量分数最低;目前还没有微生物发酵降解Neu5Gc的研究,推测可能的原因:1)微生物发酵产生代谢产物,对Neu5Gc有降解作用,如乳酸等。蒋芸等[27]研究表明猪肉在添加乳酸的情况下,60.0%以上唾液酸被解离;2)Neu5Gc是一类具有9碳骨架的酸性糖类,通常附着于细胞表面和分泌的糖蛋白和糖脂的糖链的外端[4],可能作为碳源被微生物利用进入代谢途径发生分解从而导致Neu5Gc在红肉中的质量分数降低。
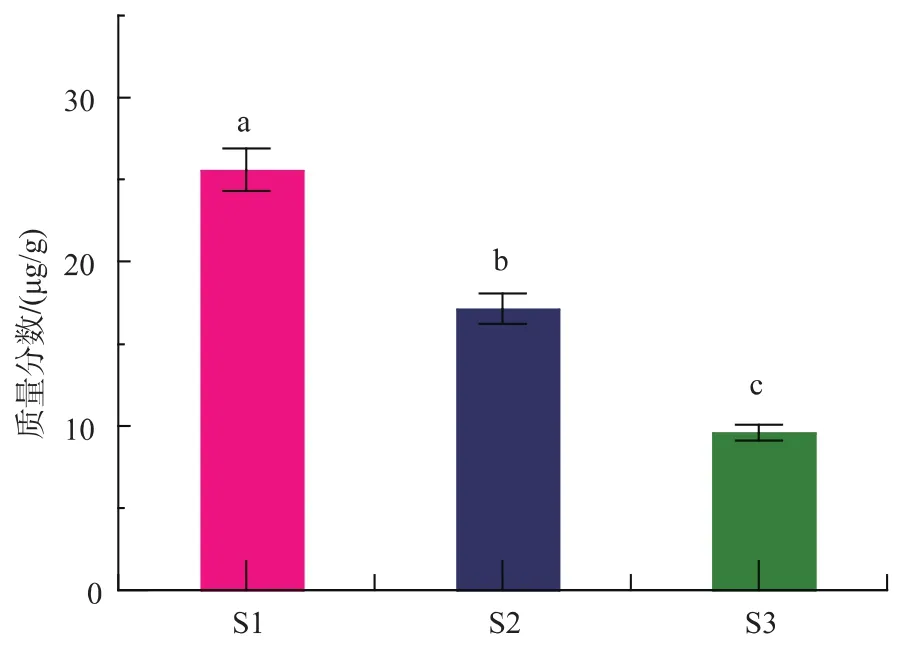
图6 不同方式发酵的红肉制品中Neu5Gc的质量分数(n=3)Fig.6 ContentofNeu5Gcinfermentedredmeat products by different ways(n=3)
由图7和图8可知,肉糜状发酵肉制品中的Neu5Gc质量分数普遍低于块状发酵红肉制品中Neu5Gc质量分数,对两组样品(包括3个平行样)进行t检验分析得在置信区间95%内p值为0.03(<0.05),即不同形态的红肉发酵制品中的Neu5Gc存在显著性差异。其中腊肉的Neu5Gc质量分数最高,萨拉米香肠质量分数最低。如果微生物发酵降解Neu5Gc质量分数的推测成立,据此推断肉糜状的红肉更有利于增大红肉与微生物的接触面积,从而使发酵更充分,提高Neu5Gc的降解效率。

图7 块状发酵红肉制品中Neu5G质量分数(n=3)Fig.7 Content of Neu5Gc in block fermented red meat products(n=3)
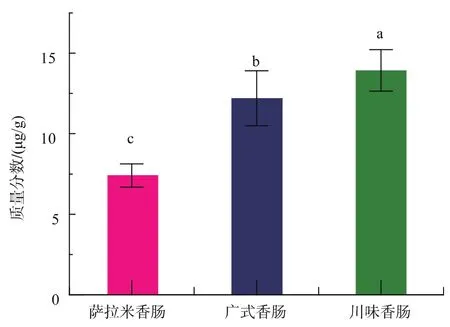
图8 肉糜状发酵肉制品中Neu5G质量分数(n=3)Fig.8 Content of Neu5Gc in minced fermented red meat products(n=3)
3 结语
采用酸水解,4,5-亚甲基二氧基-1,2-邻苯二胺盐(DMB)衍生的荧光高效液相色谱(HPLC-FLD)检测发酵红肉制品中Neu5Gc质量分数。该方法分离度良好(R>1.5),平均回收率在 96.4%~99.07%之间,最低检出限为0.001 μmol/L,Neu5Gc保留时间为14.484 min,且峰形对称无漂移无拖尾。此方法分辨率、灵敏度,精密度和回收率较高,能够满足发酵红肉制品中Neu5Gc的测定,弥补了对发酵红肉制品中Neu5Gc的研究手段的缺失。
采用该方法测得的不同种类的发酵红肉制品Neu5Gc的质量分数在9.59~20.08 μg/g之间,不同的发酵红肉制品Neu5Gc的含量之间均存在显著性差异(p<0.05),且低于未发酵红肉样 Neu5Gc的含量26.87 μg/g。目前,尚未有微生物发酵对红肉中Neu5Gc影响的研究,进一步研究旨在阐释微生物发酵对Neu5Gc的降解机制。

