阿司匹林缓释微球的制备及体外缓释效果评估
陈 英,刘中宁,李 波,姜 婷△
(1. 北京大学口腔医学院·口腔医院,修复科 国家口腔疾病临床医学研究中心 口腔数字化医疗技术和材料国家工程实验室 口腔数字医学北京市重点实验室,北京 100081; 2. 重庆科技学院纳微复合材料与器件重庆市重点实验室,重庆 401331)
非甾体类抗炎药物阿司匹林(acetylsalicylic acid, aspirin)是临床常用的药物,价格低廉,近年来的研究显示,阿司匹林在骨代谢中发挥着重要作用,同时具有显著的抗炎和促矿化作用[1-2]。本课题组将可注射性温敏海藻酸/羧化聚N-异丙基丙烯酰胺/β-TCP复合凝胶(thermo-sensitive alginate hydrogel-g-PNIPAAm/β-TCP, TSAH/β-TCP)作为支架材料,在兔下颌骨和大鼠颅骨诱导成骨中获得了肯定的成骨效果[3-4]。但是,由于阿司匹林属于小分子,在传统支架材料中存在用药即刻突释现象,长期作用效果受到很大局限,其诱导形成的新生组织仍处于矿化早期,因此,建立一种阿司匹林的缓释体系,对于其在成骨研究中的应用至关重要。
缓释的作用机制是将药物通过化学接枝或物理包裹方式与载体结合,随着化学键的断裂或载体的降解而实现药物缓慢释放,从而达到延长药物作用周期和减少毒副作用的目的[5]。化学接枝的难点在于合适化学键的选择和药物特性的维持[6],而阿司匹林极易发生水解形成水杨酸而丧失其疗效[7],因此,相对于化学接枝而言,物理包裹方式更有利于阿司匹林保持药效和长期缓释。
常见的微球型药物载体可分为天然有机类和人工合成类,将阿司匹林包裹于海藻酸[8]、壳聚糖/聚乙烯醇[9]等天然有机类微球载体中能取得一定的缓释效果,但存在缓释时间短、载药率低和需手术有创植入等缺陷。人工合成类高分子聚合物聚乳酸羟基乙酸(polylactic-co-glycolic acid, PLGA)微球,粒径小,降解速率可调控,可塑性强,并且可以制成注射型制剂,具有操作方便、微创等优点而受到广泛应用。
在骨组织工程支架材料中,生物陶瓷和有机聚合物结合的复合支架具有良好的生物相容性、柔韧性以及机械性能,能长期释放钙离子,有利于成骨微环境形成等优点。生物陶瓷类硅酸钙(calcium silicate, CaSiO3)是一种可降解材料,具有良好的生物相容性和骨传导性,与传统的钙磷类生物陶瓷相比,其能够更有效地促进早期骨形成[10-11]。在药物缓释方面,其表面及内部疏松多孔结构能够吸附大量药物,载药率较高。
我们拟构筑PLGA与CaSiO3复合型微球载体,利用CaSiO3材料增强支架机械性能,并通过表面多孔结构物理性药物吸附,实现部分药物的早期快速释放,同时利用PLGA包载药物,实现药物随PLGA降解缓慢长期释放,通过二者协同作用,获得阿司匹林的理想释放方式,以期在骨缺损局部发挥抗炎和促进成骨的长期效果,达到促进骨再生的目的。
1 材料与方法
1.1 合成制备三种缓释微球
为了探究PLGA、CaSiO3以及两者复合后的aspirin缓释性能,我们合成了三种微球体系,合成的组成比例见表1,具体合成方法如下。
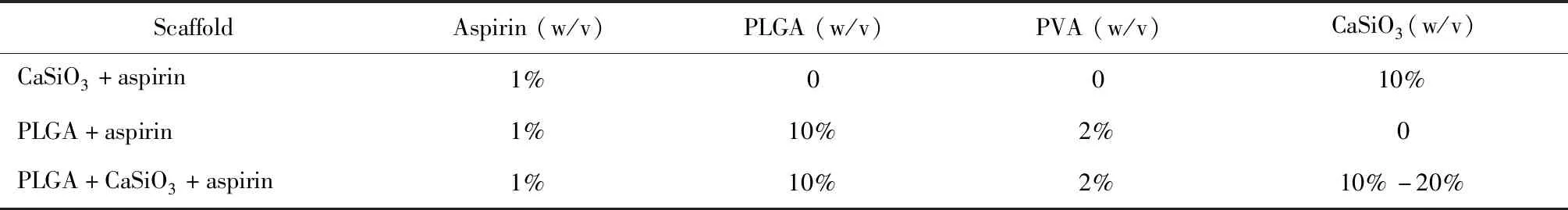
表1 三种缓释微球支架合成组分比例Table 1 The compositions of three kinds of scaffolds
PLGA, poly lactic-co-glycolic acid; CaSiO3, calcium silicate; PVA, polyvinyl alcohol; w, weight; v, volume.
1.1.1CaSiO3+aspirin微球制备 单纯物理浸提液法合成,称取10 mg CaSiO3微球(重庆科技学院提供),浸泡于1 mL 10 g/L的aspirin (≥99%, 相对分子质量180.16,Sigma, 美国)水溶液中,置于TS-1000脱色摇床(其林贝尔仪器制造有限公司,海门市)轻轻震荡2 h(转速为100 r/min),弃去上层液体,置于冷冻干燥机(BILON公司,上海)过夜。
1.1.2PLGA+aspirin微球制备 水包油(oil/water,O/W)乳化法合成,在10 g/L aspirin的二氯甲烷(DCM, 北京化工厂)溶液中加入100 mg PLGA(体积比50 ∶50,相对分子质量7 000~17 000,Sigma, 美国),冰水浴中使用磁力搅拌机(转速为200 r/min,金北德工贸有限公司,中国)搅拌20 min,将得到的悬浊液倒入3 mL 2%(质量分数)的聚乙烯醇(PVA,≥99%, 相对分子质量85 000~124 000,Sigma, 美国)溶液中,旋涡震荡30 min(转速为2 000 r/min), 静置30 min,TDZ4-WS低速台式离心机(湘仪离心机仪器有限公司, 中国)分离离心,磷酸盐缓冲液(phosphate buffered saline,PBS)超声清洗3遍,冷冻干燥过夜,真空储存。
1.1.3PLGA+CaSiO3+aspirin微球制备 同样采用O/W乳化法合成,CaSiO3微球使用高通量组织破碎仪(Qiagen公司,德国)搅拌1 min(转速为10 000 r/min), 称取一定量的CaSiO3粉末加入至含有aspirin和PLGA的DCM溶液中,并通过调整PLGA与CaSiO3的比例,得到材料的最佳形貌。
1.2 微球形态观察及粒径测定
分别取少量上述三种微球支架,于Hitachi S-4800环境扫描电镜(Hitachi公司,日本)下观察微球的外观形态,应用Nano Measurer软件测量微球的粒径及其分布。
1.3 阿司匹林标准溶液的配置及微球载药率测定
Thermo NanoDrop 8000分光光度计(Thermo公司,美国)检测aspirin溶液最大吸收波长为275 nm。配制不同浓度(31.2、62.5、125.0、250.0、500.0、1 000.0 mg/L)的标准aspirin溶液,检测其在275 nm处的光密度值(D),绘制标准曲线。
三组缓释微球支架随机各称取20 mg制备的微球,泡于1 mL DCM中,每组设置4个样本,共12个样本,捣碎静置,以分光光度计测各样本上清液275 nm处的吸收波长值,根据aspirin 275 nm处的标准曲线计算aspirin浓度,载药率=(微球含药量/微球实际重量)×100%。
1.4 载药率的统计学分析
载药率使用均数±标准差表示,采用SPSS 17.0统计软件进行单因素方差分析,任意两组之间运用LSD做组间差异的统计学处理,P<0.05为差异有统计学意义。
1.5 三种缓释微球支架药物缓释效果评估
分别称取一定量制备的微球支架置于3个15 mL离心管中,均各自浸泡于1 mL PBS,置于恒温振荡器37 ℃恒温振荡,40 r/min。分别于第1、2、4、6、9、13、17、21、24、30、36、45天时间点取20 μL浸提液测275 nm处的光密度值,同时加入20 μL新配制预热的PBS,在此过程中无换液,计算aspirin浓度,此浓度即为该时间点aspirin的累积释放浓度,绘制累积释放曲线。
2 结果
2.1 三种微球的形貌及粒径分布
在环境扫描电镜下观察可见,三种微球支架成球规整,表面光滑,基本无粘连,分布较均匀,而PLGA+CaSiO3+aspirin支架中,微球均匀分布在CaSiO3粉末中,较少出现微球破裂及团聚现象。应用Nano Measurer软件测量微球的粒径及其分布,CaSiO3+aspirin、PLGA+aspirin、PLGA+ CaSiO3+aspirin的平均粒径分别为(177.2±29.6) μm、(0.9±0.3) μm、(5.3±1.8) μm,各自主要分布在150~200 μm、0.6~1.3 μm、4.0~8.7 μm范围内(图1)。
2.2 阿司匹林标准曲线的绘制及微球载药率评估
用Thermo NanoDrop 8000分光光度计测量275 nm处吸收波长,绘制标准曲线(图2A),得线性回归方程:C=3.292D+0.023,R2=0.998,表明aspirin在30~1 000 mg/L的浓度范围内,浓度C与光密度D之间有很好的线性关系。计算CaSiO3+aspirin、PLGA+aspirin、PLGA+CaSiO3+aspirin的药物载药率,并进行统计学分析(图2B),三种微球支架的载药率分别为(1.06±0.04)%、(7.05±0.06)%和(6.75±0.18)%。采用SPSS 17.0统计软件进行单因素方差分析,任意两组间运用LSD做组间差异的统计学处理,其中PLGA+aspirin、PLGA+CaSiO3+aspirin的载药率均明显高于CaSiO3+aspirin组,差异有统计学意义(P<0.05),PLGA+aspirin与PLGA+CaSiO3+aspirin两组间载药率差异无统计学意义,说明PLGA通过物理包被作用负载药物能力明显高于CaSiO3物理吸附作用负载药物能力。
2.3 三种微球支架缓释效果评估
于固定时间点测定光密度,计算其浓度,绘制aspirin累积释放曲线(图3)。三种微球支架释放总量95%的时间分别为3 d、24 d和36 d,CaSiO3+aspirin微球突释现象较明显,PLGA+aspirin微球初期24 h释放困难,PLGA+CaSiO3+aspirin微球支架释放时间明显延长,无明显突释以及初期难以释放等问题,且释放速率更为稳定。
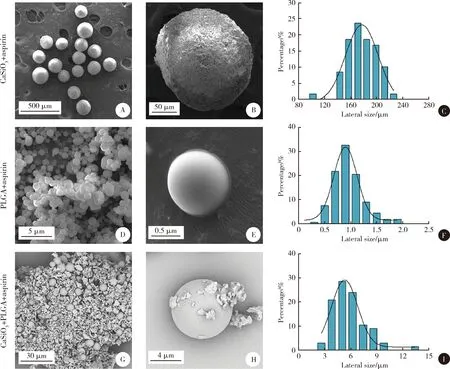
A-C, CaSiO3+aspirin; D-F, PLGA+aspirin; G-I, PLGA+CaSiO3+aspirin.图1 三种微球扫描电镜图及粒径分布图Figure 1 Scanning electron microscope photographs and size distribution of the three kinds of scaffolds
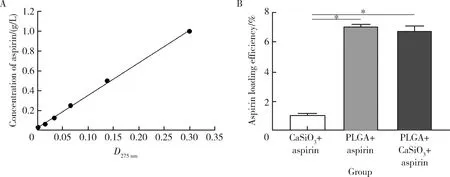
图2 阿司匹林标准曲线(A)和三种微球支架的载药率(B)Figure 2 Standard curve of aspirin (A) and aspirin loading efficiency of scaffolds (B)
3 讨论
在临床骨缺损的修复治疗中,感染的预防和控制、促矿化效果及血管化效果是促进骨再生的关键。因创伤和生物材料的植入,缺损区域常存在炎症和免疫反应。由于组织损伤和感染刺激因素的长期作用,导致缺损区慢性炎症及免疫调节的失衡,巨噬细胞和T淋巴细胞大量聚集,M1巨噬细胞分泌TNF-α、IL-1β、MCP-1、MIP-1等大量炎症因子,其中TNF-α、IL-1β等炎症因子能够激活NF-κB通路,增强破骨细胞的活性,抑制成骨细胞及间充质干细胞活性[12],同时,活化的T淋巴细胞表达FasL,通过与成骨细胞表达的Fas结合,介导骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMMSC)的凋亡[13],导致骨再生的失败。因此,将具有抗炎和免疫调节作用的药物复合到骨组织工程支架材料中并适当调控其释放,有望抑制骨缺损和生物材料植入造成的早期炎症和过度免疫反应,从而形成促进骨再生的微环境。
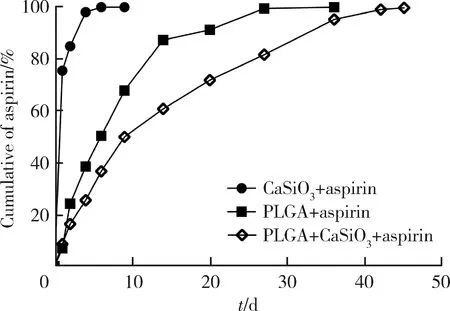
图3 阿司匹林三种微球支架的累积释放曲线Figure 3 In vitro release of scaffolds loaded with aspirin
以往大量研究探讨了促成骨生长因子(BMP2、BMP7等)和促血管生成因子(VEGF、bFGF等)对成骨的作用[14-16]。生长因子可以促进骨髓间充质干细胞增殖、分化,形成血管化的新生骨组织,但是BMP2等成骨生长因子具有成骨效果不可控、费用高昂等风险[17],临床应用受到限制。非甾体类抗炎药物阿司匹林是临床常用的药物,价格低廉,近年来的研究显示,阿司匹林在骨代谢中发挥着重要作用,同时具有显著的促矿化和抗炎作用[1-2]。阿司匹林通过抑制IKBα磷酸化及降解,抑制p50/p65磷酸化及其相关细胞信号分子ERK、p38和JNK的表达[18],同时,阿司匹林可以显著降低TNF-α和IFN-γ的表达[19],阻断NF-κB信号通路激活对成骨的不良影响。在免疫调节方面,阿司匹林还能够抑制T细胞介导的Fas通路对BMMSC的凋亡作用[13]。通过促进磷酸化β-连环蛋白的降解,激活Wnt信号通路,提高Runx2的表达,进而促进成骨[13,20]。此外,阿司匹林通过降低RANKL的表达,提高OPG的表达,抑制破骨细胞的分化[21]。本课题组的前期研究证实了可注射温敏海藻酸钠复合凝胶中添加阿司匹林可以有效提高新生组织的矿化体积和密度[3-4],但是依然存在药物释放难以理想控制等问题。因此,本文主要从材料角度出发,期望获得更为理想的药物缓释方式,对于今后缓释的研究有一定指导意义,并可作为后续体内骨修复实验的重要前期研究。
常见的药物载体可分为天然有机类以及人工合成类[22],人工合成类CaSiO3陶瓷具有骨传导性、生物相容性、释放硅钙等离子形成利于成骨微环境等特点[23],但在药物缓释方面,其表面疏松多孔的结构使其释放周期较短,存在明显的突释现象,调整其孔隙率及孔径等因素对其缓释周期无明显改善[24]。人工合成类的可降解材料(如PLGA)因其良好的生物相容性,可以通过调整其组分比例、相对分子质量以及化学结构来控制其降解速率,而且PLGA微球较大的比表面积因其能够促进细胞黏附、增殖、分化能力[24]的特点受到广泛应用,但是,PLGA微球作为一种单组分支架,机械性能不足且易发生团聚,会导致初期药物释放困难,因此,本研究旨在结合CaSiO3和PLGA的性能优点,探索一种更为理想的复合微球支架材料。
本研究通过水包油乳化法,将CaSiO3和PLGA复合为新的微球体系,通过PLGA的包被作用负载大部分阿司匹林药物,利用了CaSiO3材料表面多孔结构和吸附能力,使微球表面吸附一部分阿司匹林药物,从而形成了一个立体多层次的载药体系。通过CaSiO3和PLGA协同作用,提高了微球的机械强度,成功解决了单纯CaSiO3负载药物存在明显突释现象、PLGA载药微球初期释放困难等难题,达到了阿司匹林的理想缓释方式。我们进一步提出设想,CaSiO3材料表面吸附的阿司匹林在体内植入初期,会在短时间内较大量释放,从而有利于将材料植入区域炎症控制在一个较低范围,建立利于骨再生的微环境,保证局部免疫调节的平衡,后期随着PLGA的降解,包载于PLGA中的阿司匹林缓慢长期释放,促进骨髓间充质干细胞向成骨细胞分化,实现理想的骨再生效果。
在支架合成方面,本研究中PLGA+CaSiO3+aspirin复合微球的合成步骤简便,成分简单稳定,具有生物安全性和较高的机械性能,同时,该复合微球粒径在微纳米级别范围,可制成注射剂型,具有可塑性强和微创的特点。与临床上治疗骨缺损采用的人工骨粉或自体骨移植相比,复合微球可减轻患者的痛苦,大大降低了成本。同时,复合微球对于阿司匹林的改良缓释方式,有望实现抑制炎症调节免疫的效果,从而建立理想的成骨微环境。
综上所述,PLGA+CaSiO3+aspirin复合微球具有较理想的aspirin缓释效果,有望成为更为理想的成骨材料。

