Neuroform EZ支架在治疗复杂症状性颅内动脉重度狭窄中的应用
贾子昌,卞焕菊,李 选,栾景源,王昌明,刘启佳,韩金涛△
(1.北京大学第三医院介入血管外科,北京 100191; 2.冠县人民医院神经内科,山东聊城 252500)
颅内动脉粥样硬化性狭窄(intracranial atherosclerotic stenosis,ICAS)是缺血性卒中的重要原因。2014年中国症状性颅内大动脉狭窄与闭塞研究(Chinese Intracranial Atherosclerosis,CICAS)显示,我国缺血性卒中或短暂性脑缺血发作(transient ischemic attack,TIA)患者中ICAS发生率为46.6%,远高于欧美人群[1-2]。即使经规范化药物治疗,症状性ICAS卒中复发风险仍较高[3-5],因此,介入手术治疗症状性ICAS是一项有前景的技术。然而,一项发表于2011年的颅内动脉狭窄支架对比积极药物治疗研究(stenting versus aggressive medical therapy for intracranial arterial stenosis,SAMMPRIS)[4]和一项发表于2015年的比较球囊扩张式支架置入术与药物治疗症状性颅内动脉狭窄的随机对照研究(vi-tesse intracranial stent study for ischemic stroke therapy,VISSIT)[5]均显示,支架治疗ICAS比单纯规范化药物治疗具有更高的围手术期并发症。上述两个研究结果在国际神经介入领域引发了热烈讨论,在其选用支架单一、手术时机选择、术者资质等方面受到广泛质疑。
Miao等[6]和Wang等[7]进行的中国症状性颅内动脉狭窄支架治疗登记研究,对围手术期流程及术者资质等指标进行了改进,结果显示对于高选择性的症状性ICAS,介入治疗的风险较低(4.3%),是安全可行的治疗方式。但该研究排除了在临床上占很大比例的复杂症状性重度ICAS患者,因为以传统颅内动脉支架(Wingspan或Apollo支架)治疗此类患者的风险较高,故目前临床上大多对其采用规范化药物治疗,导致卒中复发风险很高,给社会和家庭带来巨大负担,是目前临床亟待解决的问题。近年来,少数中心尝试采用经微导管释放型支架治疗复杂症状性中毒ICAS患者,获得了较满意的效果。本研究回顾分析18例应用经微导管释放型支架Neuroform EZ治疗复杂症状性重度ICAS的患者资料,并初步评估其安全性和有效性。
1 资料与方法
1.1 研究对象
回顾性收集2016年1月至2017年12月于北京大学第三医院血管介入科采用Neuroform EZ支架治疗的18例复杂症状性重度ICAS资料,所有患者术前均签署知情同意书。
纳入标准:(1)数字减影血管造影(digital subtraction angiography,DSA)显示颅内责任动脉狭窄率>70%(WASID试验标准[3]);(2)规范化药物治疗情况下,仍有责任血管供血区卒中或TIA发作;(3)计算机断层扫描灌注成像(computed tomography perfusion,CTP)显示责任血管供血区存在低灌注征象;(4)入院时改良Rankin量表评分(modified Rankin scale,mRS评分)在0~2分;(5)存在动脉粥样硬化的危险因素(高血压、糖尿病、高脂血症、吸烟等);(6)手术路径严重迂曲、病变长(>10 mm)或闭塞、病变接近分叉、狭窄附近合并动脉瘤等。
排除标准:(1)非动脉粥样硬化性狭窄;(2)3个月内发生过颅内出血;(3)由于脑卒中或痴呆导致的严重残疾;(4)对肝素、阿司匹林、氯吡格雷、造影剂或全身麻醉有禁忌;(5)不同意介入手术治疗。
1.2 治疗方法
手术情况:均采用全身麻醉,18例手术均由经验丰富的同一神经介入医师完成。术前2 h开始静脉持续泵入尼莫地平,采用Seldinger技术穿刺股动脉置入6 F动脉鞘后,予全身肝素化。将6 F Gui-ding导管(手术路径严重迂曲者采用6 F Navien导管)置于责任血管近端的合适位置,对靶血管进行DSA造影(Innova 3100,GE公司)评估靶血管狭窄部位的长度、管径以及附近正常管腔的直径。在3D路径图指引下,微导丝(Synchro-0.014,200 cm,Stryker公司)结合微导管(Excelsior SL-10,Stryker公司)小心通过狭窄或闭塞段到达远端分支动脉。以微导管造影证实在分支动脉真腔后,将微导丝更换为交换型微导丝(Transcend-0.014,300 cm,Stry-ker公司),撤出微导管,沿微导丝引入合适型号的Gateway球囊(Stryker公司)扩张靶病变区,透视下逐渐充盈球囊到约6 atm(1 atm=101.325 kPa)的压力,持续约10 s。扩张完成后撤出球囊,沿交换导丝导入输送支架用的微导管(XT-27,Stryker公司),将合适型号的Neuroform EZ支架(Stryker公司)经该微导管定位满意后进行释放。支架置入后即刻行血管DSA造影对靶血管评估残余狭窄。通常选用略小于正常血管直径的支架,支架需完全覆盖病变处,且支架两侧至少超过病变两端3 mm(典型病例见图1和2)。
围手术期管理:入组患者术前均连续口服阿司匹林肠溶片(100 mg/d)和氯吡格雷(75 mg/d)双联抗血小板及他汀类药物7 d以上,并积极纠正危险因素。术后即刻复查头颅CT了解有无颅内出血,如无出血,术后均使用肝素钠抗凝 24 h,监测活化部分凝血活酶时间(activated partial thromboplastin time,APTT), 1次/4 h,并维持APTT于72~108 s(正常值:24~36 s)。持续静脉泵入尼莫地平注射液24 h(随血压调节泵入速度), 术后严格控制血压于100~130 mmHg/70~85 mmHg(1 mmHg=0.133 kPa)或低于基线血压15%,预防高灌注综合征。予口服阿司匹林肠溶片(100 mg/d)和氯吡格雷(75 mg/d)双联抗血小板及他汀类药物长期治疗,6个月后基于血栓弹力图和基因检测的复查结果,留取一种合适的抗血小板及他汀类药物终生服用,并规范控制动脉粥样硬化的危险因素(高血压、糖尿病、高脂血症等)。
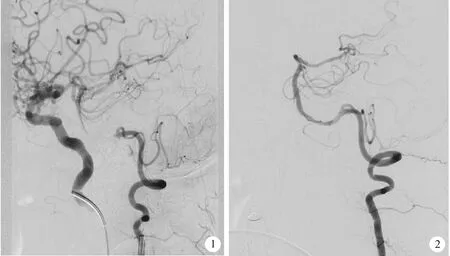
图1 术前双路径DSA造影见左椎动脉V4段长段闭塞 图2 DSA造影显示Neuroform EZ支架置入术后左椎动脉V4段血流恢复通畅Figure 1 DSA image showed long segment total occlusion of V4 part of left vertebral artery pre-operationFigure 2 DSA image showed the returned forward flow of V4 part of left vertebral artery after stenting with Neuroform EZ stent
1.3 终点事件的评估
主要终点事件定义为术后30 d内任何脑卒中事件(含缺血性和出血性)或任何原因引起的死亡,术后缺血性卒中定义为由颅脑CT或MRI证实的急性脑梗塞,出血性卒中定义为CT证实的蛛网膜下腔、脑实质或脑室内的出血。次要终点事件为支架治疗成功(定义为支架完全覆盖靶病变,且残余狭窄<40%)以及随访期间支架内再狭窄(定义为DSA证实的>50%的支架内狭窄)。
1.4 随访
术后1个月和3个月对患者行门诊随访并进行神经功能评分,术后6个月行全脑血管造影检查,判断有无支架内再狭窄发生。如患者有新发神经系统症状,随时行全脑血管造影DSA复查。
1.5 统计学方法
2 结果
2.1 基线资料结果
纳入的18例患者中男性14例、女性4例,平均年龄(58±9)岁(44~80岁)。术前症状表现为责任血管供血区脑梗塞10例、TIA 8例。18例患者中合并高血压12例(66.7%)、糖尿病11例(61.1%),有吸烟史9例(50%)。所有患者入院时mRS评分在0~2分,支架治疗与首次发病间隔平均4周(2~7周)。CTP显示,18例患者(100%)均存在脑血流量(cerebral blood flow,CBF)降低。病变部位:椎动脉颅内段及基底动脉7例(38.9%)、颈内动脉颅内段3例(16.7%)、大脑中动脉8例(44.4%)。病变长度平均为(12.8±3.6)mm。狭窄病变形态分型:Mori A型病变0例、Mori B型病变7例(38.9%)、Mori C型病变11例(61.1%),其中2例患者为完全闭塞病变,均位于椎动脉V4段。手术路径分型:LMA (天坛医院手术路径分型)Ⅰ型2例(11.1%)、LMA Ⅱ型6例(33.3%)、LMA Ⅲ型10例(55.6%)。有1例患者合并狭窄段动脉瘤。
2.2 主要/次要终点事件结果
18例患者中1例(5.6%)发生主要终点事件,表现为缺血性脑卒中。患者为左椎动脉串联病变(左椎动脉开口及V4段均重度狭窄),术中V4段予球囊扩张成形+支架置入术,椎动脉开口病变予球囊扩张成形治疗后,台上观察见狭窄解除、前向血流良好,遂未进行支架置入术。全身麻醉清醒后患者当时无明显异常,但术后3 h开始出现意识水平下降伴右侧肢体肌力减弱。予急诊造影见左椎动脉开口处出现极重度狭窄,接近完全闭塞(考虑狭窄弹性回缩所致),予补救性支架成形术,术后病情好转,出院时mRS评分为1分。本组患者中未发生出血性脑卒中及死亡事件。
18例均顺利完成手术,技术成功率为100%。支架置入术后狭窄率从85%±7%降为18%±6%,差异具有统计学意义(P<0.01)。1例合并狭窄附近颅内动脉瘤患者予二期动脉瘤栓塞治疗。12例患者获得DSA随访,随访8~26个月,平均随访时间为(16±8)个月。有2例患者(16.7%)出现支架内再狭窄,均为Mori C型病变,其中1例患者为症状性再狭窄,予支架内球囊扩张治疗。6例失访患者因无症状或为远途外地患者,拒绝住院复查全脑DSA造影(表1)。

表1 手术材料及临床结果(n=18)Table 1 Operation consumables and clinical outcomes (n=18)
TIA, transient ischemic attack. *12 patients were followed up.
3 讨论
症状性ICAS是导致缺血性脑卒中的重要原因,伴有ICAS的卒中患者大多发病症状更重,住院时间更长,卒中复发率更高,且随狭窄程度的增加,卒中复发率升高[1,8]。随着神经介入技术的发展,许多研究证实了支架成形术可以降低颅内动脉狭窄率并减少脑卒中复发风险[9-10],因此,对于药物治疗失败的患者,血管内支架成形术是一种有效的补救治疗方法。然而,近年来发表的两项大的多中心随机对照研究(SAMMPRIS和VISSIT)[4-5]均认为支架治疗ICAS存在围手术期并发症发生率过高的问题,因此,支架置入术的安全性是目前亟待解决的问题[11]。随着临床经验的日益丰富,神经介入医师逐渐认识到个体化选用适合具体病变的支架对围手术期并发症有重要影响[12-14],而上述两项研究均因采用单一支架治疗不同类型ICAS而饱受质疑(SAMMPRIS研究限定只采用自膨式Wingspan支架,VISSIT研究限定只采用球囊扩张式Vitesse支架)。我们认为治疗复杂症状性ICAS,需要根据ICAS的不同类型而个体化地选用合适的支架,以取得更好的临床效果。
对于复杂症状性ICAS,Wingspan支架系统存在以下劣势:支架输送系统顺应性较差,在迂曲的血管内输送和释放困难,到位性能差;支架系统的橄榄形头端增加了血管损伤的风险,亦不利于累及分叉病变的治疗;支架的开环设计有可能导致在复杂病变释放后出现支架输送装置回撤困难等。而Apollo支架是球囊扩张式设计,较Wingspan支架输送系统顺应性更差,导致其到位性能差,且其径向支撑力更强,因此,更容易导致穿支事件的发生,所以仅适合于病变较短、穿支较少和路径较直的病变[6,15]。因此,上述两种传统治疗颅内动脉狭窄的支架都不适合治疗复杂症状性ICAS。
与上述两种传统支架不同,Neuroform EZ支架原本是设计用来辅助动脉瘤栓塞的开环支架,其经微导管输送和释放,易于被输送至病变部位,具有良好的到位性能,这应该是本组病例获得100%技术成功率的重要原因。Neuroform EZ支架的径向支撑力低于Wingspan和Apollo支架,强于Solitaire支架和Enterprise支架[16],所以更容易在复杂ICAS病变中进行释放,并对病变血管提供合适的径向支撑力。另外,不同于另一种辅助动脉瘤栓塞的网眼较密的编织型LVIS支架,Neuroform EZ支架为开环设计并具有较大网眼,降低了穿支闭塞事件的发生率。
虽然复杂ICAS病例具有较高的技术难度,但本组患者主要终点事件的发生率仅为5.6%。考虑除了Neuroform EZ支架及其输送系统的上述优点外,也得益于以下因素:严格筛选病例,剔除了非动脉粥样硬化狭窄(如血管炎等)以及全身麻醉手术风险过高(如心肺功能差)的患者;本组病例治疗与首次发病平均间隔为4周,明显长于SAMMPRIS研究的7 d和VISSIT研究的9 d,降低了术中栓塞事件及术后脑出血的风险;本组病例均由经验丰富的神经介入医师完成手术,亦有利于提高手术成功率及降低并发症风险。
既往报道显示,糖尿病、病变长、残余狭窄重、C反应蛋白水平增高是颅内支架内再狭窄的危险因素[17]。对于同样经微导管释放的Enterprise支架,既往报道的再狭窄率为9.3%~33.3%不等[14,18]。本组病例中有12例患者获得DSA随访,其中2例患者(16.7%)出现支架内再狭窄,发生率与文献报道的其他类型支架类似。有6例患者因无症状或为远途外地患者,拒绝住院复查全脑DSA造影而失访,可能导致本组的再狭窄率被高估。
综上所述,本研究显示,对于经过严格筛选的复杂症状性ICAS患者,由经验丰富的神经介入医师采用经微导管释放的Neuroform EZ支架完成手术,有较高的安全性,并具有很高的技术成功率以及可接受的远期支架内再狭窄率。由于本研究为回顾性研究,且样本量较小,其结论尚待进一步扩大样本量的前瞻性临床试验验证。
