环状RNA circ-SOD2对肠上皮屏障和溃疡性结肠炎的作用
王婷婷,韩 影,高芳芳,叶 磊,张育军△
(北京大学人民医院1.中心实验室,2.消化内科,北京 100044)
溃疡性结肠炎(ulcerative colitis, UC)是一种主要累及结直肠的慢性、易复发的肠道黏膜炎症性疾病,与克罗恩病(Crohn’s disease, CD)构成炎症性肠病的主要亚型[1]。目前发达国家UC患病率约1/300,发展中国家患病率较发达国家低,但随着饮食方式的改变,发展中国家的UC发病率逐年增高[2]。UC的发病机制目前尚不完全清楚,但是基因及表观遗传学的改变参与UC的发病已有较多报道[3-4]。非编码RNA为一类不能经过翻译产生蛋白质的RNA,具有基因表达调控的作用,主要包括微小RNA(microRNA)、长链非编码RNA(long non-coding RNA, lncRNA)、tRNA、piRNA等。环状RNA(circular RNA, circRNA)属于长链非编码RNA的一种特殊类型,其长度大于200nt,一般由外显子或内含子经过3′和5′端反向剪接构成[5]。由于其特殊的环状结构可以降低其被核酸内切酶剪切降解的概率,因此环状RNA较一般的线性RNA稳定,这一特性使其成为理想的生物标志物及治疗靶点[6]。
有报道环状RNA参与了多种疾病的发生发展,包括肿瘤[7-8]及各种免疫炎症相关疾病(如骨关节炎[9]、多发性硬化[10]等)。在炎症性肠病(inflammatory bowel disease, IBD)的另一亚型克罗恩病中已有报道表明,与正常健康人相比,CD患者的结肠黏膜组织中有218个表达异常的circRNA[11],然而该文献并未对circRNA在CD发病中的作用及机制进行探讨。此外,与正常结肠组织相比,在UC癌变的动物模型AOM/DSS小鼠中发现结肠肿瘤组织有234个表达异常的circRNA,然而其亦未进行深入的功能机制研究[12]。上述研究表明,circRNA可能在肠道炎症和肠道疾病的发生中具有重要作用,但是其功能机制尚未见深入研究。环状RNA可通过与microRNA结合从而减弱其对mRNA的抑制作用,即作为microRNA海绵发挥基因表达调控作用[13]。microRNA与UC发病的关系已有较多文献报道,miR-155可通过抑制Foxo3a的表达增加促炎细胞因子的产生从而介导UC的发生[14]。MiR-223可影响IL-23通路作用于上皮细胞屏障相关分子claudin-8,其表达过量可导致肠上皮细胞屏障受损促使UC的发生[15]。MiR-301a在UC中表达上调,其表达上调可导致肠上皮细胞屏障功能减弱[16]。除了作为microRNA海绵,环状RNA还可调控基因的转录及翻译过程[17]。目前,环状RNA在UC中的表达改变及其对肠上皮细胞屏障功能的影响尚未见报道。UC的诊断需综合患者临床表现、内镜下及组织学表现、实验室检查等多个方面进行,尚未有准确的生物标志物,环状RNA因其特殊的环状结构在作为诊断标志物方面具有天然的优势,因此,检测UC患者的环状RNA表达谱改变,并确定一个作用明显的环状RNA指标作为诊断标志物具有重要的临床意义。
1 材料与方法
1.1 主要试剂
研究所使用的细胞培养所需试剂high-glucose DMEM、0.25%(质量分数)胰酶(+EDTA)、MEM、胎牛血清、磷酸盐缓冲液(PBS)均购自美国Thermo Fisher公司,RNA提取所需Trizol购自美国Invitrogen公司,反转录所用试剂盒PrimeScript RT reagent kit with gDNA Eraser购自大连Takara公司,实时荧光定量PCR(qRT-PCR)所用试剂盒iTaq Universal SYBR Green Supermix购自美国Biorad公司。所用细胞因子TNF-α、IL1-β购自美国R&D公司,脂多糖(lipopolysaccharide, LPS)购自美国Sigma-Aldrich公司,FITC-dextran(相对分子质量4 000 000)购自美国Sigma-Aldrich公司。Western blotting所需细胞蛋白裂解液RIPA购自美国Thermo Fisher公司,一抗兔抗人claudin-8购自美国Abcam公司,兔抗人ZO-1、occludin、β-actin购自美国Proteintech公司,二抗山羊抗兔抗体购自中国中杉金桥公司。
1.2 临床组织样本与细胞
收集2017年3月至2018年3月北京大学人民医院溃疡结肠炎急性期患者炎症性结直肠组织及正常结直肠组织共30对,组织的病变情况及炎症程度均经过相隔≤5 cm的邻近部位病理学确认。炎症部位取材自直肠和乙状结肠,正常部位取材自升结肠及横结肠。患者临床信息见表1,患者的临床严重程度采用Mayo评分进行评估[1]。研究所采用细胞系NCM460为北京世纪坛医院消化内科实验室惠赠,Caco2购自上海中国科学院典型培养物保藏委员会细胞库。
本研究开始前已经北京大学人民医院伦理委员会审查批准,所进行实验研究均遵循赫尔辛基宣言,UC临床组织样本的获取均经过患者知情同意并签署知情同意书。
1.3 主要实验方法
1.3.1RNA提取、反转录及实时荧光定量PCR 组织及细胞内RNA提取均采用Trizol法,RNA提取后使用NanoDrop 2000 Spectrophotometer (Thermo Scientific)进行浓度和纯度测定,纯度符合D260/D280在1.8~2.0之间的进行下一步反转录。反转录使用Takara PrimeScript RT reagent kit with gDNA Eraser试剂盒,按照说明书进行操作。使用SYBGREEN法进行实时荧光定量PCR(quantitative real-time PCR, qRT-PCR), PCR仪使用ABI公司的Step One Plus,β-actin作为内参基因,circ-SOD2的相对表达量采用2-ΔΔCt进行计算。Circ-SOD2的引物序列为:F:5′-AATGTAATCAACTGGGAGAATG-3′, R:5′-GGCTGTAACATCTCTCAGCATA-3′;β-actin引物序列为:F:5′-GTGGCCGAGGACTTTGATTG-3′,R:5′-CCTGTAACAACGCATCTCATATT-3′,引物均由北京擎科新业公司合成, PCR产物进行一代测序。
1.3.2环状RNA芯片 研究使用上海康成生物公司Arraystar Human circRNA Array V2 (8x15K, Arraystar)芯片,挑选了5对Mayo评分处于中重度的UC炎症性结直肠组织和正常结直肠组织并提取总RNA,之后用RNAse A去除线性RNA,富集circRNA。富集后的circRNA进行荧光标记,与circRNA芯片进行杂交。
1.3.3细胞培养及处理 NCM460细胞系为来源于正常人结肠组织的永生化细胞系,使用90%(质量分数)DMEM(Dulbecco’s modified Eagle medium)培养基+10%(体积分数)胎牛血清(FBS), 50 U/mL 青霉素,50 mg/L链霉素进行培养,3 d传代。Caco2细胞系为结肠腺癌细胞系,使用85%(质量分数)MEM(minimum essential medium)培养基+15%(体积分数)FBS, 50 U/mL 青霉素,50 mg/L链霉素进行培养, 4~6 d传代。细胞均接种在6孔板中,待其密度达70%~80%时,分别加入LPS(50 mg/L)、TNF-α(10 μg/L)、IL-1β(10 μg/L),刺激1~7 h后提取细胞RNA,进行qRT-PCR检测,重复3次。
1.3.4荧光原位杂交 使用广州市锐博公司RNA FISH杂交试剂盒,按照说明书进行实验。溃疡性结肠炎患者炎症结直肠组织和非炎症正常结直肠组织分别放入4%(体积分数)多聚甲醛中固定24 h后进行脱水、包埋、切片,切片厚度为4 mm。将切片经过脱蜡、复水等处理后,使用0.5%(质量分数)TritonX-100的PBS缓冲液4 ℃通透8 min,PBS洗3遍。加入预杂交液37 ℃预杂交30 min,之后加入标记荧光cy3的circ-SOD2杂交探针及缓冲液,37 ℃过夜。42 ℃枸橼酸缓冲液洗干净后,加入DAPI染核8 min,PBS洗3遍,封片。使用激光共聚焦显微镜进行图像采集。
1.3.5跨上皮细胞电阻(trans-epithelial electrical resistance, TEER)测量 将Caco2细胞消化后制成悬液,调整细胞密度为4×105/mL,将细胞接种至Costar 0.4 μm孔径的12孔Transwell小室中,上室加500 μL,下室加1.5 mL。每隔一天换一次液,培养至2周左右,使用Millicell ERS-2电阻仪测量细胞电阻,待电阻升至500 Ω·cm2时,进行circ-SOD2过表达质粒及pcDNA3.1对照质粒的转染,使用Invitrogen公司的lipoRNAimax作为转染介质,操作步骤遵循说明书。转染24、48、72 h后再次进行TEER测定,实验重复5次。
1.3.6上皮细胞渗透性(FITC-dextran透过率)检测 接种于Transwell小室中的Caco2细胞转染前及转染后24、48、72 h分别进行FITC-dextran透过率检测。将细胞原培养基弃去,换成无酚红MEM培养基,上室加入FITC-dextra,使终浓度为1 g/L,37 ℃孵育2 h后从下室吸取100 μL培养基进行荧光值测定。使用Synergy H2 microplate reader(Bio Tek Instruments)检测荧光,发射波长为492 nm,接收波长为520 nm。根据已知浓度梯度的稀释液的标准曲线荧光值计算每个小室的FITC-dextran透过率。每个实验重复5次。
1.3.7Western blotting检验 将Transwell小室的膜用手术刀切下后用细胞刮子将细胞刮下,加入RIPA裂解液裂解细胞提取细胞总蛋白。BCA法进行蛋白定量后使用10%、12%(质量分数)的分离胶和5%(质量分数)积层胶进行SDS-PAGE蛋白电泳。电泳后使用PVDF膜进行转膜,转膜条件为:CLDN-8 265 mA,1 h;闭合小环蛋白-1(zonula occluden-1, ZO-1) 285 mA,2.5 h;咬合蛋白(occludin) 265 mA 1.5 h;Actin 265 mA,1.5 h。5%(质量分数)脱脂奶粉封闭2 h,一抗孵育过夜。TBST充分洗涤后,使用山羊抗兔二抗室温孵育1 h,TBST洗3次,使用ECL发光液进行显影。显影条带使用Image J进行灰度分析。
1.4 统计学分析
使用SPSS 20.0软件和Graphpad软件进行统计学分析和绘图,UC炎症黏膜组织和正常组织间比较使用配对设计的非参数检验进行统计学分析,结果使用中位数(最小值,最大值)表示。细胞实验结果使用均数±标准差表示,使用t检验,P<0.05认为差异有统计学意义。
2 结果
2.1 环状RNA在UC中的表达谱分析
经过5对来自于UC活动期患者的炎症性结直肠组织和正常结直肠组织的circRNA芯片检测后,通过限定条件(差异倍数>1.5,P<0.05)共筛选出111个上调、153个下调的circRNA(图1A和1B)。通过限定表达谱芯片中各样本的原始信号表达值均>100进一步筛选,最终发现表达上调的circRNA排在前5位的为hsa_circ_0004662、hsa_circ_0057090、hsa_circ_0000992、hsa_circ_0002211、hsa_circ_0006006,表达下调的circRNA排在前5的为hsa_circ_0003915、hsa_circ_0007422、hsa_circ_0007919、hsa_circ_0001727、hsa_circ_0008267(图1C,表1),其中hsa_circ_0004662表达上调倍数最高,为3.49倍,且在各组织中表达值均较高(表达谱芯片中raw data>100), 其由17号染色体SOD2母本基因中外显子3和外显子5首尾相接而成,因此将其命名为circ-SOD2。
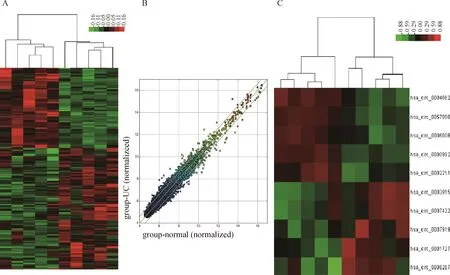
A, circRNAs’ heat map, red strips represent the upregulated circRNAs and green strips represent the downregulated circRNAs in UC inflamed mucosa tissues; B, scatter plot, the two green lines above and below represent the critical value of 1.5 fold-change of circrnas expression in UC inflammatory intestinal mucosal tissues and normal tissues, the point beyond the critical line represents the circRNAs with abnormal expression change of >1.5 times; C, the top 5 upregulated and downregulated circRNAs in UC inflamed mucosa tissues, red strips represent the upregulated circRNAs and green strips represent the downregulated circRNAs.图1 UC的环状RNA表达谱分析Figure 1 The analysis of circRNA expression profile of UC
2.2 环状RNA circ-SOD2在UC临床及细胞模型中的表达异常验证
经过上述芯片检测后进一步扩大样本量n=30,提取30例UC活动期患者的炎症及非炎症正常肠黏膜组织的RNA后进行反转录荧光实时定量PCR,验证circ-SOD2的表达情况。在UC炎症组织中circ-SOD2较正常组织表达上调了3.21倍(P<0.001,图2A)。随后对circ-SOD2及患者的临床Mayo内镜下评分进行相关性分析,发现二者无明显相关性(P>0.05),但是存在一定的趋势,即Mayo内镜下评分越高者,circ-SOD2的表达越高(图2B)。为进行下一步的体外细胞实验以研究circ-SOD2对肠上皮细胞屏障功能的影响,对肠上皮细胞系NCM460、Caco2给予LPS、TNF-α及IL1-β炎性刺激以模拟体内结肠炎环境,给予上述刺激后1~7 h每隔1 h收集细胞RNA进行circ-SOD2检测。经过qRT-PCR实验,发现在NCM460细胞及Caco2细胞经过炎症刺激后circ-SOD2表达均出现上调(图2C和2D)。
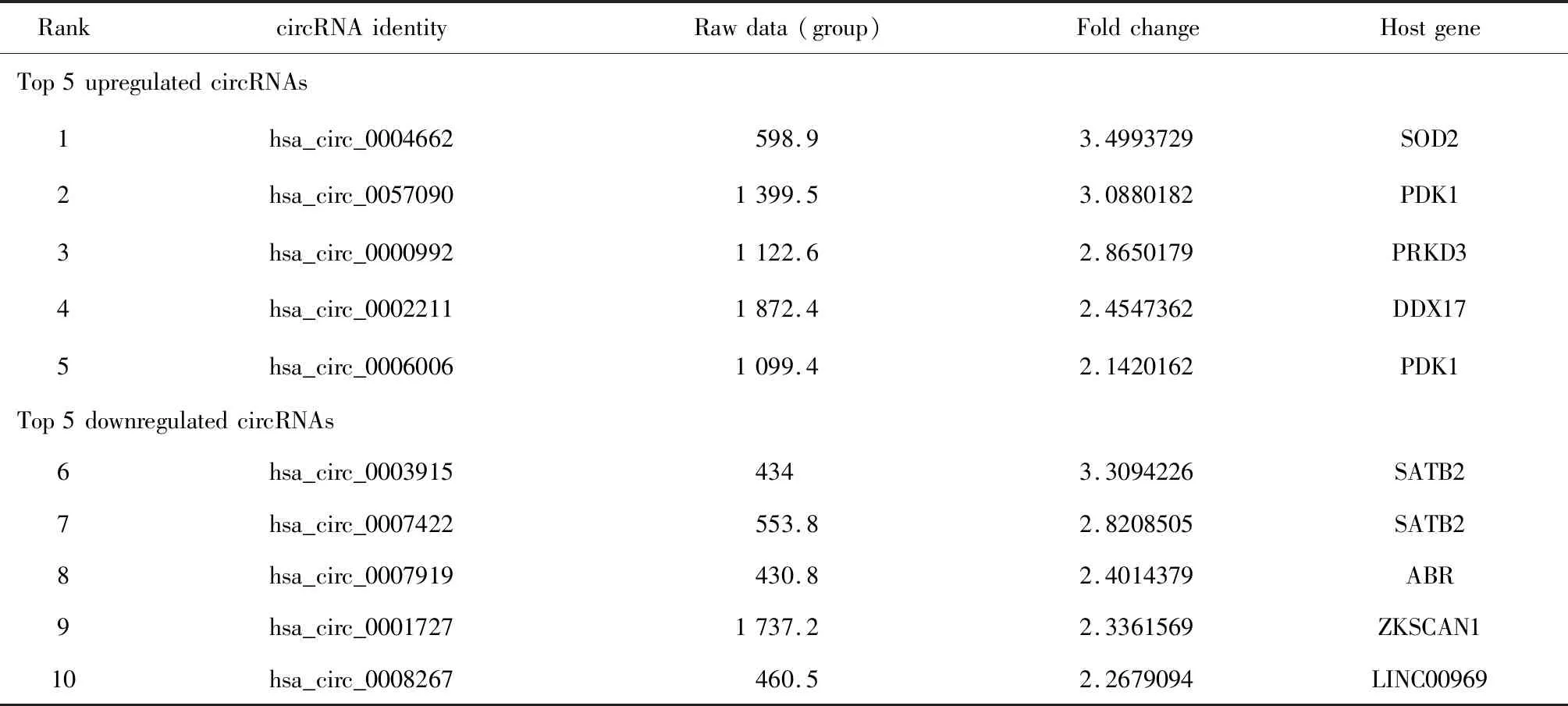
表1 差异显著的10个circRNATable 1 Top 10 differentially expressed circRNA
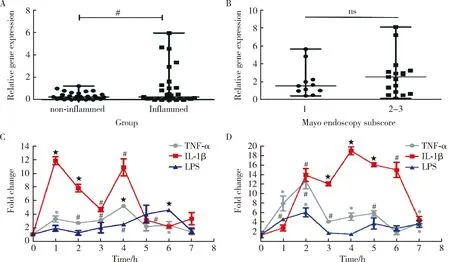
A, circ-SOD2 was significantly upregulated in UC inflamed colorectal mucosa tissues (n=30); B, the relation between circ-SOD2 expression and UC patients’ Mayo endoscopy subscore; C and D, circ-SOD2 was up-regulated in Caco2 and NCM460 cells stimulated by inflammatory factors (n=3). *P<0.05, # P<0.01, ★ P<0.001, ns, no significance.图2 circ-SOD2在UC肠黏膜组织及炎症细胞模型中的表达改变Figure 2 The expression change of circ-SOD2 in UC intestinal mucosa tissues and inflamed epithelial cells
2.3 环状RNA circ-SOD2的细胞定位及过表达载体构建
将circ-SOD2的PCR产物进行一代测序,其序列信息与数据库circbase[18]中的序列信息完全一致(图3A), 随后对circ-SOD2在UC组织中进行定位,经过荧光原位杂交实验,发现其在结肠上皮细胞中表达较高,且炎症组织较正常结肠组织明显升高,在细胞质与细胞核均有表达,但细胞质中表达更高(图3B)。根据既往文献报道[19],使用质粒pcDNA3.1作为circ-SOD2的过表达载体,并在circ-SOD2的线性结构两侧加入侧翼片段(图3C),随后,将circ-SOD2转染入Caco2细胞中,24 h后检测circ-SOD2过表达情况,发现circ-SOD2在过表达组升高了170多倍,可用于下一步实验(图3D)。
2.4 过表达环状RNA circ-SOD2对肠上皮细胞屏障功能的影响
Caco2细胞系为高分化结肠腺癌细胞,在长培养周期(>14 d)可表现出特征性的肠上皮细胞分化[20],广泛应用于肠道药物吸收及渗透性实验、肠上皮细胞屏障功能研究等,因此,选择Caco2细胞作为肠上皮细胞屏障功能研究的体外细胞模型,发现在过表达circ-SOD2组相对于pcDNA3.1空白对照组,Caco2细胞的跨上皮细胞电阻值发生明显下降(P<0.05),而FITC-dextran透过率明显升高(P<0.05,图4A和4B),这说明肠上皮细胞屏障被破坏。对肠上皮屏障相关分子CLDN-8、occludin、ZO-1的蛋白表达水平进行检测,发现CLDN-8的表达发生明显下调,而ZO-1及occludin的表达无明显改变(图4C)。
3 讨论
本研究分析了溃疡性结肠炎中环状RNA的表达谱改变,基于差异表达的circRNA筛选标准[(1)在circRNA表达谱芯片中原始信号值>100;(2)差异表达倍数>2倍;(3)差异具有统计学意义(P<0.05)], 最终锁定在溃疡性结肠炎炎症组织中上调倍数最高(3.49倍)且差异显著的circ-SOD2进一步在30对UC炎症和正常肠黏膜组织中进行验证,并探索了其表达上调后对Caco2肠上皮细胞单层屏障功能的影响。经过qRT-PCR、Western blotting、跨上皮细胞电阻及肠上皮细胞渗透性测定等一系列实验,发现circ-SOD2在UC炎症组织中表达明显上调,过表达circ-SOD2后Caco2细胞的TEER发生降低,FITC-dextran渗透性增加,肠上皮细胞屏障功能相关分子CLDN-8表达明显下调,这说明circ-SOD2可能通过调节肠上皮细胞屏障功能介导了UC的发生。
由于正常健康人的结直肠黏膜组织获取较为困难,本研究采用UC的炎症组织及非炎症性正常组织进行对比,发现异常表达的circRNA表达谱改变,以自身正常组织作为对照可减少患者之间的个体差异。此外,有研究表明,正常人结直肠黏膜组织和UC患者结直肠正常部位的肠黏膜组织中mRNA及lncRNA的表达改变不大[21-22]。关于二者之间的circRNA表达差异情况需待未来进一步的深入研究进行阐明。本研究的主要目的为锁定并探索一些circRNA分子在UC发病中的作用机制,因此检测同一UC患者的正常结直肠黏膜和炎症性结直肠黏膜的circRNA表达改变具有较高的可行性和说服力。
许多非编码RNA如lncRNA及microRNA均可通过调控肠上皮细胞的屏障功能介导UC的发生。MiR-21可通过作用于RhoB分子来调控肠上皮细胞屏障的渗透性,上调miR-21的表达后可发现Caco2细胞的RhoB和肠上皮细胞屏障相关分子occludin、ZO-1表达明显下调[23]。而本研究发现过表达circ-SOD2后,occludin和ZO-1的表达变化不明显,CLDN-8则发生明显下调。CLDN-8为细胞间紧密连接构成部分中的连接蛋白家族成员,与IL-23/Th17激活有关的UC中CLDN-8可作为IL-23通路发挥功能的重要下游分子,对肠上皮细胞屏障功能具有重要作用,miR-223可直接作用于CLDN-8,可能是IL-23影响CLDN-8表达及肠上皮细胞屏障功能的关键分子[15]。而circRNA发挥基因表达调控作用的分子机制可通过调控miRNA或直接与蛋白相互作用[17],因此推断circ-SOD2可能通过间接作用于miR-223等miRNA或直接与CLDN-8相结合,从而调控CLDN-8的表达水平,这需要下一步的研究来证实。
circRNA作为国内外学者研究的热点,在疾病的诊断及治疗方面具有巨大的潜力。UC的诊断往往需要综合临床、内镜、组织学及实验室检查等多个方面的表现,尚缺乏金标准,与克罗恩病及其他非特异性肠炎存在一定的鉴别诊断难度。本研究分析了UC炎症肠黏膜组织与正常非炎症肠黏膜组织中circRNA的表达谱改变,探索了表达明显改变的circ-SOD2对肠上皮细胞屏障功能的影响。在IBD的另一亚型克罗恩病[11]和UC癌变的动物模型AOM/DSS小鼠[12]中,均有关于circRNA改变的相关报道,然而二者均未进行深入的功能机制研究。
本研究从肠上皮细胞屏障功能层面探究了circRNA在UC中可能的作用机制,为阐明UC的发病机制提供了新的思路。未来的研究中可选取正常健康人、克罗恩病患者及其他非特异性肠炎患者与UC患者的肠黏膜组织和circRNA表达改变进行对比,找出UC特异的circRNA分子,进一步丰富UC在表观遗传学方面的探究,有助于UC的诊断及治疗决策的制定。

A, circ-SOD2 is derived from the back-splicing of exon 3 and exon 5 of SOD2; B, circ-SOD2 is highly expressed in intestinal epithelial cells of UC colorectal mucosa tissues and the expression of circ-SOD2 in inflammatory tissues was significantly higher than that in normal tissues. Circ-SOD2 was labeled with cy3 red fluorescence, the nuclei were stained with DAPI, and the magnification was ×400; C, The schema graph of circ-SOD2 overexpression vector; D, circ-SOD2 expression was significantly up-regulated after the over-expression vector was transfected into Caco2 cells (n=3), *P<0.001.图3 circ-SOD2的来源、细胞定位及过表达载体构建Figure 3 The resource and cellular localization of circ-SOD2 and construction of circ-SOD2 overexpression vector
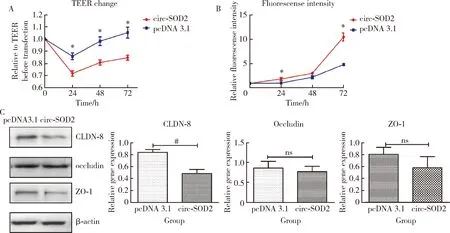
A, the transepithelial electrical resistance (TEER) of Caco2 cells decreased significantly after circ-SOD2 overexpression; B, the FITC-dextran permeability increased in circ-SOD2 over-expressed Caco2 cells; C, the overexpression of circ-SOD2 caused that the expression of CLDN-8, the barrier molecule of Caco2 cells, was down-regulated, while the expression of ZO-1 and occludin was not changed (n=5). *P<0.05, # P<0.01, ns,no significance.图4 circ-SOD2过表达后对Caco2细胞屏障的影响Figure 4 The effect of circ-SOD2 overexpression on epithelial barrier of Caco2 cells
