伴杏仁核肥大的颞叶癫痫的临床及病理特征
朱 莎,徐宗胜,夏 晴,方筱静,赵丹华,刘献增,2△
(1. 北京大学国际医院神经内科,北京 102206; 2. 北京大学人民医院神经内科,北京 100044)
颞叶内侧癫痫(mesial temporal lobe epilepsy, MTLE)是最常见的癫痫类型,往往为药物难治性癫痫。伴海马硬化的MTLE已被大量报道,同为颞叶内侧结构的杏仁核可能在MTLE中具有重要作用,却未引起足够重视,因而相关研究较少。成年起病的MTLE常常可观察到杏仁核肥大(amygdala enlargement, AE)[1]。8%的MTLE在头颅MRI的T1及Flair像上可观察到一侧AE[2],12%的“MRI阴性”的颞叶癫痫患者可发现AE[3],4%的难治性颞叶癫痫可观察到AE[4]。越来越多的研究发现痫性放电与AE为同侧,因此,AE可能是MTLE的致痫区。本研究旨在总结伴AE颞叶癫痫的临床特征、视频脑电图(video electroencephalogram,VEEG)、影像学表现及病理特点。
1 资料与方法
1.1 研究对象
收集2017年1—6月于北京大学国际医院神经内科就诊并行手术治疗的3例伴AE颞叶癫痫患者,头颅MRI的T2及Flair像均表现为非强化的AE,均无海马硬化或颅内肿瘤表现。根据临床表现、VEEG、影像学检查,由癫痫专家及放射科专家共同确诊颞叶癫痫及AE,回顾性分析患者的临床资料并进行随访。
1.2 头颅MRI检查及杏仁核体积测量
为了排除癫痫所致的脑损伤,3例均在发作7 d后行头MRI检查。采用3.0T磁共振扫描仪,应用T1加权磁化强度预备梯度回波序列(T1weighted magnetization prepared rapid acquisition gradient echo sequence,T1W1MP RAGE), 层厚1 mm,无间隔3D扫描采集大脑数据。采用西门子后处理工作站测量感兴趣区域软件,手动勾画每一层杏仁核面积,每层面积乘以层厚再相加得出体积。本研究以冠状位切面为主要测量切面,杏仁核的解剖定界参照Watson等[4]的定界标准。
1.3 VEEG监测
采用国际10-20电极放置系统,记录头皮VEEG,包括发作间期、发作期及术后定期随访头皮VEEG以及皮层VEEG,1例患者在杏仁核区域放置颅内深部电极并行VEEG监测。
1.4 单光子发射计算机断层成像术及正电子发射计算机断层显像检查
在行该检查前连续记录头皮VEEG,检查前至少6 h内无临床及亚临床发作。2例患者行单光子发射计算机断层成像术(single-photon emission computed tomography,SPECT)检查,1例行正电子发射计算机断层显像(positron emission tomography, PET)检查。
1.5 手术及病理检查
根据临床表现、VEEG、影像学表现及优势大脑半球确定手术范围,3例患者均行颞叶前极+杏仁核海马切除术,病理组织常规经苏木精-伊红(hematoxylin-eosin, HE)染色+免疫组织化学染色(包括NeuN、GFAP、NF、Nestin、MAP2和Olig2等)。
1.6 随访
术后3个月、半年分别评估临床发作情况及复查头皮VEEG。
2 结果
2.1 临床特征
3例患者中男1例、女2例,发病年龄21~40岁。2例表现为夜间入睡后继发全面性强直-阵挛发作,持续2~3 min,频率为每月1~10余次,其中1例1年后于清醒状态下出现复杂部分性发作,表现为愣神、眨眼、右手自动,持续约30 s,几乎每天均有发作。第3例表现为复杂部分性发作,如咂嘴及吐舌,持续2 min左右,睡眠、清醒状态均有发生,几乎每周均有发作。3例均伴有明显的焦虑状态,无记忆障碍。患者均无热性惊厥史,自幼发育正常,无出生时缺血缺氧性脑病病史,其中1例有可疑癫痫家族史。
2.2 头颅MRI检查结果
3.0T MRI薄层扫描显示1例为右侧AE,2例为左侧AE(图1)。
2.3 杏仁核体积测量结果
3例非肥大侧杏仁核体积为(1 276.3±156.9) mm3,肥大侧杏仁核体积为(2 123.7±131.8) mm3(表1)。
2.4 VEEG监测
2例发作间期痫性放电与AE同侧,1例发作间期痫性放电为双侧,3例均以前、中颞区为著。3例在减药及睡眠剥夺情况下行VEEG检查,发作期VEEG提示3例异常放电均起源于AE侧,并局限于前、中颞区,其中1例行立体定向引导下脑深部电极植入术,颅内深部电极VEEG监测提示异常放电由一侧颞前叶及内侧结构起始,以杏仁核为著,与MRI及头皮VEEG结果一致;另外2例术中行皮层VEEG监测,发作间期与头皮VEEG结果一致。
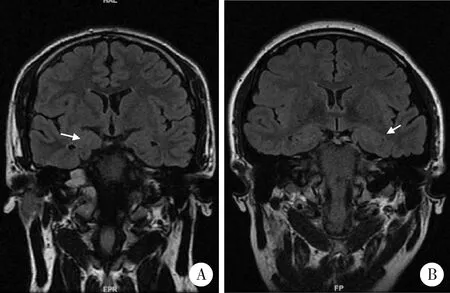
A, amygadala enlargement on the right side (white arrow); B, amygadala enlargement on the left side (white arrow).图1 头颅MRI Flair像Figure 1 Head MRI Flair image
2.5 SPECT及PET检查结果
2例行发作间期SPECT检查均未见异常,1例行发作间期PET检查表现为肥大的杏仁核低代谢(图2)。
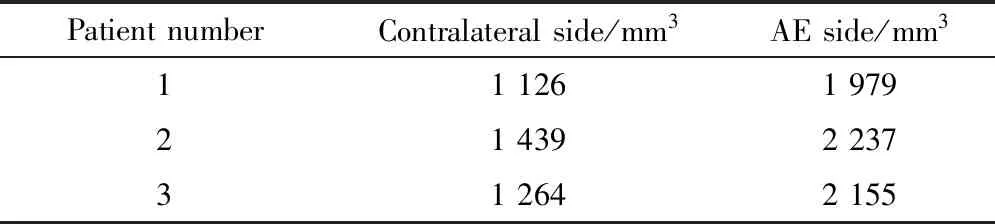
表1 3例患者的杏仁核体积Table 1 The amygdala volumes of the 3 patients
AE, amygdala enlargement.
2.6 组织病理检查结果
3例患者的组织病理检查结果为杏仁核及颞叶局灶性皮层发育不良(focal cortical dysplasia, FCD), 均表现为颞叶皮层局灶分层结构不清及柱状排列紊乱,出现气球样变神经元,杏仁核可见异型神经元及气球样细胞(图3), 其中1例海马锥体细胞数量明显减少,尤以大锥体细胞为著。根据2011年国际癫痫协会FCD分类标准,前2例为FCDⅡb型,后1例为FCDⅢa型(伴海马硬化)。
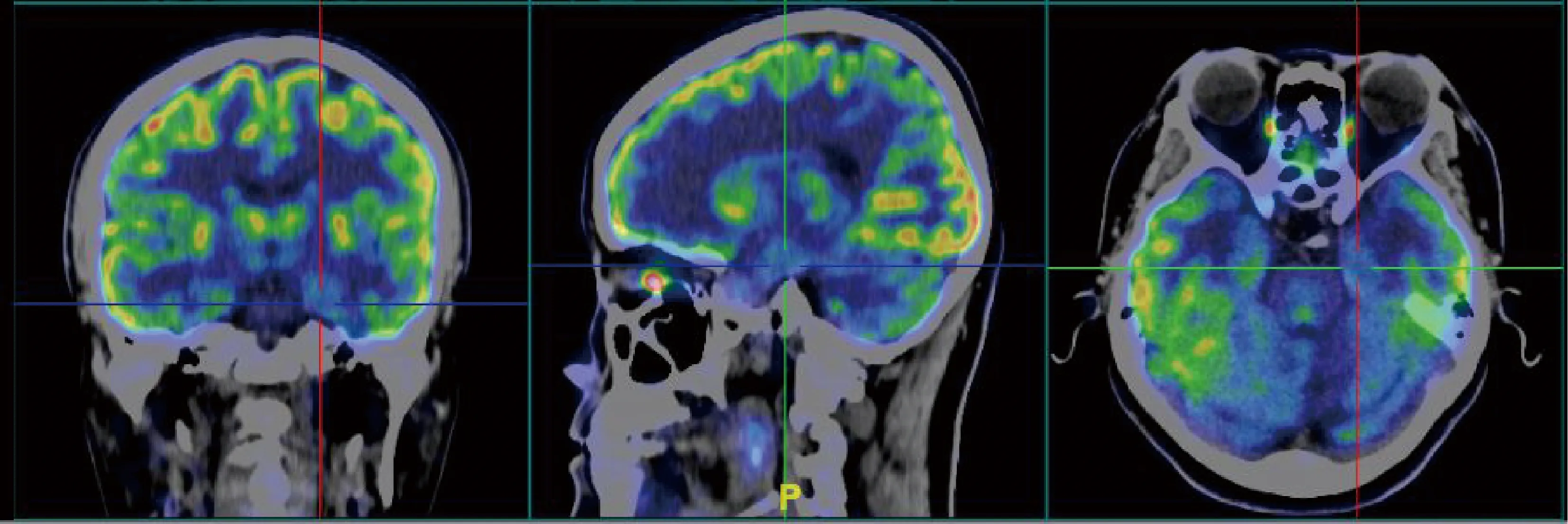
图2 PET检查显示左侧肥大的杏仁核低代谢Figure 2 Positron emission tomography examination showed hypometabolism in the enlarged amygdala on the left
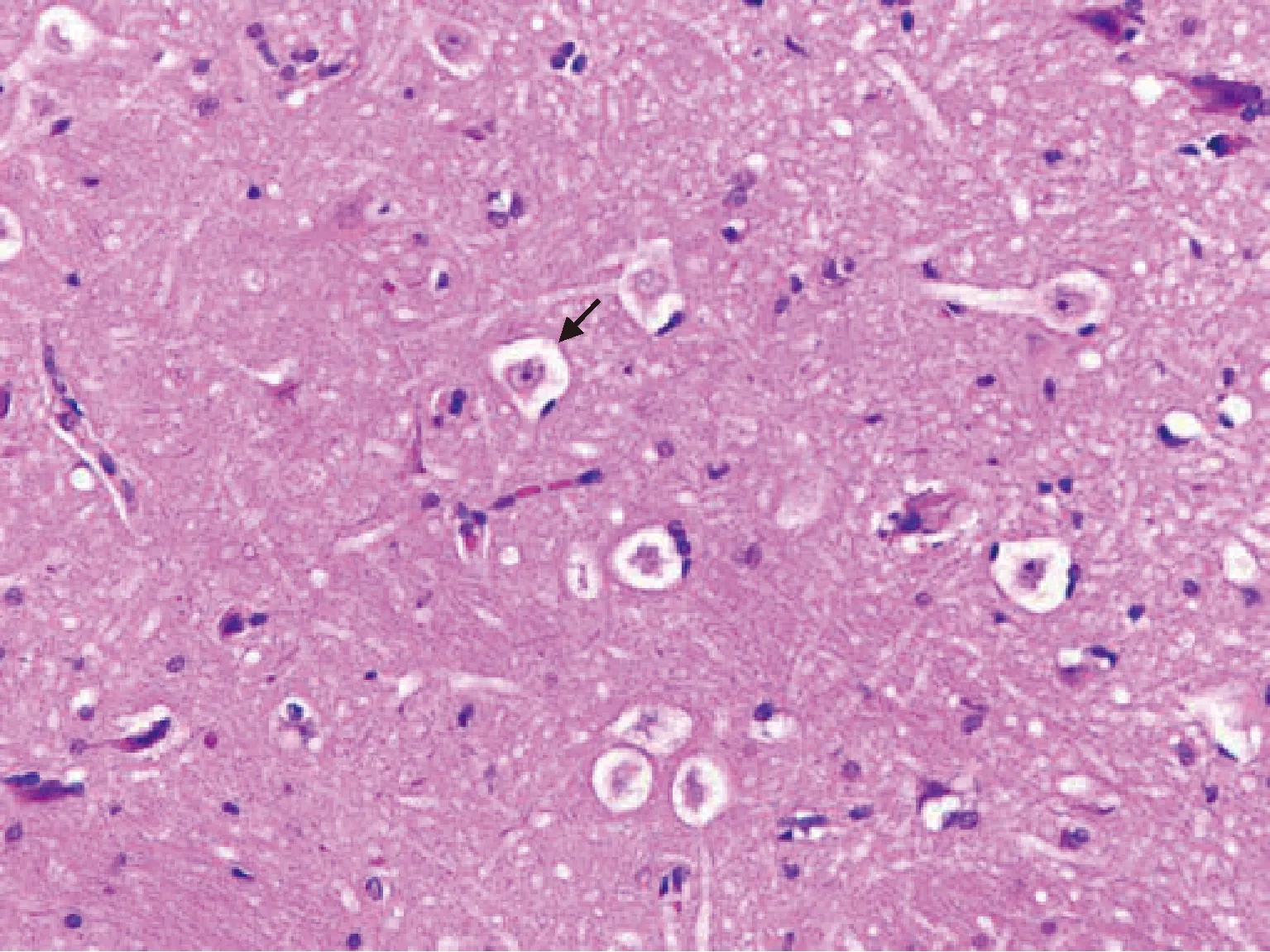
图3 杏仁核中可见气球样细胞(黑色箭头,HE ×40)Figure 3 Balloon like cells in the amygdala (black arrow, HE ×40)
2.7 随访结果
术后3个月、半年随访,患者临床无发作,VEEG提示术区术后慢波活动,偶见尖波发放(表2)。
3 讨论
颞叶内侧结构包括海马、杏仁核、内嗅皮质及梨状皮质,对致痫性损伤尤其敏感。MTLE通常以海马硬化为特征,有关杏仁核与癫痫的研究较少,一方面由于杏仁核解剖界限难以辨认[5-6],另一方面,尚不能通过常规方法精准定位异常放电起源于杏仁核。近年来,在“MRI阴性”的颞叶癫痫中可观察到AE[3,7]。“MRI阴性”被定义为无皮层病变,无海马硬化,无颞叶内侧结构的信号增高,但无法完全避免术后组织病理可能为海马硬化[8]。
迄今为止,杏仁核的体积通常采用以下4种方法确定:(1)MRI肉眼直接观察确定,(2)手动测量杏仁核复合体,(3)基于体素的MRI形态分析(voxel based morphometry, VBM)方法,(4)FreeSurfer软件自动测量[9]。本研究利用高分辨MRI,采用手动绘出杏仁核的边界,进而测量杏仁核体积。本研究中,肥大侧杏仁核的体积明显大于非肥大侧,但由于样本量少,未设立正常对照,这是本研究的不足之处。目前,国内关于正常人群杏仁核体积测量的最大样本数据为956.45~1 584.3 mm3[10],与该研究相比,本研究非肥大侧杏仁核体积在其正常范围内,但肥大侧体积明显高于其正常范围。
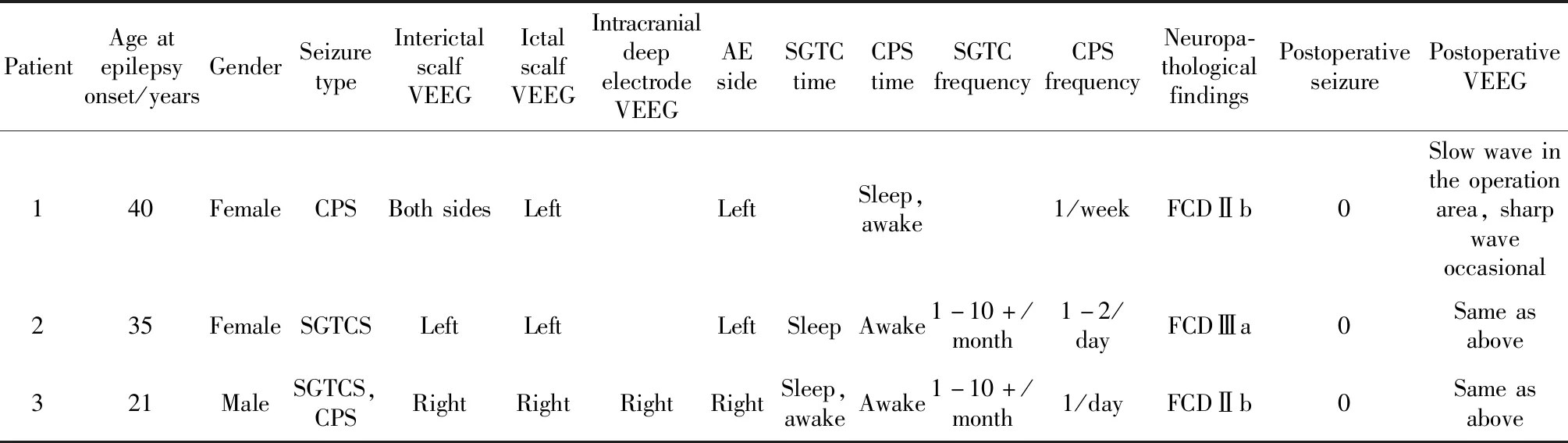
表2 3例伴杏仁核肥大的颞叶癫痫患者的临床资料Table 2 Clinical data of 3 patients with temporal lobe epilepsy with enlarged mygdale
CPS, complex partial seizures; SGTCS, secondarily generalized tonic-clonic seizure; VEEG,video electroencephalogram; AE, amygdala enlargement; SGTC, secondarily generalized tonic-clonic; FCD, focal cortical dysplasia.
本研究显示,3例伴AE颞叶癫痫患者的发病年龄均在成年以后,临床表现以复杂部分性发作为主,伴有明显的焦虑状态,发作间期痫性放电与AE同侧,异常放电以前、中颞区为著,组织病理结果为局灶性皮层发育不良。既往研究发现,与海马硬化相比,伴AE颞叶癫痫发病的患者年龄偏大,有文献报道平均年龄为32.2岁,3~75岁均可发病,以复杂部分性发作常见,很少出现继发全面性强直-阵挛发作[9]。本研究3例患者的发病年龄为21~40岁,2例虽临床表现为全面性强直-阵挛发作,但发作期头皮VEEG显示颞区起源,从而推测为继发全面性强直-阵挛发作。本研究中2例继发于复杂部分性发作的继发全面性强直-阵挛发作均在夜间睡眠中发生,既往研究发现,14%的病例在入睡后出现继发全面性强直-阵挛发作[11],说明伴AE颞叶癫痫出现继发全面性强直-阵挛发作并不是偶然现象,但其原因目前还没有合理的解释,需要进一步研究。杏仁核的功能与情感、精神行为及认知有关,故颞叶癫痫患者常伴有精神行为障碍。在不伴海马硬化的颞叶癫痫中,AE与焦虑及精神障碍有关[12-13],本研究3例患者的临床症状均伴有焦虑障碍,与文献报道一致[11]。
动物试验研究发现,杏仁核可能点燃惊厥发作[14],临床研究显示,直接刺激杏仁核可引起复杂部分性发作[15]。颅内脑电图研究表明,5%~10%的颞叶癫痫起源于杏仁核[7,16]。近来,Wieser[17]通过颅内深部电极发现5%的颞叶癫痫异常放电起源于杏仁核。Bartolomei等[18]和Takaya等[19]通过深部电极同样发现MTLE的异常放电可起源于杏仁核。本研究2例患者发作间期痫性放电与AE同侧,1例患者发作间期痫性放电为双侧性分布,且异常放电以前、中颞区为著,3例发作期VEEG异常放电均起源于AE侧,其中1例脑深部电极显示发作期异常放电起源于肥大杏仁核区,推测肥大杏仁核可能为颞叶癫痫亚型的致痫区。
伴AE颞叶癫痫的发病机制并不明确,可能与神经发育异常[如FCD、良性肿瘤(如错构瘤)或者低级别胶质瘤和神经免疫炎性疾病]有关[19-20]。有研究报道在颞叶癫痫中,神经免疫疾病可能是成年起病的原因之一[21]。癫痫是自身免疫性脑炎的重要表现,而持续的慢性炎症可能导致AE[16]。本研究3例患者血液检查均未发现肿瘤、免疫等因素,但遗憾的是3例患者均未进一步筛查脑脊液的相关指标,说明神经免疫等因素在颞叶癫痫中并未引起足够重视。对于成年起病的颞叶癫痫,若有神经免疫因素参与发病过程,通过免疫调节治疗,癫痫可能得到有效控制,因而建议完善脑脊液检查,进一步除外副肿瘤及神经免疫因素。既往研究发现,伴AE的颞叶癫痫患者术后组织病理最常见的为FCD。本研究3例患者术后组织病理均为FCD,推测FCD可能为AE最重要的病因。以往文献报道,仅不到20%的伴AE颞叶癫痫病例有热性惊厥史[9],本研究3例患者均无热性惊厥史,推测热性惊厥与发病无关。
研究显示,伴AE颞叶癫痫患者的SPECT及PET检查多表现为肥大杏仁核低灌注及低代谢,也可表现为正常。约91%~100%的病例PET检查显示AE侧颞叶内侧低代谢[9]。另有研究证实,100%的患者发作间期PET表现为低代谢,78%的患者发作间期SPECT表现为低灌注[22]。本研究仅1例患者行PET检查,显示低代谢,另外2例行SPECT检查未见异常,难以确定PET与SPECT检查的一致性。
与伴海马硬化颞叶癫痫相比,伴AE颞叶癫痫对抗癫痫药物(antiepileptic drugs,AEDs)的反应好。有研究对33例伴AE颞叶癫痫患者给予常规AEDs治疗,发现经过半年到1年的随访,67%的患者未再发作且肥大杏仁核体积缩小,33%的患者起始疗效还可以,但逐渐出现疗效减退现象,而且杏仁核体积没有明显变化,据此推测杏仁核可能为致痫区[11]。Kimura等[22]发现,伴单侧AE颞叶癫痫的患者给予卡马西平治疗为主,74%的患者获得完全缓解,17%明显改善,9%为难治性癫痫,难治性癫痫最终行手术治疗,术后随访8~10年未再发作。Kim等[23]对12例伴AE难治性癫痫行手术治疗,99%的患者未再发作。研究显示,伴AE颞叶癫痫术后组织病理主要为FCD及低级别胶质瘤,最常见的是FCD。Kim等[23]的研究显示8例患者术后病理为FCD(其中5例合并海马硬化), 2例为神经节神经胶质瘤,1例为星形细胞瘤,1例为少突神经胶质瘤。低级别胶质瘤容易侵犯颞叶内侧区域,包括杏仁核,通常缺乏影像特征,如钙化、囊性改变和强化[24]。伴AE颞叶癫痫的患者,如果病理检查确诊为肿瘤,与非肿瘤性患者相比,发病年龄通常更小,而且常表现为药物难治性癫痫[23]。本研究中3例患者均表现为药物难治性癫痫,最终行海马杏仁核切除术,术后组织病理均显示杏仁核及颞叶FCD,未发现肿瘤。根据2011年国际癫痫协会FCD分类标准,2例为FCDⅡb型,1例为FCDⅢa型,即伴海马硬化。FCD与海马硬化共存已被广泛认识,海马硬化可能为FCD所致的颞叶癫痫继发性改变[25]。
综上所述,AE可能为颞叶癫痫的一种亚型,临床中应注意在“MRI阴性”的颞叶癫痫患者中是否存在AE的可能,当药物治疗难以控制发作时,手术治疗具有良好效果,FCD可能是伴有AE颞叶癫痫的最常见的组织病理特点。
