rhEPO减轻糖尿病大鼠尿蛋白排泄机制的实验研究
刘慧娟 黄 雯 张 梅 陈 燊
糖尿病肾病是主要的糖尿病微血管并发症之一,肾小球内皮细胞是肾小球滤过屏障的重要组成部分,直接受到血液中高浓度血糖、糖基化蛋白终末产物和氧化应激反应的影响。肾小球内皮细胞的损伤产生细胞因子和血管活性物质还影响肾小球足细胞的生物学行为,从而影响肾小球滤过屏障的功能。
内皮祖细胞(EPCs)是存在于循环血液中的骨髓来源的细胞,同时具有干细胞和内皮细胞的生物学标志。EPCs的数量和功能的变化能直接反映内皮细胞功能损伤。有关内皮祖细胞的研究显示,1型和2型糖尿病患者循环内皮祖细胞的数量和功能都较正常人有所下降,其数目和功能的下降与血管内皮功能失调及血管修复能力下降密切相关[1]。目前EPCs修复内皮细胞损伤的研究多以体外培养扩增,体内移植为基础,能否通过药物治疗来改善EPC的数量和功能,成为国内外新的研究方向。重组人促红细胞生成素(rhEPO)是一种调节红细胞生成的糖蛋白类激素,主要作用为诱导骨髓原始红细胞分化,促进外周血红细胞生成。近年来,研究发现促红细胞生成素除了治疗贫血外,还可以动员骨髓EPCs到外周血中,在血管新生中发挥重要作用[2~5]。实验也证实了rhEPO在体外可以增强EPCs的活性,其增殖、黏附和迁移功能是与其参与血管新生直接相关的[6]。
材料与方法
1.实验动物:SD大鼠,雄性,鼠龄6~8周,体质量170~190g,购自北京维通利华实验动物技术有限公司(实验动物许可证号为SKXK京2012-0001),适应性喂养5天后进行实验。试验组(28只):按60mg/kg一次性腹腔快速注射2%的STZ液。对照组(NC组)7只:按60mg/kg一次性腹腔注射柠檬酸钠-柠檬酸缓冲液。在注射STZ后72h采集两组动物的尾静脉血,用快速血糖测定仪测定血糖,血糖浓度>16.7mmol/L判定为1型糖尿病动物模型。模型不达标者,3天后以40mg/kg再次腹腔注射2%的STZ液。随机将实验组大鼠分为3组:①糖尿病组(DM组)9只;②应用25U/kg的rhEPO治疗组(DMTA组)9只;③应用50U/kg的rhEPO治疗组(DMTB组)10只。每周3次,连用8周。EPO注射8周后处死所有大鼠。
2.实验仪器:XN-1000全自动血液分析仪 (日本Sysmex公司);UniCel Dxi 800全自动化学发光免疫分析仪(德国Becman Counter公司);NovoCyte D206OR 流式细胞仪(艾森生物杭州有限公司)。
3.实验试剂:重组人促红细胞生成素(rhEPO)(益比奥,沈阳三生制药公司);兔抗大鼠VEGFR-2多克隆抗体、小鼠抗大鼠JG12单克隆抗体、PE标记的小鼠抗大鼠CD34多克隆抗体[艾博抗(上海)贸易有限公司];链脲佐菌素(STZ)(北京博爱港经贸中心)。
4.大鼠血压测量:37℃条件下预加温5min后固定尾动脉,使用大鼠智能无创血压测定系统测定大鼠血压。每只大鼠重复测量3次,取平均值。
5.标本留取检测血、尿相关指标:处死前24h将所有大鼠单个置于代谢笼中。(1)尿液:收集24h尿标本,离心后取上清测尿微量白蛋白含量。(2)血液:2%戊巴比妥钠按40mg/kg腹腔给药,麻醉后,从腹主动脉取血5ml,其中3ml用来检测血清尿素氮(BUN)、血肌酐(Scr)、白蛋白(ALB),另2ml用2%EDTA抗凝,行血常规及裂解红细胞后流式细胞仪检测。ELASA法测定尿微量白蛋白(按照说明书操作)。
6.大鼠外周血EPCs的分离、鉴定:(1)CD34/VEGFR-2双阳性细胞的标记方法(VEGFR-2为间接标记):①取100μl血样至ISO和Test管,加红细胞裂解液1ml,震荡仪震荡,反应8min后离心,弃去上清液。1%BSA-PBS缓冲液洗涤;②加入VEGFR-2抗体(间接标记一抗)1μl,混匀,4℃孵化1h。1%BSA-PBS缓冲液洗涤;③加APC标记的羊抗兔二抗1μl(10μl二抗+90μl PBS稀释浓度为0.2μg/μl),再加PE标记的CD34抗体5μl,混匀,4℃避光孵化1h。1%BSA-PBS缓冲液洗涤;④加入1%BSA-PBS缓冲液0.5ml重悬细胞,流式细胞仪检测荧光值,每管计数50000个细胞。(2)流式细胞术检测:经流式细胞仪计数时,首先根据FSC/SSC设门,在散点图中圈选单个核细胞区域,排除双联体细胞、血小板、细胞碎片、微颗粒等杂质,依据CD34SSC设第2个门,圈定PE-CD34阳性的细胞群区域,第3个门用来选取CD34和VEGFR-2双阳性细胞,并在收集50000个细胞后停止检测,计数CD34和VEGFR-2双阳性细胞。
7.免疫组织化学:①脱蜡、水化组织切片,进行抗原热修复;②3%H2O2去离子水孵育5~10min,阻断内源性过氧化物酶;③滴加JG-12一抗(1∶100),4℃冰箱过夜;④滴加二抗,室温孵育40min;⑤0.05% DAB显色,镜下控制染色结果;⑥蒸馏水充分冲洗,苏木精复染,梯度乙醇脱水,二甲苯诱明,中性树胶封片。JG12免疫组化分析:根据肾小球染色结果,每张切片随机选取10个肾小球,经QUIN软件划出肾小球的范围,显示肾小球面积,选中肾小球中染色阳性的区域,显示染色阳性面积,计算JG12与肾小球总面积的比值,然后取平均值。

结 果
1.rhEPO对糖尿病大鼠血Scr、血BUN、血ALB、血红蛋白、血压、血糖和肾重量/体质量的影响:于皮下注射EPO 8周后,发现糖尿病组血BUN较对照组明显升高(P<0.05),血ALB较对照组明显降低,应用rhEPO治疗后血Scr、血ALB水平与糖尿病组比较,差异无统计学意义(表1)。各组大鼠血压无变化,糖尿病组血糖和肾重量/体质量较对照组明显升高,应用rhEPO后无变化(表2)。
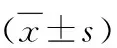
表1 各组大鼠8周血Hb、HCT、BUN、Scr、ALB的变化
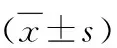
表2 各组大鼠8周血糖、肾重量/体质量比、血压的变化
2.rhEPO对糖尿病大鼠24h尿微量白蛋白的影响:rhEPO皮下注射8周后,检测各组大鼠24h尿微量白蛋白,发现糖尿病组24h尿微量白蛋白较对照组显著增高,DMTB组24h尿微量白蛋白较糖尿病组显著降低,而DMTA组尿微量白蛋白有降低趋势,差异无统计学意义(表3)。

表3 各组大鼠8周24hUAlb的变化
3.rhEPO对糖尿病大鼠肾脏Aminopeptidase P(JG-12)表达的影响:DM组肾小球JG12表达均较对照组显著减少(P<0.05),应用rhEPO治疗后,JG-12表达增加,大剂量组增加更为明显(P<0.05,图1、图2)。

图1 JG12免疫组化染色(×400)A.NC组;B.DM组;C.DMTA组;D.DMTB组
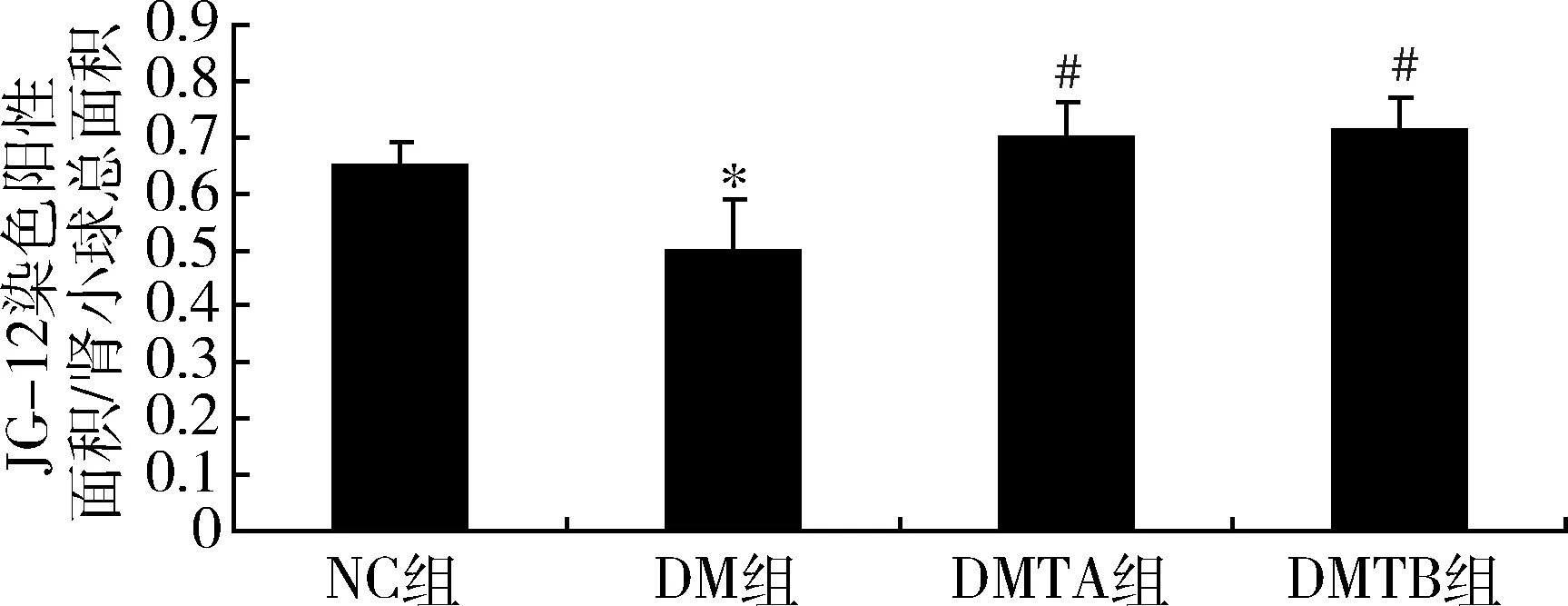
图2 肾小球毛细血管JG-12的表达与NC组比较,*P<0.05;与DM组比较,#P<0.05
4.rhEPO对糖尿病大鼠外周血EPCs的影响:应用rhEPO治疗糖尿病大鼠后,其外周血中EPCs的数量有增加趋势,呈剂量依赖性,DMTB组EPCs数量增加更为明显,但差异无统计学意义(图3、图4)。
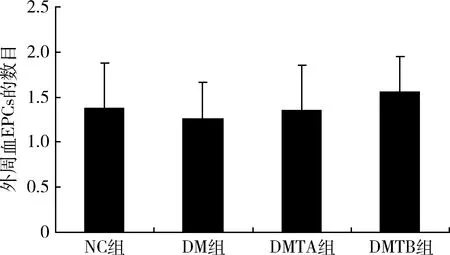
图4 外周血EPCs的数目
讨 论
糖尿病肾病(DN)临床表现为蛋白尿、渐进性肾功能损害或晚期出现严重肾衰竭,是患者的主要死亡原因之一。本实验结果显示,糖尿病大鼠24h尿微量白蛋白排泄明显升高,较高剂量rhEPO治疗组与糖尿病组比较,尿微量白蛋白显著下降。较低剂量的rhEPO治疗组尿微量白蛋白排泄亦有下降趋势。
在糖尿病肾病进展的患者中,肾小球毛细血管的减少是肾小球滤过率下降的关键事件,伴随着微血管的塌陷,缺氧的环境提供了纤维化的潜在刺激,导致以肾小球硬化和肾间质纤维化为特点的晚期糖尿病肾病[7]。JG-12是毛细血管的特异性标志物。在本研究中,选取JG-12作为肾小球内皮细胞的标志物检测各组大鼠微血管内皮的损伤和修复。实验结果显示,糖尿病大鼠肾小球JG-12表达明显减少,说明在STZ糖尿病大鼠出现的肾脏微血管病变以肾小球微血管内皮损伤和毛细血管的萎缩、减少为特征性表现,与以往的研究结果一致[8]。内皮细胞数量减少、功能受损、毛细血管萎缩、丢失等微血管病变导致肾组织慢性缺血、缺氧和营养供应缺乏。内皮是接触血液的首个屏障,血管内皮细胞一旦出现损伤,其合成和释放多种血管活性物质(如NO)和细胞因子(如血管内皮生长因子VEGF)之间的平衡被打乱,引起功能障碍,可累及人体多个脏器。
结合前期的研究,笔者认为内皮细胞的损伤直接影响其旁分泌细胞因子和血管活性物质,以及与肾小球系膜细胞、足细胞和肾小管上皮细胞、肾间质成纤维细胞的信号交流,内皮细胞本身的表型亦发生改变,致使组织损伤和保护因素之间的平衡被打破,是肾脏进一步损伤的基础[9~11]。STZ大鼠的微量白蛋白尿排泄增加和内生肌酐清除率的上升与此有关。此时,内皮损伤若不及时修复将会导致病变加重直至肾小球硬化和肾间质纤维化。
在内皮损伤的修复方面,多项研究认为,骨髓来源的、存在于循环中的具有血管生成潜能的细胞对内皮细胞的修复是主要的修复方式[12,13]。内皮祖细胞即是具备内皮生成潜质的细胞,它可以增殖、分化并移行至损伤部位成为内皮细胞,执行其功能[14~16]。目前,相关的实验研究主要是将骨髓或外周血中的内皮祖细胞收集,体外培养,增殖至一定的数量回输[17,18]。实验在体外进行,耗时长,治疗间断进行,回输的细胞在体外培养有表型转变的风险。因此,本研究尝试寻找促使体内内皮祖细胞补充的方法。
促红细胞生成素(erythropoietin,EPO)是最早发现并应用于临床的造血因子之一,除了具有治疗贫血、抗炎、抗氧化应激等作用外,还可以刺激内皮祖细胞介导的内皮恢复,在组织局部缺血部位参与新生血管的形成。本研究中,应用EPO治疗的大鼠,尿微量白蛋白明显下降,肾小球JG-12表达明显增加,提示肾小球微血管内皮损伤得到了一定程度的修复。同时,rhEPO治疗的糖尿病大鼠,尿微量白蛋白排泄较糖尿病组大鼠减少,并呈剂量依赖,提示肾脏结构及功能得到改善,与微血管内皮损伤的修复有关。大鼠应用EPO皮下注射8周后,发现外周血内皮祖细胞数量有升高趋势,且与剂量呈正相关,这与报道相一致[8]。在本研究中,糖尿病大鼠经rhEPO干预后,毛细血管的标志JG-12的变化与循环内皮祖细胞的变化趋势一致,笔者推测内皮祖细胞可能直接参与了内皮损伤的修复。但外周血内皮祖细胞只有升高趋势,差异无统计学意义。其可能的原因为EPO促进EPCs增加,这与高血糖所致的EPCs减少尚未达到一定的平衡有关,模型时间只有8周,或还不足以引起外周血中EPCs的明显差异,可能通过延长实验时间或调整剂量明确EPCs的变化,这有待于进一步研究。
近年来研究发现刺激EPCs的骨髓动员,可使其迁移到损伤组织,分化成内皮细胞并形成新生的血管,EPCs不仅参与胚胎血管生成,也参与出生后的血管新生过程。新生血管中25%的内皮细胞是由EPC分化而来的[19,20]。EPC通过自身的分化、增殖而形成的新生血管不受原有血管内皮细胞功能的影响,且受损的内皮层可由循环EPC重生,EPC可促进重新内皮化。有研究表明,糖尿病患者的内皮祖细胞除了数量下降,其迁移和归巢功能也有一定程度的减弱[18]。本研究仅就EPO对糖尿病大鼠循环内皮祖细胞数量的变化与肾脏结构功能的变化的关系进行了探讨,但EPO可能对内皮祖细胞的内皮修复作用在迁移、归巢、分化等不同的环节有更多的作用,需要实验进一步研究。

