T3对缺氧/复氧致小鼠心肌细胞凋亡的影响
廖小婷 曾 彬 刘 磊
急性缺氧和复氧损伤是一种常见的环境应激状态,可造成一系列病理生理过程,包括急性氧化应激损伤、线粒体功能障碍和炎症[1,2]。发生急性心肌梗死后,常并发严重的缺血再灌注损伤。越来越多的研究证明甲状腺激素对胚胎心肌的发育至关重要,且成年后甲状腺激素通过激活发育基因编程来调控心脏修复或再生[3,4]。本研究采用体外培养乳小鼠原代心肌细胞,进行缺氧及缺氧/复氧损伤来模拟体内缺血及缺血再灌注损伤,并对缺氧复氧细胞进行T3预处理,通过形态学观察、流式细胞技术、JC-1免疫荧光染色、Western blot法检测细胞凋亡,研究不同缺氧时间及缺氧/复氧对心肌细胞的损害程度,以及运用甲状腺素T3对心肌细胞的影响。
材料与方法
1.实验材料:(1)动物:1~2天龄的新生昆明乳鼠,雌雄不限,由湖北省实验动物中心提供。(2)试剂:DMEM-F12培养基(美国Hyclone 公司),胎牛血清(美国Gibico 公司),胰酶(美国Beyontime 公司),胶原酶Ⅱ(美国Sigma 公司),PBS液,青-链霉素抗生素(杭州吉诺生物医药技术有限公司),Annexin V-FITC细胞凋亡试剂盒(天津三箭生物技术有限公司),JC-1试剂盒(北京索莱宝科技公司),兔抗鼠抗磷酸化Akt多抗(美国CST公司),兔抗鼠抗磷酸化PI3K多抗(英国Abcam公司),辣根过氧化物酶(HRP)标记的羊抗兔二抗(美国Aspen公司)。
2.心肌细胞培养:采用改良的两步法分离培养心肌细胞[5]。取1~2天的新生乳小鼠,取出心脏,置于预冷PBS缓冲液中清洗2~3遍,修剪心脏,减去多余的血管、心房及心外膜组织。在0.125%胰酶中将心脏稍稍剪开但不剪碎,将心脏组织吸入15ml离心管中,加入0.125%胰酶10ml静置,4℃过夜(10~12h)。第2天,吸出上清液,加入含0.035%胶原酶Ⅱ的消化液6ml,置于37℃水浴轻轻振摇3~5min,待液体变混浊后及停止消化,重复消化6~7次。将收集的上清液以1000r/min离心10min,弃上清,加入适量含15%胎牛血清的完全培养液(1%青-链霉素抗生素)重悬细胞,接种于10cm培养皿中进行差速贴壁1h去除成纤维细胞,将细胞悬液种于35mm培养皿中,细胞密度为1×106,培养24h后,用倒置显微镜观察。
3.心肌细胞缺氧及缺氧/复氧模型的建立:模拟心肌缺血损伤,细胞贴壁完全且搏动良好后,吸去培养液,加入2ml不含血清的DMEM无糖培养基,置于三气培养箱(94%N2、5%CO2、1%O2,37℃)中培养。心肌细胞缺氧/复氧模型的建立:模拟心肌缺氧/复氧损伤,细胞贴壁完全且搏动良好后,吸去培养液,加入2ml不含血清的DMEM无糖培养基,置于三气培养箱(94%N2、5%CO2、1%O2,37℃)中培养,后弃去培养液,加入含15%胎牛血清的培养液2ml,放入培养箱(37℃、5%CO2)中复氧,即完成缺氧/复氧过程。T3预处理:心肌细胞缺氧/复氧处理前,细胞培养液中加入20μmol/L T3孵育24h,缺氧时,换用含20μmol/L T3的2ml不含血清的DMEM无糖培养基,复氧时加入含20μmol/L T3的2ml完全培养液。
4.实验分组:分离的原代心肌细胞培养48h后,心肌细细胞缺氧及缺氧/复氧模型建立分组:正常对照(control)组;缺氧2h(H2)组;缺氧4h(H4)组;缺氧6h(H6)组;缺氧8h(H8)组;缺氧4h/复氧2h(H4/R2)组。T3药物效应分组:正常对照(control)组;缺氧5h复氧2h(H/R)组;T3预处理+缺氧/复氧(T3+H/R)组。
5.心肌细胞状态及搏动频率观察:将完成缺氧、缺氧/复氧及正常培养细胞进行境下观察,观察细胞状态,搏动强度并计数细胞搏动频率。
6.流式细胞分析:细胞进行不同处理后,用0.25%胰酶1ml洗涤2~3min,收集细胞悬浮液及培养液进行流式细胞仪检测,以Annexin V-FITC及PI双染分析细胞凋亡情况。每组用胰酶消化细胞后,将细胞浓度调整为106/L的细胞悬液,每组加入195μl的FITC结合液,再加入5μl FITC染液,室温避光孵育15min,后每组加入5μl碘化丙啶(PI)染液,室温避光孵育5min,在流式细胞仪(美国BD公司)上进行细胞凋亡分析。左下象限:活细胞比例,Annexin V阴性-PI阴性的细胞;右下象限:凋亡早期细胞比例,Annexin V阳性-PI阴性的细胞;右上象限:晚期凋亡细胞比例,Annexin V阳性-PI阳性的细胞;左上象限:操作过于剧烈而发生机械损伤的细胞,Annexin V阴性-PI阳性的细胞。凋亡细胞的比例即为凋亡早期细胞比例+凋亡晚期细胞比例。
7.线粒体膜电位检测:对于control组、H/R组及T3+H/R组,细胞进行相应处理后,吸去培养液,用PBS洗3遍,加入1ml JC-1染色工作液,37℃避光孵育20min,后弃上清,用JC-1染色缓冲液(1×)洗涤3次,吸去多余的染色工作液,加入1ml含胎牛血清的完全培养液,于倒置荧光显微镜下观察拍照。检测 JC-1 单体时可以把激发光设置为 490nm,发射光设置为 530nm;检测 JC-1 聚合物时,可以把激发光设置为 525nm,发射光设置为 590nm。
8.Western blot法检测凋亡蛋白表达:取control组、H/R组及T3+H/R组细胞,加入裂解液进行蛋白提纯,采用BCA法进行蛋白定量,SDS-PAGE电泳,转膜,5%脱脂牛奶室温封闭1h,然后用兔抗鼠cleaved caspase-3(稀释度 1∶500,英国Abcam公司,货号4060)以及兔抗鼠Bax(稀释度 1∶2000,美国CST公司,货号ab18250)抗体4℃孵育过夜。次日用辣根过氧化物酶(HRP)标记的羊抗兔二抗(稀释度1∶10000,美国Aspen公司,货号AS1107)室温孵育1h,化学发光法(ECL)显影。采用凝胶成像系统(美国UVP公司)进行分析,以目的蛋白条带灰度值与β-actin条带灰度值的比值反映Bax 和cleaved caspase-3的表达。

结 果
1.显微镜下观察细胞形态:刚开始接种的心肌细胞成球形,悬浮于培养液中,12h后观察已有心肌细胞贴壁生长,24h后,大部分细胞已经贴壁,呈三角形或不规则的星行,大部分细胞开始搏动,搏动频率不一;48h后观察心肌细胞全部贴壁,并伸出伪足,相互交接成网,并形成单层和放射状排列的细胞簇,且心肌细胞搏动同步化,搏动频率一致,约100次/分左右。心肌细胞经过缺氧处理后细胞搏动能力减弱,搏动频率降低,计数不同处理组细胞的搏动频率(表1),与正常培养细胞比较,缺氧损伤导致心肌细胞搏动能力减弱,搏动频率降低;缺氧时间越长,心肌细胞搏动频率越低(P<0.05)。
2.缺氧及缺氧/复氧对心室肌细胞凋亡的影响:采用流式细胞仪检测心肌细胞凋亡率,缺氧损伤后,心肌细胞凋亡率明显增加,随着缺氧时间的延长,细胞凋亡率逐渐增加;且与单纯缺氧损伤比较,缺氧/复氧损伤显著增加细胞凋亡率(图1),各组心室肌细胞凋亡率见表1。
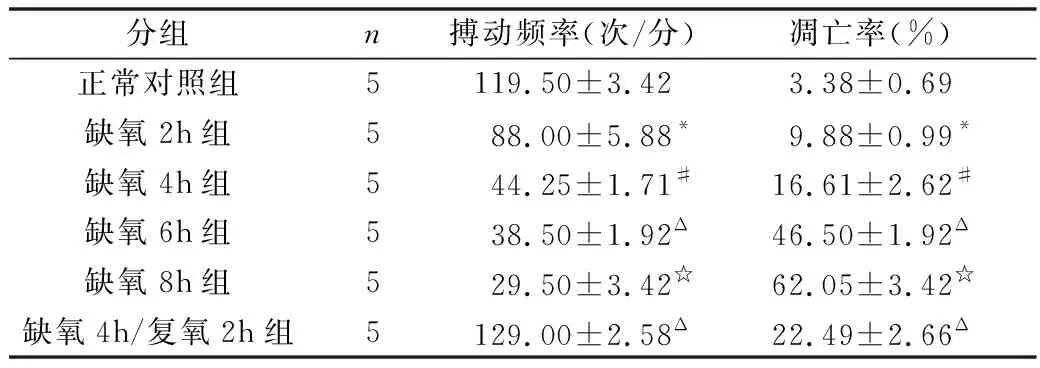
表1 各组细胞搏动频率、凋亡率比较

图1 不同缺氧时间及缺氧/复氧对心肌细胞凋亡的影响
3.T3减少缺氧/复氧致心室肌细胞凋亡:确定缺氧/复氧模型对心肌细胞损伤更大后,采用缺氧/复氧损伤模型检测T3对心肌细胞的影响,对正常对照组、缺氧/复氧组、T3+缺氧/复氧组进行流式细胞分析发现与缺氧/复氧组比较,T3可明显降低细胞凋亡率(P<0.05,n=3)。Western blot法检测可见与正常培养细胞比较,缺氧/复氧后心肌细胞Bax、caspase-3蛋白表达显著增加(图2),T3预处理可降低缺氧/复氧心肌细胞Bax、caspase-3蛋白表达(P<0.05,n=3)。
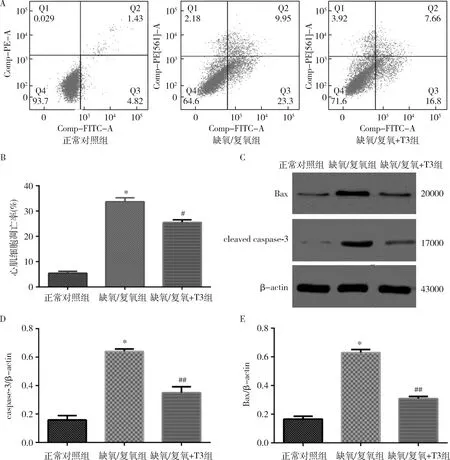
图2 T3对缺氧/复氧致心室肌细胞凋亡的影响A.流式细胞术检测细胞凋亡率;B.不同处理组心肌细胞凋亡率柱状图;C.Western blot法检测凋亡蛋白Bax、caspase-3表达;D.不同组心肌细胞caspase-3/β-actin比例;E.不同组心肌细胞Bax/β-actin比例。与正常对照组比较,*P=0.000;与缺氧/复氧+T3组比较,#P<0.01,##P=0.000
4.T3减少心室肌细胞缺氧/复氧所致线粒体膜电位下降:采用缺氧/复氧损伤模型检测T3对心肌细胞线的粒体膜电位影响,对正常对照组、缺氧/复氧组、T3+缺氧/复氧组进行JC-1染色,在倒置荧光显微镜下观察细胞线粒体红绿比,如图3所示,正常培养细胞经JC-1染色,境下多为发红光线粒体,而缺氧/复氧损伤后发红光线粒体减少,发绿光线粒体增加,红绿比降低,说明缺氧/复氧损伤心室肌细胞线粒体,造成线粒体膜电位降低。经过T3预处理的心肌细胞,境下可见发绿光的线粒体减少,线粒体红绿比增加。

图3 荧光显微镜下T3对缺氧/复氧致心室肌细胞线粒体膜电位影响(JC-1染色,×200)
讨 论
随着细胞与分子水平研究的不断深入,心肌细胞原代培养已经成为心血管研究的重要方法和计数基础,与大鼠心肌细胞比较,小鼠的心肌细胞较脆弱易损,在消化过程中会由于消化时间和力度造成细胞损伤,致心肌细胞贴壁不佳甚至几乎不贴壁的现象[5]。因此小鼠心肌细胞原代培养时对于消化要求更高,本实验采用改良的两步法分离培养心肌细胞,与传统的胰酶消化或混合酶(胰酶+混合酶)消化比较,这种方法得到的心肌细胞成活率更高,纯度更好[3,5,6]。
本实验采用三气培养箱进行心肌细胞缺氧环境,1%O2常用于心肌细胞体外缺氧模型,因此本实验也采用了1%O2诱导细胞缺氧环境。表1可见,随着缺氧时间的不断增加,心肌细胞搏动频率逐渐降低。笔者发现,当心肌细胞缺氧时间达到8h时,细胞存活率显著降低,大量细胞失去活性,流式凋亡检测也证明了当缺氧8h时细胞凋亡率高达60%左右,有研究显示8h缺氧处理诱导的心肌细胞变化足够用作细胞相关研究[7]。因此本实验设置细胞缺氧时间梯度最大值为8h。在进行不同缺氧时间处理的基础上,笔者对细胞进行了缺氧/复氧损伤,与缺氧4h比较,缺氧/复氧对心肌细胞造成的损伤更大,细胞凋亡率更高,说明复氧进一步加重细胞损伤。研究证明细胞凋亡是心肌再灌注损伤的特征之一,再灌注损伤可加速不可逆转的细胞凋亡[8~10]。且有研究显示,细胞缺氧后复氧造成的进一步损伤在1h后趋于平缓[11]。在本实验中,缺氧6h时,细胞损伤率加大,因此笔者采用缺氧5h复氧2h来进行后续实验检测。
甲状腺激素T3是人体重要的激素,可调节机体器官的生长发育,研究发现甲状腺激素可以增强左心室收缩功能,改善心室舒张功能及减少外周血管阻力[12,13]。且急性心肌梗死、心力衰竭等都伴随着体内甲状腺激素水平的改变[14,15]。甲状腺激素可调控心肌收缩及钙处理蛋白表达,离子通道激活和交感神经兴奋,既往研究显示急性心肌梗死后运用低剂量甲状腺素治疗可以增强心室收缩,减少心肌细胞凋亡,从而改善梗死后心功能[15~17]。本实验中T3预处理可降低缺氧/复氧致心室肌细胞凋亡,并减少凋亡蛋白Bax和caspase-3的表达,从而发挥心肌细胞保护作用。心肌细胞凋亡是心肌缺血再灌注损伤的重要机制,其中线粒体损伤是心肌细胞凋亡和心脏收缩功能障碍的重要原因[18]。在缺血再灌注损伤过程中,过量的活性氧导致线粒体通透性转换孔的开放,然后使Bax蛋白向线粒体外膜易位,从而触发线粒体凋亡途径导致细胞凋亡[18~20]。本实验通过JC-1染色检测心肌细胞线粒体,发现缺氧/复氧损伤可降低线粒体膜电位,说明缺氧/复氧损伤了心肌细线粒体,而T3可以恢复缺氧/复氧损伤造成的线粒体膜电位降低,保护心肌细胞线粒体,减少心肌细胞凋亡。
综上所述,体外培养心肌细胞可以更好地进行分子机制的研究,缺氧/复氧模型的建立可以模拟体内心肌缺血再灌注损伤。缺氧/复氧可加重心肌细胞损伤,降低线粒体膜电位,甲状腺素T3可以增加线粒体膜电位,减少细胞凋亡率,保护缺氧/复氧所致心肌细胞损伤。

