白蛋白结合型紫杉醇联合卡铂在铂类敏感复发性卵巢癌患者中的临床观察
王 崇 陆 林 高世乐
卵巢癌是妇科常见恶性肿瘤,早期诊断困难,70%以上的卵巢癌患者确诊时已为晚期(Ⅲ~Ⅳ期),预后较差[1]。治疗上以手术切除为主,但是仅42%的患者能够接受肿瘤细胞减灭术治疗,术后辅以含顺铂(cisplatin,DDP)或卡铂(carboplatin,CBP)两药联合化疗为常见一线治疗方案[2,3]。2015年NCCN指南亦推荐紫杉醇/卡铂联合化疗,对于一线方案治疗已经成熟,易于被临床医生和患者接受[4]。但是对于复发后的卵巢癌患者,目前尚无统一的、疗效确切的治疗方案,因顺铂毒性不良反应较大,多数复发患者二次治疗难以耐受。紫杉醇联合卡铂虽为标准化疗方案,但有较高复发率,且紫杉醇在水中几乎不溶解,必须借助聚氧乙基蓖麻油和无水乙醇助溶,可发生严重超敏反应,且一线化疗方案再次使用易于耐药,无法有效控制肿瘤进展。如何选择有效治疗方案,成为肿瘤科医生关注和研究的热点,白蛋白结合型紫杉醇(albumin-bound paclitaxel)是一种新型细胞毒性药物,通过与人血白蛋白结合形成130nm大小的颗粒,其中白蛋白部分能够与血管内皮细胞膜表面的白蛋白表面受体结合,将紫杉醇通过胞吞作用转运至肿瘤组织内,可有更高的抗瘤反应性、延长肿瘤进展时间和较低的过敏反应[5,6]。对于白蛋白结合型紫杉醇联合卡铂在复发性卵巢患者中疗效如何,值得期待。下面就笔者医院初治后铂类敏感复发性卵巢癌患者,分别给予两种不同化疗方案,观察其疗效和不良反应,归纳分析总结如下。
资料与方法
1.一般资料:选取笔者医院2014年1月1日~2016年1月1日收治的60例初治后铂类敏感复发性卵巢癌患者作为研究对象,患者平均年龄51.6(31~65)岁;有病理学支持诊断,初始治疗术后FIGO分期Ⅰ期3例,Ⅱ期12例,Ⅲ期39例,Ⅳ期6例,其中浆液性腺癌18例,内膜样腺癌22例,黏液样腺癌9例,透明细胞癌3例,腺癌6例,其他2例。复发病灶位于盆腔25例,腹腔11例,腹盆腔20例,其他4例。所有患者入组标准:①均接受过肿瘤细胞减灭术以及含铂方案化疗,化疗方案为紫杉醇或多西紫杉醇联合顺铂或卡铂,首次治疗后评价达CR或PR;②停止化疗后12个月以上出现进展或复发,即为铂类敏感性复发[7];③KPS评分≥70分,预计生存期≥6个月;④经影像学和肿瘤标志物CEA、CA125定期随访明确为肿瘤复发,且影像学有可测量病灶;⑤复发后请妇科会诊无再次手术指征;⑥有知情同意书及医学伦理学委员会通过。排除标准:①严重肝脏、肾脏、心脏、脑功能不全者;②初次化疗含吉西他滨或白蛋白结合型紫杉醇方案;③哺乳期、妊娠期女性;④精神疾病不能合作者;⑤第2次复发肿瘤;⑥晚期恶病质。60例患者按照随机数字表法分为对照组28例和治疗组32例。对照组给予吉西他滨联合卡铂方案化疗,治疗组给予白蛋白结合型紫杉醇联合卡铂方案化疗。两组患者在年龄、病理类型、复发部位、KPS评分、肿瘤标志物CEA及CA125等一般资料比较,差异无统计学意义(P>0.05)。
2.治疗药物:注射用盐酸吉西他滨,规格0.2克/支,国药准字H20030104,购自江苏豪森药业股份有限公司;注射用紫杉醇(白蛋白结合型),规格100毫克/支,进口药品注册证号H20091059,Abraxis BioScienc,LLC;卡铂注射液,规格100mg/10ml,国药准字H20020180,购自齐鲁制药有限公司。
3.化疗方案:对照组28例患者给予吉西他滨联合卡铂方案化疗,具体为吉西他滨1000mg/m2D1/8,卡铂300mg/m2D1;治疗组32例患者给予白蛋白结合型紫杉醇联合卡铂方案化疗,白蛋白结合型紫杉醇260mg/m2D1,卡铂用法用量同对照组。化疗期间常规镇吐、制酸、补液,每3周为1个化疗周期,共行4个周期。化疗前常规心电图、血常规、肝脏、肾功能电解质、肿瘤标志物CEA、CA125、尿粪常规检查,化疗期间常规复查血常规,每3周复查肝脏、肾功能电解质,化学发光免疫分析法检测血清CEA(正常值≤5ng/ml)及 CA125(正常值<35U/ml)。血液学毒性按WHO分级标准,Ⅰ度和Ⅱ度者在GCSF支持下继续既定剂量化疗,Ⅲ度减量25%,Ⅳ度中止化疗[8]。
4.评价标准:化疗结束后评价所有患者KPS评分,并复查影像学计算肿瘤体积,按实体瘤RECIST1.1评价疗效标准分为4级[9]:(1)完全缓解(complete response,CR):所有目标病灶完全消失。(2)部分缓解(partial response,PR):所有可测量目标病灶的直径总和低于基线≥30%。(3)疾病稳定(stable disease,SD):介于PR和PD之间。(4)疾病进展(progressive disease,PD):可测量目标病灶的直径总和增加≥20%,除此以外,必须满足直径和的绝对值增加至少5mm,或出现新病灶。另外,客观有效率(objective response rate,ORR)=(CR+PR)/总例数×100%;疾病控制率(disease control rate,DCR)=(CR+PR+SD)/总例数×100%。
5.治疗期间常见不良反应评价:骨髓抑制程度、胃肠道反应程度按WHO分级,详见表1。

表1 治疗期间不良反应WHO分级标准

结 果
1.两组患者治疗前后KPS评分及肿瘤标志物变化:对照组与治疗组治疗后腹痛、腹胀、便秘等临床症状不同程度较前改善,患者饮食、睡眠、食欲、精神状态均较前增加,生活质量明显提高,治疗组KPS评分稍高于对照组患者,但差异无统计学意义(P>0.05);治疗组患者血清CEA及CA125低于对照组患者(P<0.05),差异有统计学意义,详见表2。

表2 两组患者KPS评分及肿瘤标志物CEA及 CA125变化
2.所有患者治疗后复查腹部及盆腔增强CT检查:影像学评价对照组28例患者中CR、PR、SD、PD为2、13、9、4例,ORR、DCR为53.6%、85.7%;治疗组32例患者中CR、PR、SD、PD为6、19、5、2例,ORR、DCR为78.1%、93.8%。与对照组比较,治疗组ORR显著高于对照组(P<0.01),差异有统计学意义;治疗组DCR高于对照组(P<0.05),差异有统计学意义,详见表3。
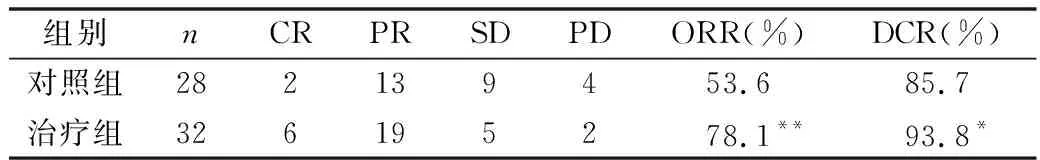
表3 两组患者临床疗效评价(n)
3.不良反应:各组患者治疗期间主要不良反应为血液学毒性和消化道反应,其中对照组按WHO分级标准发生Ⅰ~Ⅱ度骨髓抑制、恶心、呕吐、腹泻分别为4例(14.3%)、8例(28.6%)、4例(14.3%);治疗组Ⅰ~Ⅱ度骨髓抑制、恶心、呕吐、腹泻分别为6例(18.6%)、10例(31.3%)、6例(18.8%),治疗组发生Ⅲ度腹泻1例(3.1%),均无Ⅳ度毒性不良反应,全组无治疗相关性死亡,详见表4;治疗组1例患者首次化疗给予白蛋白结合型紫杉醇输液5min后发生过敏反应1例,给予地塞米松5mg静脉注射后症状缓解,减慢输液速度未再发生类似不良反应。

表4 不同治疗方案Ⅰ~Ⅲ度毒性不良反应[n(%)]
4.随访:所有复发性卵巢癌患者治疗后定期复查,有专人随访,无失联病例,随访率100%。第1年每3个月1次,第2年每6个月1次,第3年及以后每年1次。复查内容包括肿瘤标志物CEA、CA125及腹盆腔增强CT,最后随访时间2018年6月1日。所有患者随访时间最长44.2个月,最短8.5个月,中位随访时间26.9个月;随访结束后对照组存活5例,除1例死于心脑血管疾病,其余死于肿瘤进展,治疗组存活9例,1例死于交通意外,其余均死于肿瘤进展。对照组1年、3年、5年生存率分别为71.4%、46.4%、21.4%,治疗组1年、3年、5年生存率分别为84.3%、65.6%、34.3%,治疗组患者1年、3年、5年生存率均高于对照组,差异有统计学意义(P<0.05)。
讨 论
据文献报道,世界女性恶性肿瘤中卵巢癌位居第7位,病死率位居第4位,在妇科肿瘤中病死率中位居第1位,且发生率逐年上升[10,11]。近年来,对于卵巢癌的诊断治疗一直是临床医生研究的热点,因确诊时多为中晚期,主要治疗方法为肿瘤细胞减灭术后辅助化疗[12]。肿瘤细胞减灭术是指尽最大努力切除原发病灶及其转移灶,使残余病灶<2cm[13]。对于术后患者辅助化疗方案选择中,一线治疗方案含紫杉醇或铂类已被多数临床医生接受,早期疗效较好,但患者最终会复发,5年生存率不理想;约有70%~80%的患者在初始治疗有效后会复发,其中85%的复发患者病灶位于腹盆腔内,临床主要表现为恶心、呕吐、腹痛、腹胀、食欲不振,重者肠梗阻[14,15]。对于治疗后复发患者目前尚无统一治疗标准,其中铂类敏感性复发患者二线化疗仍可使用含铂方案化疗,但单一化疗疗效有限,对于治疗后复发患者如何选择低毒、高效化疗方案,尽可能避免交叉耐药,是二线治疗疗效及提高患者生活质量的关键。
紫杉醇是红豆杉属植物中一种复杂的次生代谢产物,也是唯一可以促进微管聚合和稳定已聚合微管的药物。肿瘤细胞接触到紫杉醇后,紫杉醇以微管为作用靶点,与肿瘤细胞微管蛋白结合,促进微管聚合,抑制微管聚集,阻断细胞有丝分裂。但是紫杉醇只结合到聚合的微管上,不与未聚合的微管蛋白二聚体反应。且紫杉醇为疏水性化合物,在水中不溶解,需借助无水乙醇、聚氧乙基蓖麻油作为助溶剂,可引起严重过敏反应、骨髓抑制和神经毒性[16]。而白蛋白结合型紫杉醇是美国Abraxis公司研发的新一代紫杉类药物,它以人血白蛋白作为药物载体,其中白蛋白可以与血管内皮细胞膜表面的特异性白蛋白表面受体gp60相结合,促进药物进入肿瘤细胞内,可以将更多药物聚集在癌细胞内,使得药代动力学呈线性关系,提高肿瘤间质内的紫杉醇浓度,更强效提高抗瘤活性[17]。有研究者通过体外细胞培养的方法,发现白蛋白结合型紫杉醇与内皮细胞的结合和转运是溶剂型紫杉醇的4倍[18]。此外,白蛋白结合型紫杉醇不含助溶剂,过敏反应发生率极低,无需预处理,血液毒性、消化道毒性、神经毒性均低于紫杉醇注射液。有临床研究报道,白蛋白结合型紫杉醇在晚期肺癌和乳腺癌中有较高的临床反应率,白蛋白结合型紫杉醇联合卡铂已被FDA批准用于一线治疗不适合手术或放疗的局部晚期或转移性非小细胞肺癌,对于既往紫杉醇耐药的或接受过紫杉醇多重化疗的晚期乳腺癌采用白蛋白结合型紫杉醇为基础的化疗,仍可以取得疗效,但对晚期复发卵巢癌报道较少[19,20]。
本研究将白蛋白结合型紫杉醇联合卡铂治疗铂类敏感复发性卵巢癌患者设定为治疗组,通过与对照组比较分析,两组患者经全身化疗4个周期后生活质量及KPS评分均较治疗前提高,治疗组KPS评分虽高于对照组,但两组间患者比较,差异无统计学意义,可能与样本量较小有关。化疗后治疗组患者血清肿瘤标志物CEA及CA125表达水平低于对照组,说明血液学检测肿瘤负荷下降;采用实体瘤RECIST1.1评价疗效,治疗组患者客观有效率和疾病控制率分别为78.1%、93.8%,显著高于对照组的53.6%和85.7%,差异有统计学意义,可以得出治疗组患者化疗后疗效优于对照组。那么在提高疗效的同时,治疗期间不良反应发生率如何,是临床医生需要关注的另一重要问题,通过数据分析,两组患者化疗期间常见不良反应为骨髓抑制、恶心、呕吐、腹泻等,其中骨髓抑制、恶心、呕吐等不良反应发生率差异无统计学意义,治疗组腹泻症状发生率为21.9%,高于对照组的14.3%,差异有统计学意义。通过对两组患者KPS评分、实体瘤体积变化、不良反应发生率等指标研究,可以得出白蛋白结合型紫杉醇联合卡铂近期疗效客观,未明显增加药物不良反应发生率,那么治疗后远期疗效如何,需要进一步随访得出,治疗组在1、3、5年生存率均高于对照组,差异有统计学意义,远期疗效同样可观。
综上所述,对于白蛋白结合型紫杉醇联合卡铂两药方案联合化疗在铂类敏感复发性卵巢癌患者,疗效确切,不良反应可控,值得临床推广。

