SUVmax联合CEA、NSE、Ca211对肺癌诊断价值
李镇江 赵 杰 贾晓民
肺癌是一种恶性肺肿瘤,是世界范围内癌症相关死亡的主要原因,大多数患者病情严重,远期预后较差[1]。当前对肺癌的诊断主要基于手术或支气管镜或CT引导下进行的组织活检。然而,有时临床上获取足够的组织进行活检尚不可行,如晚期肺癌患者。Fuorine-18氟脱氧葡萄糖正电子发射断层显像(18F-FDG PET)是一种无创方法,主要应用于肺癌的分期与疗效评价以及预后评估[2]。FDG摄取反映了肿瘤的葡萄糖代谢率,可以用最大标准摄取值(maximal standard uptake value,SUVmax)来描述或量化。血清肿瘤标志物(CEA、NSE、Ca211)浓度测定方法简单,对肺癌的辅助诊断和预测病理分型有一定价值[3,4]。但据相关文献报道,SUVmax、CEA、NSE、Ca211单独诊断肺癌的准确性尚且不够,而SUVmax和肿瘤标志物(CEA、NSE、Ca211)二者联合是否能更好的诊断肺癌目前研究相对较少。本研究分析肺癌病灶SUVmax和血清肿瘤标志物(CEA、NSE、Ca211)临床参数,并评估二者联合对肺癌的诊断价值。
资料与方法
1.一般资料:本回顾性研究获徐州医科大学附属医院伦理学委员会批准。选取2015年2月~2018年12月徐州医科大学附属医院收治的147例疑似肺癌患者。所选患者经手术、纤维支气管镜活检及CT或B超引导下穿刺活检,经病理确诊,有肺癌患者118例,包括腺癌81例,鳞癌22例,小细胞癌15例;男性73例,女性45例;患者年龄61.9±9.4岁。肺癌临床分期根据2009年国际肺癌研究学会(IASLC)公布的第7版TNM分期系统[5];有良性病变患者29例,包括炎性肉芽肿4例,结核4例,炎性假瘤8例,炎性病变8例,错构瘤1例,腺样不典型增生2例,支气管扩张伴真菌感染1例,机化性肺炎1例;男性22 例,女性7例;患者年龄52.6±13.8岁。纳入标准:①所选患者术前均行18F-FDG PET/CT扫描和血清肿瘤标志物(CEA、Ca211、NSE)检测,且临床资料完整;②根据常规胸部X线或CT检查结果,患者在接受任何治疗前被怀疑患有肺癌可能;③所选患者均经病理明确;④所有患者知情同意。排除标准:①术后1个月内活检组织未能明确病理的患者;②转移性肺癌;③有严重肝肾功能不全患者。
2.检查方法:(1)PET-CT采集及判读:所有患者在18F-FDG PET/CT显像前禁食至少6h,检测空腹血糖在正常水平范围内。采用美国通用公司Discovery PET/CT Elite(美国GE公司),氟代脱氧葡萄糖(18F-FDG)由南京江原安迪科药有限公司供给,放化纯>95%,将示踪剂18F-FDG以3.70~5.55MBq/kg的剂量缓慢静脉注射,保持安静状态,静脉注射18F-FDG 60min后,使用PET/CT全身扫描。PET-CT数据由两位经验丰富的核医学医生进行分析。该医生对所有患者病理未知,但对患者临床病史知情。由计算机软件获得感兴趣区并计算肺病灶的最大标准摄取值(maximal standard uptake value,SUVmax),按照SUVmax>2.5判断为恶性肿瘤。如果解释上不一致,由两位核医学医生通过讨论达成一致来解决。(2)肿瘤标志物检测:当日空腹采静脉血3ml,经离心分离血清,贮存于4℃冰箱冻存待检测。应用罗氏Cobas8000全自动生化分析仪及其原装配套试剂,采用电化学发光法,按说明书严格操作,室内质控,室间质控符合标准。(3)肿瘤标志物判断标准:正常参考值CEA 0~5.00ng/ml,NSE 0~17.00ng/ml,Ca211 0~3.30ng/ml,超出正常值高限为阳性。(4)诊断标准:联合检测组中任一指标超过正常值高限即为阳性,均为阴性定义为阴性。
3.统计学方法:采用SPSS 19.0统计学软件对数据进行统计分析,非正态数据分布用中位数和四分位数[M(P25~P75)]表示。用Kruskal-WallisH检验评估肿瘤病灶直径(最大)、病理类型之间SUVmax的差异,用Mann-Whitney检验评估年龄、性别、临床分期之间SUVmax的差异。用受试者工作特征曲线(ROC)评价SUVmax与CEA、Ca211、NSE诊断准确性,ROC曲线下面积 (AUC) 值接近1代表诊断准确优,AUC值低于0.5代表诊断准确差。使用MedCalc 18.5(MedCalc Software)进行Logistic回归分析,采用Z检验比较SUVmax联合血清肿瘤标志物、单独使用SUVmax和单独使用各血清肿瘤标志物之间AUC的差异,以P<0.05为差异有统计学意义。
结 果
1.肺癌SUVmax及肿瘤标志物(CEA、NSE、Ca211)水平比较:肺癌SUVmax明显高于良性病变(P=0.000),SUVmax在肺腺癌(P=0.008)、肺鳞癌(P=0.000)、小细胞肺癌(P=0.000)均显著高于良性病变。SUVmax与性别(P=0.247)、年龄(P=0.488,表1)无关,但与病理类型(P=0.000)、临床分期(P=0.000)、病灶直径(P=0.000)有关。SUVmax在小细胞肺癌明显高于腺癌(P=0.019),鳞癌明显高于腺癌(P=0.001),小细胞肺癌与鳞癌SUVmax比较差异无统计学意义(P>0.05,表1)。SUVmax在临床晚期(Ⅲ+Ⅳ期)明显高于临床早期(Ⅰ+Ⅱ期)。病灶直径≤20mm小于30mm<直径≤40mm(P=0.001)或40mm<直径(P=0.000),余两两区间比较差异无统计学意义(P>0.05,表1)。血清CEA、Ca211、NSE水平在肺腺癌、鳞癌和小细胞肺癌患者中明显高于良性病变患者(P分别为0.000、0.003、0.001)。
2.肺癌SUVamx诊断价值:绘制ROC曲线分析SUVmax和肿瘤标志物(CEA、NSE、Ca211)诊断价值,AUC值如下:SUVmax为0.730(95%CI: 0.635~0.824),CEA为0.713(95%CI:0.625~0.802),NSE为0.620(95%CI:0.506~0.734),Ca211为0.694(95%CI:0.585~0.803,表2),SUVmax和肿瘤标志物(CEA、NSE、Ca211)联合时,AUC值为0.823(95% CI:0.752~0.895,P=0.000,表2,图1)。明显高于SUVmax (Z=2.075,P=0.038),CEA(Z=2.855,P=

表1 肺癌患者SUVmax与临床病理特征间的关系[M(P25~P75)]
小细胞癌与腺癌比较,P=0.019;鳞癌与腺癌比较,P=0.001;30<直径≤40mm与直径≤20mm比较,P=0.001;直径40mm<直径与直径≤20mm比较,P=0.0000.004), Ca211 (Z=2.631,P=0.001)和NSE (Z=3.878,P=0.000)。 SUVmax和肿瘤标志物(CEA、NSE、Ca211)的敏感度、特异性和准确率各不相同,SUVmax显示较高敏感度(81.36%)和准确率(72.79%),SUVmax和肿瘤标志物(CEA、NSE、Ca211)联合诊断时敏感度为87.29%,准确率为75.51%,高于SUVmax和肿瘤标志物单独,但特异性为27.59%,明显低于SUVmax和单独使用肿瘤标志物(表2)。
3.SUVmax联合CEA或NSE或Ca211对肺癌病理类型的诊断价值:选取118例肺癌病例,根据病理结果分为肺腺癌、鳞癌、小细胞肺癌。ROC曲线用特定肿瘤标志物与SUVmax结合绘制。在81例肺腺癌中,SUVmax联合CEA的AUC值为0.767(95%CI:0.679~0.855,P=0.000)高于CEA单独(0.732,95%CI:0.639~0.825,P=0.000,表3,Z=1.154,P=0.248),同样,在小细胞肺癌或鳞癌中,SUVmax联合NSE或Ca211的AUC值也高于NSE单独(P=0.001,表4,Z=1.421,P=0.155)或Ca211单独(P=0.003,表5,Z=1.982,P=0.047)。

表2 CEA、NSE、Ca211和SUVmax联合时及各单独时诊断分析
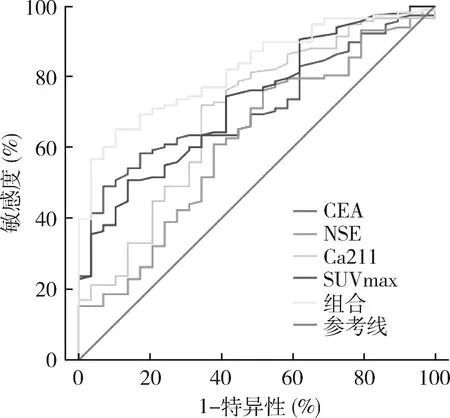
图1 肺癌与良性病变患者SUVmax,单个肿瘤标志物及SUVmax与CEA、NSE、Ca211联合诊断的ROC曲线ROC.受试者工作特征曲线;CEA.癌胚抗原;Ca211.细胞角蛋白19片段;NSE.神经元特异性烯醇化酶;SUVmax.最大标准摄取值;组合.CEA、NSE、Ca211与SUVmax联合;AUC.曲线下的面积

表3 肺腺癌中SUVmax、CEA联合及各单独诊断分析

表4 小细胞肺癌中SUVmax、NSE联合及各单独诊断分析

表5 肺鳞癌中SUVmax、Ca211联合及各单独诊断分析
讨 论
肺癌是目前世界范围内发生率最高的恶性肿瘤[3,6]。尽快明确肺癌诊断是当前治疗及管理肺癌行之有效的办法,现在临床对肺癌的诊断主要是基于病理组织学检查。然而,许多晚期肺癌患者中获取足够的组织学检查又不可行[7]。所以,临床迫切需要一种无创、准确的方法来快速评估可疑病变。
近年来尽管在分子诊断学方面产生了许多肺肿瘤生物学标志物,但单独使用肿瘤标志物对肺癌诊断敏感度有限,且特异性单一,迄今为止所开发的血清学标志物尚未被认为是理想的生物学标志物[8]。有研究表明,肿瘤标志物(Ca211、CEA、NSE)联合检测在肺肿瘤诊断中具有重要意义[9]。Fuorine-18氟脱氧葡萄糖正电子发射断层显像(18F-FDG PET/CT)检测联合功能代谢与解剖,方法无创,是《肺癌诊断和治疗指南》推荐的8~10mm的孤立性肺结节的早期筛查手段,目前被广泛应用于临床[10]。18F-FDG PET以18F-FDG示踪剂的摄取反映正常或癌变组织糖酵解代谢速率,可以用最大标准摄取值(SUVmax)来描述或量化。然而,近年来有关SUVmax与肿瘤标志物(CEA、NSE、Ca211)联合对肺癌诊断价值研究报道较少,而且评价不一。本研究采用SUVmax联合血清肿瘤标志物(CEA、NSE、Ca211)对肺癌诊断进行评估。
笔者首先比较不同病理类型间SUVmax和血清肿瘤标志物的差异。肺癌的SUVmax明显高于良性病变,鳞癌、小细胞癌SUVmax均高于腺癌,良性病变最低,鳞癌与小细胞癌水平比较差异无统计学意义。之前,有研究表明鳞癌对18F-FDG摄取高于腺癌,因为鳞癌表达的葡萄糖转运体1型 (GLUT-1)高于腺癌[11]。然而,Liu等[12]发现SUVmax对不同病理类型的肺癌的诊断能力有限,原因可能是样本量有限,仅包括15例肺癌患者。刘芳蕾等[13]研究发现病灶直径≥20mm的SUVmax值明显高于<20mm。在本研究中,发现病灶直径≤20mm小于30mm<直径≤40mm(P=0.001)或40mm<直径(P=0.000),与上述文献报道一致,因此,18F-FDG的吸收有可能与葡萄糖转运体表达和病灶直径有关。
辛丹[14]研究发现SUVmax+CEA+NSE+Ca211联合诊断敏感度为87.62%,特异性为92.3%。本研究SUVmax+CEA+NSE+Ca211联合诊断敏感度为87.29%,特异性为27.59%,特异性偏低。SUVmax特异性低常见原因为,部分代谢能力低、分化程度高的肿瘤(如腺癌、支气管肺泡细胞癌及类癌等),还有炎症、结核及结节病灶均会富集显像剂。本研究中,有炎性肉芽肿2例,结核3例,炎性假瘤4例,炎性病变5例和机化性肺炎1例SUVmax值高于2.5。另外,与程凯等[15]研究结果不同,笔者的研究结果显示,SUVmax值Ⅲ+Ⅳ期肺癌中的表达水平明显高于Ⅰ+Ⅱ期肺癌。
ROC分析目前被广泛用于比较肿瘤标志物的诊断价值,AUC被认为是一种定量测量肿瘤标志物在肺癌病例与良性肺疾病鉴别能力的方法[16]。采用ROC曲线进一步评价和比较单独应用SUVmax、单独应用各血清肿瘤标志物及两种方法联合应用的诊断效能。结果表明,单独使用血清肿瘤标志物或SUVmax诊断效果还尚不足。然而,当这两种方法相结合时,AUC值、敏感度和准确率评价肺癌诊断效果均明显提高。
既往研究表明,血清肿瘤标志物与组织学类型有关,腺癌中癌胚抗原(CEA)、鳞癌中鳞状细胞癌抗原(SCC)、细胞角蛋白19片段(Ca211)、小细胞肺癌中的神经元特异性烯醇酶(NSE)均显著升高[17]。本研究中,NSE在小细胞肺癌明显高于在鳞癌和腺癌中的水平,NSE联合SUVmax在小细胞肺癌诊断中AUC值为(0.901,95%CI:0.808~0.975)高于SUVmax和单独使用NSE,表明NSE联合SUVmax 对小细胞肺癌有更好的诊断价值。此外,SUVmax联合CEA或Ca211分别能提高对肺腺癌和鳞癌的诊断。
但本研究尚有一定的局限性。首先,采用回顾性设计纳入的患者相对较少,尤其是小细胞肺癌患者。其次,患者选择过程中可能存在偏倚,未纳入组织活检困难、血清肿瘤标志物未检测的病例。再次,SUVmax解释的观察者间可变性未被评估,观察者们只是达成了一项共识。尽管如此,本研究表明,SUVmax与Ca211、CEA和NSE联合检测提高了AUC值和肺癌诊断的敏感度和准确率。此外,当SUVmax与Ca211、CEA或NSE与肺鳞状细胞癌、腺癌和小细胞肺癌相结合时,SUVmax的诊断价值也明显增加。建议对SUVmax和肿瘤标志物进行联合监测,以获得更可靠的肺癌诊断价值。

