两株植物乳杆菌联合抑制高脂诱导小鼠肥胖的形成
陆婧婧,宋 月,岳莹雪,霍贵成
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
肥胖是一种慢性代谢疾病,并且已经成为全球流行性疾病[1]。根据世界卫生组织(WHO)统计,截止到2016年,全球已有19亿成年人超重,其中6.5亿人肥胖,超过3.4亿名儿童和青少年超重或肥胖[2]。就目前快节奏的生活方式而言,高能量食物的摄入与久坐的工作方式是导致肥胖率升高的主要原因。当摄入过多脂肪时,会被各种酶及胆汁酸盐进行消化水解成甘油和脂肪酸等进入血液,而肝脏作为脂肪合成的主要场所,如果合成的甘油三酯不能被及时转运就会形成脂肪肝、脂肪组织积累,此外还会引起二型糖尿病、心血管疾病等慢性代谢疾病的发生[3]。目前,有很多减肥药物出现在大众的视野中,如可以抑制食欲的西布曲明,阻挡脂类吸收的奥利司他等药物,但会使得体内所需脂溶性维生素吸收不足引起内分泌失调[4]。所以,研发出更加新型健康的制剂来预防肥胖形成至关重要。
世界卫生组织将益生菌制剂定义为,可以黏附、定植在肠道表面,当达到有效数量级时,对宿主产生有益的作用[5]。Yung-Tsung Chen[6]研究得出,马里乳杆菌ASP1的摄入可以调节高脂饮食大鼠体内脂代谢相关基因的表达,减少甘油三酯的积累,进而缓解肥胖。Kyung-Ah Kim[7]表明,LactobacillusbrevisOK56通过抑制炎症因子NF-κB的表达进而缓解小鼠肥胖的形成。Cuiyuan Jin[8]研究得出,无菌小鼠和正常小鼠同时饲喂高脂饲料,正常小鼠成为肥胖模型,而无菌小鼠无肥胖特征,说明肥胖的形成与肠道菌群密切相关。很多实验表明[9-10],肥胖小鼠肠道内厚壁菌门与拟杆菌门比值增大,而益生菌制剂的补充使肠道内厚壁菌门下降,拟杆菌门上升,改善肠道菌群结构,进而缓解肥胖的形成。目前,很多的研究多关注一株益生菌对肥胖形成的缓解作用,两株及多株益生菌联合是否具有更好的调节作用仍值得进一步研究。
植物乳杆菌KLDS1.0344、植物乳杆菌KLDS1.0386分离于内蒙古传统发酵乳和稀奶油中,已经证明两株菌具有较好的耐酸胆盐、黏附特性,且具有较优的降解胆固醇能力[11-13]。本实验采用两株植物乳杆菌联合灌胃,检测其对高脂饮食诱导小鼠肥胖所产生的抑制作用。为开发出具有缓解肥胖形成的功能性发酵剂提供理论基础。
1 材料与方法
1.1 材料与仪器
植物乳杆菌KLDS1.0344、植物乳杆菌KLDS1.0386 教育部重点实验室工业微生物菌种保藏中心;C57BL/6J雄性小鼠 60只,体重20~23 g,许可证号:SCXK(京)2012-0001,北京维通利华实验技术有限公司;高脂饲料D12460、对照饲料D12450B配方参照文献配方[14];MRS培养基 每1L含有:蛋白胨5 g、牛肉膏5 g、胰蛋白胨10 g、乙酸钠5 g、磷酸氢二钾2 g、葡萄糖20 g、硫酸锰0.25 g、柠檬酸氢二铵2 g、吐温-80 g,澳博星生物技术公司;酵母粉、奥利司他 OXOID公司。
VD-1320超净工作台 北京东联哈尔仪器有限公司;DHP-9082型恒温培养箱 上海一恒科技有限公司;HVE-50全自动高压灭菌锅 HIRAYAMA公司;紫外可见分光光度计 MILTON ROY COMPANY;GL-21M离心机 上海市离心机械研究所;DH-101-3BS电热恒温鼓风干燥箱 天津市中环实验电炉有限公司。
1.2 实验方法
1.2.1 实验样品的制备 实验前菌株KLDS1.0344和KLDS1.0386分别以2%接种量接种到MRS培养基中,传代3次,取培养16 h的菌悬液,6000 r/min、10 min离心收集菌体,加入5 mL无菌PBS缓冲溶液,利用移液枪吹散菌体,继续离心,重复两次,第三次收集两株菌体,用PBS重新悬浮成浓度为108CFU/mL的菌悬液,剂量选择参照靳妲等的研究[15]。菌悬液每日重新制备。奥利司他药物组按每千克小鼠体重10 mg剂量灌胃[16]。
1.2.2 小鼠分组与饲养 所有小鼠进行普通饲料适应性喂养一周,后随机分为四组,每组十只:空白组、模型组、干预组(KLDS1.0344组、KLDS1.0386组、混合组)药物组。空白组喂食D12450B饲料,其余组菌喂食D12460饲料。空白组和模型组灌胃灭菌0.01 M PBS溶液,干预组和药物组分别灌胃菌悬液(其中KLDS1.0344组、KLDS1.0386组分别灌胃两株菌株,混合组按照1∶1比例,每株菌为5×108CFU/mL,每次每只小鼠灌胃0.2 mL)和奥利司他溶液(10 mg/kg),连续灌胃6周。鼠房温度保持在24 ℃左右,湿度保持在45%~50%之间,照明10 h左右。实验期间,每周更换两次垫料,每天更换高脂饲料以免脂肪氧化产生气味影响小鼠进食,每周进行体重测量。
1.2.3 小鼠体重、Lees系数、体脂率的测定 每周记录小鼠体重变化;测定小鼠体长(从鼻尖到肛门的距离),计算Lees系数;取出小鼠附睾脂肪组织及肾周脂肪组织进行称量[17]。

1.2.4 血脂四项测定 小鼠眼球取血,室温放置2 h,4 ℃,3000 r/min离心10 min,吸取血清,送至黑龙江中医药大学利用全自动生化分析仪检测血清中TC(总胆固醇)、TG(甘油三酯)、LDL-C(低密度脂蛋白胆固醇)和HDL-C(高密度脂蛋白胆固醇)的浓度。
1.2.5 小鼠脏器指数测定 小鼠眼球取血后,进行解剖,将小鼠心脏、肝脏、脾脏、肾脏取出,用无菌PBS冲洗,并用滤纸吸干,称重,进行脏器指数的测定。

1.2.6 肝脏中甘油三酯的测定 取出冻藏在-80 ℃的各组小鼠肝脏,分别称取0.1 g,按1∶9的比例加入灭菌PBS冰浴条件下进行研磨,4 ℃,4000 r/min离心10 min,取出上清液,利用南京建成甘油三酯试剂盒进行测定。
1.2.7 肝脏HE病理学分析 取空白组、模型组、干预组及药物组小鼠的肝脏,观察颜色和形态所发生的变化,称取不同肝脏同一部位,放置在4%的甲醛溶液中,于30 ℃恒温固定,进行HE染色,参照宋晨实验方法[18],在光学显微镜下观察小鼠肝脏病理变化,并拍照记录。
1.3 数据分析
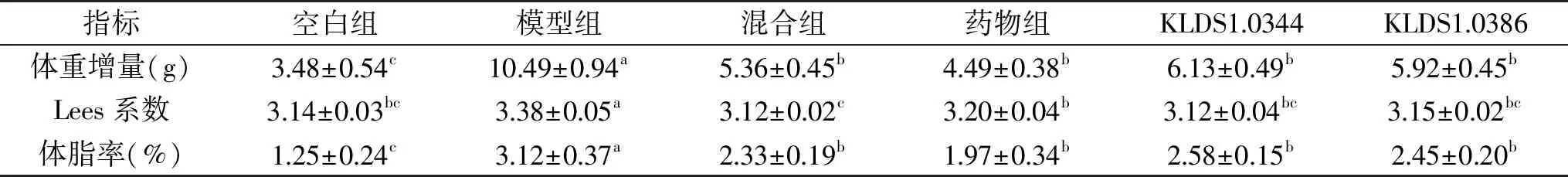
表1 体重增量、Lees系数、体脂率Table 1 The body weight,weight gain,Lees coefficient,and body fat percentage
注:同行小写字母不同表示差异显著(P<0.05),表2同。
2 结果与分析
2.1 小鼠体重、Lees系数、体脂率的分析
8周末,如图1所示,模型组小鼠体重高于空白组27.5%,大于20%[18],肥胖模型建立,说明高脂饮食会增加机体对能量的摄入从而使体重显著增加(P<0.05)。如表1所示,模型组小鼠体重增量最大,而混合组与药物组体重增量明显低于模型组(P<0.05),二者处于相同水平,说明混合组能和药物组一样有效的抑制高脂诱导小鼠体重的增长。

图1 小鼠体重的变化Fig.1 Changes in body weight of mice
Lees系数反映小鼠的肥胖程度,数值越大,肥胖程度越高。从表1可以看出,模型组的Lees系数大于空白组,说明高脂饮食能引起小鼠的快速增长并引起肥胖;混合组和药物组系数显著低于模型组(P<0.05)。
肥胖的形成不仅需要观测体重的变化,也应关注体内脂肪含量的变化,体脂率是体内脂肪含量与体重的比值,可以更加直观地观测到小鼠的肥胖程度。从表1可以看出,模型组的体脂率显著高于其他三组(P<0.05),混合组和药物组显著降低了体脂率(P<0.05),与体重及Lees系数结果一致。
2.2 血脂四项的变化
长期高脂膳食的摄入,会造成体内产生过多的脂肪酸,从而促进了血清中TG和TC含量上升,若机体处于肥胖状态时,体内脂肪酶会加速处理,使得HDL含量下降,LDL含量升高。
血脂四项变化如图2所示,与空白组相比,模型组小鼠TG、TC、LDL的含量均显著上升(P<0.05),HDL的含量显著降低(P<0.05)。当灌胃KLDS1.0344与KLDS1.0386进行干预时,均在不同程度上获得了改善。与模型组相比,KLDS1.0386组和混合组均能有效改善高脂饮食引起血清中TG水平的增加,混合组效果更为明显(P<0.05)。供试菌株的干预均能有效缓解血清中TC的增加(P<0.05),使得HDL的含量明显上升(P<0.05)。此外,混合组的指标更接近于对照组与药物组,所以混合组可以显著的改善高脂饮食所引起的血脂升高。这与姚芳芳等[19]研究结果相符合,副干酪乳杆菌N1115联合益生元能有效改善高脂饮食所引起的小鼠血清甘油三酯、胆固醇的下降。可能由于益生菌的干预改善了其肠道菌群结构,使肠道通透性改变,抑制对高脂饮食的吸收。Bobae[20]实验结果表明,高脂饮食喂养C57BL/6J小鼠同时灌胃鼠李糖乳杆菌LGG(1×108CFU/只),可以有效缓解小鼠血清中TG和TC水平的增加。

图2 小鼠的血脂四项Fig.2 The blood lipids of mice注:小写字母不同表示差异显著(P<0.05)。
2.3 脏器指数的测定
由表2可以看出,长期高脂饮食对小鼠肝脏影响较为显著(P<0.05),对心脏、脾脏、肾脏无显著影响(P>0.05)。说明高脂饮食可能会引起小鼠肝脏脂肪性病变,严重则会导致脂肪肝,不同实验处理对小鼠的心脏、脾脏、肾脏未产生影响。
2.4 肝脏中甘油三酯含量的测定
肝脏是甘油三酯合成的主要场所,当所合成的甘油三酯过多,不能被及时转运时,便会在肝脏中积累。由图3可知,长期饲喂高脂饲料可引起肝脏中脂肪的积累,模型组肝脏中甘油三酯含量显著上升(P<0.05),灌胃植物乳杆菌干预组中甘油三酯含量明显得到了改善(P<0.05),且混合组效果较好。与张震研究结果一致[22],其利用鼠李糖乳杆菌干预高脂饮食小鼠,结果表明可以有效改善小鼠肝脏中的甘油三酯含量。Yooa[21]实验结果表明,L.plantarumKY1和L.curvatusHY7601干预高脂饮食小鼠9周,可以有效缓解肝脏中甘油三酯含量,缓解非酒精性脂肪肝的形成。

表2 小鼠的脏器指数(%)Table 2 Organ index of mice(%)

图3 小鼠肝脏中甘油三酯的含量Fig.3 Content of triglyceride in liver注:小写字母不同表示差异显著(P<0.05)。
2.5 肝脏病理切片HE染色
肥胖与脂肪肝关系密切,肥胖常常会引起脂肪肝的形成。在肝脏中,如果甘油三酯合成和分解保持平衡,则不会有脂滴形成,一旦有过多脂质累积,则会在细胞内形成圆形的脂滴,破坏肝细胞正常结构,对肝脏造成损伤,当脂肪空洞数量及大小达到一定程度,就会形成脂肪肝[18]。从图4中,可以观察到对照组(Control)中无脂肪变性,组织结构清析、完整,未发生病变。模型组(Model)肝脏中出现小而多的脂肪空洞,呈规则的圆形,说明高脂饮食在引起肥胖的同时,摄入的甘油三酯不能被充分利用,积累在肝脏引起轻度脂肪肝的形成。而经过乳酸菌干预,KLDS1.0344组中出现部分大脂滴,KLDS1.0386组出现小的脂滴,混合组(MX)肝脏中脂肪变性减轻,脂肪空洞很小且很少,说明混合组能有效降低机体对脂肪的积累,这可能是因为益生菌的干预促进了机体脂代谢,从而减少脂质积累;药物组所体现较好的治疗效果,阻止了体内对脂肪的吸收,导致肝脏中甘油三酯含量降低。这与宋晨[18]研究结果一致,益生菌干预显著的改善了高脂饮食所引起的脂肪肝,使肝脏中脂肪空洞变少变小。

图4 小鼠肝脏组织切片HE染色Fig.4 Liver HE staining of mice注:箭头所标记为脂肪变性形成的圆形空洞。
3 讨论
乳酸菌因其具有较好的耐酸耐胆盐特性,及肠道黏附定植特性,已经广泛用来治疗人体或者动物肠道相关疾病。本实验采取高脂饮食同时灌胃两株植物乳杆菌,8周末,检测肥胖相关指标。在体重体脂方面,模型组小鼠体重均达到31.2 g,混合组小鼠达到26.69 g,得出益生菌混合组能显著的降低高脂饮食所引起的肥胖(P<0.05);模型组小鼠体脂率为3.12%,混合组小鼠为2.33%,可以有效的减少小鼠脂肪的积累,这与李丽[23]研究结果一致,乳杆菌的干预会显著降低高脂饮食小鼠体内的体重及体脂率。与模型组小鼠相比,混合组小鼠血清中甘油三酯含量下降了33.3%,肝脏甘油三酯含量下降了34.2%,存在显著性差异,具有统计学意义,这与李明月[24]研究结果相似,LactobacilluscaseiYBJ02干预后使得小鼠血清和肝脏中甘油三酯含量下降了27%、30.3%。通过肝脏切片可以得出,与模型组相比,混合组切片中脂肪空洞较小,而且密度较低,存在显著性差异(P<0.05)。
4 结论
本实验结果表明,植物乳杆菌KLDS1.0344与植物乳杆菌1.0386联合制剂,可以显著降低小鼠体内甘油三酯含量,减缓脂肪肝的形成,减少脂肪组织的累积,从而有效地抑制高脂饮食所引起的肥胖。为开发出具有缓解肥胖的发酵剂奠定了基础,在未来的研究中我们可以进一步探讨两株菌对脂肪合成、代谢相关基因及通路的影响。

