芒果酒发酵动力学模型及抗氧化性研究
,*
(1.攀枝花学院 生物与化学工程学院,四川攀枝花 617000;2.攀枝花市干热河谷特色生物资源工程技术中心,四川攀枝花 617000)
芒果是攀枝花的特产,具有纤维少、味甜芳香、质地腻滑、香气怡人、营养丰富的优良品质,集热带水果优点于一身,被誉为“热带水果之王”[1-3]。芒果含糖分较高,口感独特,将其制成发酵酒,一方面可保留芒果本身的营养特性,另一方面可使发酵酒的口感独具特色。发酵动力学是探讨微生物新陈代谢随发酵时间、微生物生长状况、基质消耗、产物形成的变化规律的一门科学[4],它把数学模型运用到发酵动力学数据处理中,用直观的数学表达式表示变化规律,可为发酵工业的工艺改进提供理论参考[5]。
目前国内外关于芒果发酵酒及发酵制品的报道已有很多,如岑涛等[6]从云南芒果上分离酵母菌并用于芒果酒发酵;王宇鸿等[7]将番木瓜与芒果一起发酵酿制果醋;王天陆、李善雄等[8-9]分别对芒果发酵酒的工艺条件通过对比试验进行了优化等。在发酵动力学研究方面,也有诸对如樱桃、红枣等果酒发酵动力学模型进行研究的报道[10-11]。关于抗氧化性研究,在国内,普遍采用测定多酚、黄酮、羟基自由基清除率、超氧自由基清除率、DPPH自由基清除率、硫酸氰铁法等方法测定果酒的抗氧化性[12-16]。目前鲜有关于芒果发酵酒发酵动力学及其抗氧化性的相关报道。
本研究通过芒果酒发酵,根据发酵过程中酵母菌数量、酒精度及总糖含量随发酵时间的变化,采用Logistic及TwoSiteComp方程分别建立动力学模型,对动力学模型进行模拟以反映芒果酒发酵过程的动力学特性,并研究不同酒精度、SO2含量、VC添加量及发酵时间对芒果酒抗氧化性的影响,以期为芒果酒发酵工艺提供一定的理论依据,这对芒果资源市场的进一步开发和扩大具有重要意义。
1 材料与方法
1.1 材料与仪器
芒果 攀枝花市仁和区农贸市场,品种为“凯特”,产地位于攀枝花市仁和区中坝;安琪高活性酵母 湖北宜昌安琪酵母股份有限公司;果胶酶(30×104U/g) 江苏锐阳生物科技有限公司;亚硫酸(99.8%)、芦丁(AR)、没食子酸(>99.9%) 成都科龙化工试剂厂。
FA2204B电子天平 上海越平科学仪器有限公司;PHS-2C酸度计 天津市赛得利斯试验分析仪器;LB32T手持式糖度仪 广州市铭睿电子科技有限公司;DZKW-S-8电热恒温水浴锅 北京市永光明医疗仪器有限公司;0-25型酒精计 衡水市博衡仪器仪表有限公司。
1.2 实验方法
1.2.1 工艺流程及操作要点 芒果酒发酵工艺流程如下所示[17]。

操作要点:原料预处理:芒果破碎、去核,并将去核芒果放入榨汁机榨汁;SO2、果胶酶的添加:芒果汁中加入60 mg/L的二氧化硫以防止杂菌污染,并加入40 mg/L果胶酶在40 ℃的恒温培养箱中酶解24 h以分解果胶,增加出汁率;成分调整:发酵前要对芒果汁进行糖度、酸度调整。实验需要对不同酒精度的芒果酒进行抗氧化性测定,通过初始加入不同白砂糖量调节糖度,发酵进行酒精度调整;加入柠檬酸调节酸度为4.5 g/L,同时加入接种酵母。发酵:发酵期间,发酵外环境温度为室温(15 ℃左右),在20 ℃的恒温培养箱中发酵7 d;陈酿:陈酿时需加入100 ppm/L的二氧化硫以杀死菌体。
1.2.2 芒果酒发酵过程中理化与菌种量的变化 测定芒果酒中多酚、黄酮含量及羟基自由基清除率时,固定SO2添加量为60 mg/L,VC添加量为120 mg,通常17~18 g/L的糖分可转为1°酒精,通过初始加入白砂糖量分别为85、120、150、190、220 g/L,在发酵过程中对酒精度进行检测,控制发酵时间,获得不同酒精度为5%、7%、9%、11%、13%;固定酒精度为11%,VC添加量为120 mg,发酵7 d,设定SO2添加量为60、80、100、120、140 mg/L;固定SO2添加量为60 mg/L,酒精度为11%,发酵7 d,设定不同VC添加量为30、75、120、165、210 mg;固定SO2添加量为60 mg/L,VC添加量为120 mg,酒精度为11%,设定不同发酵时间为0、12、24、36、48、60、72、84、96、108、120、132、144、156、168 h。在发酵的7 d时间内每隔12 h对发酵过程中的酒精度、总糖、pH及酵母菌数量进行测定。
1.2.2.1 酒精度的测定 采用蒸馏法,用酒精计测量其酒精含量。
1.2.2.2 总糖含量的测定 采用菲林试剂法[18]。
1.2.2.3 pH的测定 采用pH计进行测定。
1.2.2.4 酵母菌数量测定 采用血球计数板法测定。
1.2.3 芒果酒发酵过程中抗氧化指标的变化 在进行抗氧化指标变化的测定时,酒精度、SO2添加量、VC添加量及发酵时间的变化水平与1.2.2中所描述的变化水平相同。
1.2.3.1 黄酮含量的测定 芦丁标准曲线的绘制[19-20]:用分析天平准确称取芦丁10.26 mg,加入30%乙醇,定容至50 mL,得芦丁母液(1 mL中含有0.2052 mg芦丁)。准确吸取芦丁母液0、1.0、2.0、3.0、4.0、5.0 mL,分别加入5只25 mL容量瓶中,向每只容量瓶中依次加入5%的硝酸钠溶液1 mL,10%的硝酸铝溶液1 mL,1 mol/L氢氧化钠溶液10 mL,定容,摇匀后静置15 min,测定吸光度值,用Origin 8.6软件绘图,得标准曲线和回归方程式。根据芦丁的线性回归方程和样液的吸光值,计算样液的黄酮含量。
1.2.3.2 多酚含量的测定 没食子酸标准曲线的绘制[21-23]:用分析天平精确称取(0.110±0.001) g的焦性没食子酸,用水定容至100 mL,得浓度为1000 mg/L的没食子酸母液;从没食子酸母液中分别吸取0、1.0、2.0、3.0、4.0、5.0 mL到5只100 mL容量瓶中,定容至刻度,得0、10、20、30、40、50 mg/L的没食子酸标准溶液。分别吸取1 mL没食子酸标准溶液,在其中加入5 mL水,1 mL福林酚试剂,3 mL 7.5% NaCO3溶液,得0、1、2、3、4、5 mg/L的没食子酸,在765 nm处测定其吸光度值,运用Origin 8.6软件进行绘图,得标准曲线和回归方程式。根据没食子酸的线性回归方程和样液的吸光值,计算样液的多酚含量。
1.2.3.3 羟基自由基清除率的测定 在1 mL芒果酒试液中,依次加入0.1 mL 0.3%双氧水和1.5 mL 1.8 mmol/L的水杨酸-乙醇和2 mL 1.8 mmol/L的硫酸亚铁,混匀,37 ℃恒温水浴30 min,以蒸馏水代替芒果酒试液作为对照,测定510 nm处的吸光值[24-25]。羟基自由基(OH·)清除率的计算公式为:
式(1)
式中:A1为蒸馏水代替芒果酒试液的吸光值;As为加了芒果酒试液的吸光值。
1.2.4 发酵动力学模型的建立 Logistic模型是一个相当经典的“S”型曲线方程,常应用于发酵的细胞生长过程[26]。
1.2.4.1 酵母菌生长动力学模型 根据实验的数据分析,果酒酵母的生长呈“S”型的曲线,可以用Logistic模型来进行描述:
式(2)
式中:Y表示发酵液中总糖含量,%;A1表示酵母菌的最初浓度,%;A2表示酵母菌的最终浓度,%;X表示发酵时间,h;X0、P为方程系数。
1.2.4.2 产物酒精生成动力学模型 本实验采用蒸馏法测定发酵液中酒精度,依据试验数据,应用Origin 8.6软件对实验所得数据进行画图,描述酒精度含量随发酵时间的变化趋势。方程为:
式(3)
式中:Y表示发酵液中的总糖含量,%;X表示时间,h;A1表示酒精的最初浓度,%;A2表示酒精的最终浓度,%;X0、p表示方程中的系数。
1.2.4.3 总糖消耗动力学模型 芒果酒发酵过程中,发酵液中糖主要供给酵母菌利用,用于酵母菌的生长繁殖,维持酵母的正常新陈代谢,用下面的方程来拟合总糖消耗的变化过程:
式(4)
式中:Y表示发酵液中的总糖含量,%;X表示时间,d;A1为发酵液中总糖的最大含量,%;A2表示发酵液中的总糖的最小含量,%;其它表示方程中的系数。
2 结果与分析
2.1 芒果酒中菌体量、酒精度、总糖含量、pH的变化情况
芒果酒发酵过程中菌体量、酒精度、总糖含量、pH随发酵时间的变化趋势见图1。由图1可知,0~36 h期间,酵母菌处在适应新环境阶段,生长缓慢,糖的消耗也较慢,酒精生成量较少,pH迅速下降,此阶段为适应期;36~108 h期间,酵母菌迅速增长,糖迅速被利用,酒精生成速率快,48 h之后pH有缓慢上升;108~168 h期间,酵母菌生长基本停止,酒精生成速率变慢,糖基本没有消耗,pH趋于稳定。发酵结束后发酵液酒精度为11.4%,总糖含量为2.3%左右,pH为3.74。从图中变化曲线可以看出,总糖的消耗和酒精的生成符合酵母菌生长代谢规律。
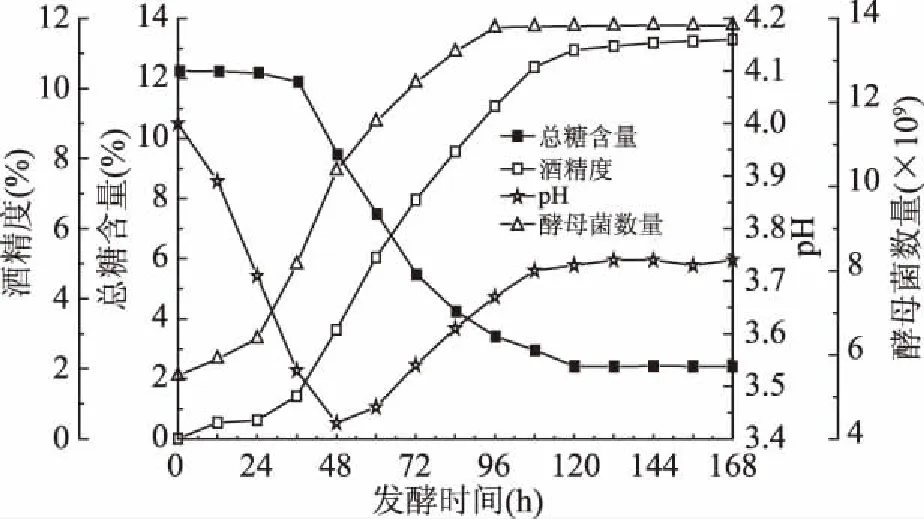
图1 芒果酒发酵过程主要指标变化曲线Fig.1 Change curves of main indexes of Mango wine fermentation process
2.2 芒果酒抗氧化性
2.2.1 标准曲线
2.2.1.1 芦丁标准曲线 在510 nm处测得的芦丁标准曲线如图2所示。芦丁的标准曲线方程为:Y=5.71916X-0.00919,R2=0.99293,相关性较好,可用于计算芒果酒中黄酮的含量。

图2 芦丁标准曲线Fig.2 Standard curve of rutin
2.2.1.2 没食子酸标准曲线 在765 nm处测得的没食子酸标准曲线如图3所示。没食子酸的标准曲线方程为:Y=0.025X-9.5238,R2=0.99631,相关性较好,用于计算芒果酒中多酚的含量。

图3 没食子酸标准曲线Fig.3 Standard curve of gallic acid
2.2.2 不同酒精度对芒果酒抗氧化性的影响 由表1可以看出芒果酒在发酵过程中当酒精度为5%~7%时,黄酮、多酚含量有所增加,羟基自由基清除能力也随着增加,当酒精度为9%时,羟基自由基清除能力最强,当酒精度>9%时,羟基自由基清除能力反而减弱。与酒精度为9%时相比,当酒精度达到13%时,OH自由基清除能力下降了23.6%,抗氧化能力几乎减弱一半,黄酮含量下降了9.3%,多酚含量减少了11.1%,随着芒果酒中黄酮和多酚含量的下降,抗氧化能力随之减弱。抗氧化能力变化的原因可能是与黄酮的分子结构和构象有关,促进电子的离域化,有利于供氢体在提供氢后形成相对稳定的自由基中间体,从而抗氧化能力得到加强。而多酚的抗氧化能力的强弱由它的化学结构有密切关系决定。它的聚合度越高,抗氧化能力就越强。抗氧化能力减弱的原因可能是由于糖苷的取代位置不同,对氧化活性有差异,糖苷基的引入均会降低其抗氧化能力。而多酚的聚合度随着酒精含量的增加而降低,其抗氧化能力也随着减弱。

表1 酒精度对黄酮、多酚含量以及OH·清除率的影响Table 1 Effects of alcohol content on flavonoids,polyphenols content and OH· scavenging rate
2.2.3 不同SO2浓度对芒果酒抗氧化性的影响 由表2可知,随着SO2浓度的增加,黄酮含量逐渐减少,多酚含量先下降再上升再下降,羟基自由基的清除能力也呈现先上升后下降的趋势,当添加量为100 mg/L时,多酚含量和羟基自由基的清除率达到最高,分别为0.058 mg/mL、69.01%。随后,多酚的含量逐渐减少,羟基自由基的清除能力减弱。主要原因可能是SO2能与果酒中的有机过氧化物的发生反应,导致芒果酒中没有过氧化氢等强氧化性物质生成,同时过氧化酶也不能发挥其活性。

表2 二氧化硫对黄酮含量、多酚含量和OH·清除率的影响Table 2 Effects of SO2 on flavonoids content,polyphenols content and OH· scavenging rate
2.2.4 不同维生素C添加量对芒果酒抗氧化性的影响 由表3可知,黄酮含量在VC加入量为30 mg时最高,为0.099 mg/mL,在VC加入量为75 mg时最低,为0.028 mg/mL,整体上黄酮含量随VC加入量的增加而降低;多酚含量在VC加入量为75 mg时最低,为0.028 mg/mL,当VC加入量为165 mg时,多酚含量达到最高,为0.066 mg/mL;OH自由基的清除能力随VC加入量的增加呈现上升趋势,当VC加入量在210 mg时,OH自由基清除率达到最高,为68.35%。过量的VC使黄酮和多酚的含量下降,OH自由基清除率却并没有多大变化,由此可见过量的VC可能会对芒果酒的抗氧化性造成抑制作用。当加入VC的量为165 mg时,芒果酒的抗氧化作用达到最强。

表3 维生素C添加量对黄酮含量、多酚含量以及OH·清除率的影响Table 3 Effects of vitamin C on flavonoids content,polyphenols content and OH· scavenging rate
2.2.5 不同发酵时间对芒果酒抗氧化性的影响 由表4可以看出,发酵0~24 h时多酚与黄酮含量有所降低,在24~84 h期间,随着发酵时间的增加,黄酮与多酚含量以及清除羟基自由基的能力逐渐上升,在84 h均达到最高值。分别为0.416、0.096 mg/mL和67.6%,随后随着发酵时间的增加,黄酮、多酚含量及OH自由基清除率整体上有所下降。下降的主要原因,可能是因为含有大量的可氧化基团。发酵过程中,多酚会造成芒果酒中高级醇的氧化和多酚类物质相互间发生氧化聚合反应,随着发酵的不断进行,多酚发生聚合、氧化反应,使芒果酒中多酚含量不断下降,从而其抗氧化性也不断减弱。综合考虑各因素,当发酵时间在84 h时,芒果酒的抗氧化能力最好。
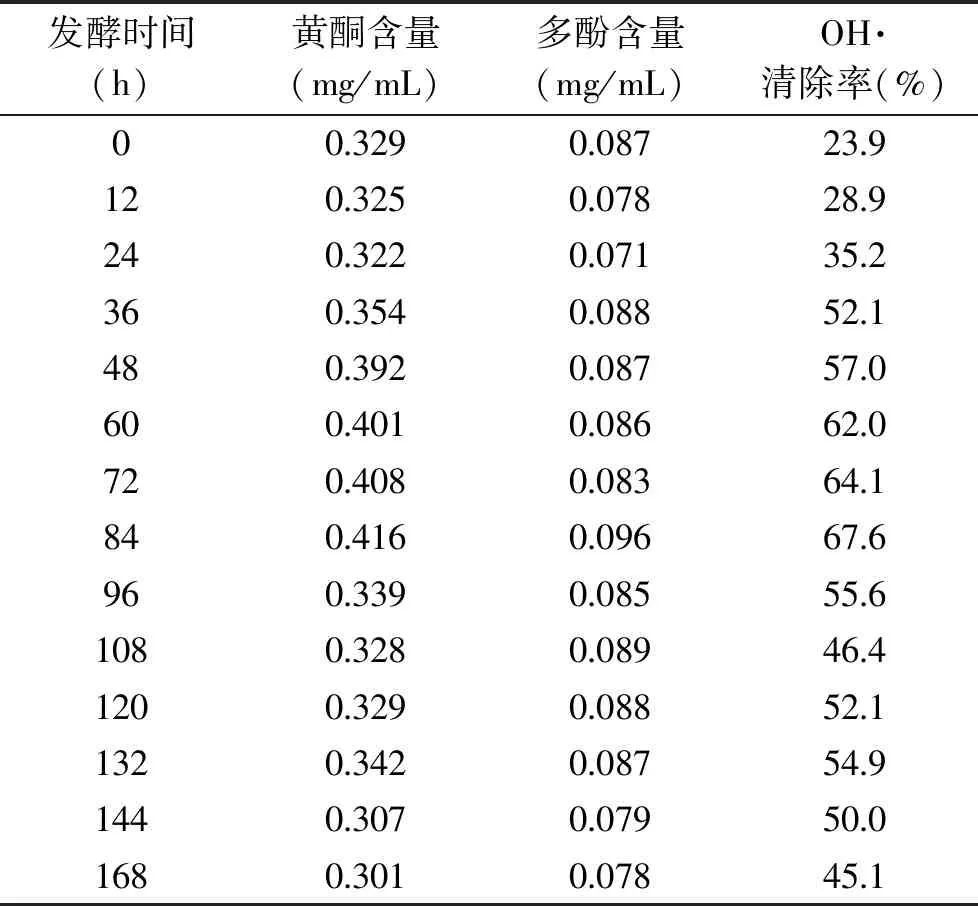
表4 发酵时间对黄酮、多酚含量以及OH·清除率的影响Table 4 Effects of fermentation time on flavonoids,polyphenols content and OH· scavenging rate
2.3 芒果酒发酵过程模型建立
2.3.1 酵母菌生长动力学模型的建立 用Origin 8.6软件对式(2)进行数据拟合,计算得式(2)中A1=5.5980,A2=14.169,X0=57.666,P=3.9710,据此得酵母菌增长随发酵时间变化的表达式为:
式(5)
通过Origin 8.0软件对试验结果分析,酵母的生长拟合曲线如图4所示。由图4可知,发酵过程中酵母菌数量随发酵时间的变化曲线与其拟合曲线的吻合程度好,芒果酒发酵过程中的Logistic模型R2=0.99819,表明该模型基本上反映了酵母菌的生长变化情况。

图4 酵母菌生长实验值与预测值模型拟合曲线Fig.4 Fitness curve of test values ofyeast growth and prediction values
2.3.2 酒精生成动力学模型的建立 酒精发酵实质上就是酵母菌通过分解葡萄糖等有机物,产生酒精、二氧化碳等不彻底氧化产物的过程。实验通过对发酵过程中酒精度的测定,用Origin 8.6软件对式(3)进行数据拟合,计算得式(3)中A1=0.19863,A2=12.0780,X0=66.7082,P=3.473,据此得到酒精度随时间变化的表达式为:
式(6)
酒精生成拟合曲线如图5所示。由图5可知,芒果酒发酵过程中酒精生成动力学模型的预测值和实测值的平均相对误差较小,酒精生成量的拟合值曲线和实测值曲线吻合较好。Origin 8.0软件分析可知,芒果酒发酵过程中的酒精生成动力学模型R2=0.99810,表明该模型能很好地反映随发酵时间酒精度的变化情况。

图5 酒精生成实验值与预测值模型拟合曲线Fig.5 Fitness curve of test values of alcohol production and prediction values
2.3.3 总糖消耗动力学模型的建立 实验通过对发酵过程中芒果汁液中总糖含量的测定,用Origin 8.6软件对式(4)进行拟合,计算得式(4)中A1=12.46893,A2=2.30008,lgx1=2.29461,lgx2=3.86362,f=0.80826。得总糖含量随时间变化的方程为:
式(7)
总糖消耗拟合曲线如图6所示。由图6可知,在芒果酒发酵过程前期、中期和后期的总糖含量测定值曲线和总糖消耗动力学模型的拟合值曲线吻合度很好。芒果酒发酵过程中的TwoSiteComp模型R2=0.99619,表明总糖含量的动力学模型能很好地反映随发酵时间总糖含量的变化情况。
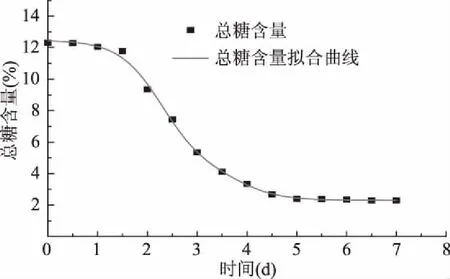
图6 总糖消耗实验值与预测值模型拟合曲线Fig.6 Fitness curve of test values of total sugar consume and prediction values
3 结论
在芒果酒的发酵过程中对理化和菌量进行了测定,芒果酒发酵过程中菌体量、酒精度、总糖含量、pH均随着发酵时间的增加而呈现一定的变化趋势,发酵结束后发酵液酒精度为11.4%,总糖含量为2.3%左右,pH为3.74;芒果酒的抗氧化性分析结果表明,当酒精度为9%时,黄酮含量、多酚含量、羟基自由基清除率分别达到最高,分别为0.09、0.021 mg/mL、52.82%;当SO2浓度为100 mg/L时,羟基自由基清除率达到最高,为69.01%;当加入VC的量为165 mg时,多酚含量最高,为0.066 mg/mL,发酵时间在84 h时,芒果酒的黄酮含量、多酚含量、羟基自由基清除率达到最高,分别为0.416、0.096 mg/mL、67.6%。本实验采用Origin 8.0软件对数据进行分析,用Logistic方程建立了芒果酒发酵的菌体生长、产酒精、总糖消耗的动力学模型并得到模型拟合方程,其决定系数R2分别为0.99819、0.99810、0.99619,均大于0.9。动力学模型的预测值曲线与实测值曲线的吻合程度均很好,表明动力学模型能够准确地描述芒果酒发酵过程的变化。
通过芒果酒发酵动力学及抗氧化性的研究,将进一步掌握酵母菌的生理特征,酒精生产的最适条件,以及各发酵参数之间的关系,为今后工业化生产芒果酒提供一定的理论参考。

