紫薯蛋白-葡萄糖美拉德产物制备及其与花色苷相互作用研究
,*
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023;2.湖北省农业科学院粮食作物研究所,湖北武汉 430064)
紫薯(Purple sweet potato),是果肉性状呈紫色的薯类,属于一种特殊的甘薯品种[1]。紫薯中蛋白质含量丰富[2-3],每100 g干物质紫薯中,粗蛋白含量约1.2~10 g。紫薯中同时具有游离态花色苷和聚合态花色苷,聚合态花色苷主要是以紫薯蛋白花色苷复合物的形式呈现,即紫薯蛋白与花色苷通过共价键或非共价键结合形成新的生物大分子物质[4]。美拉德反应是蛋白质分子中ε-氨基与还原糖分子羰基发生的羰氨反应[5]。与原蛋白相比,蛋白质-多糖美拉德产物在溶解性、乳化性、起泡性、热稳定性、抗氧化性等理化性质上通常能够得到增强,具有更好的应用价值[6-7]。
近年来,关于花色苷与蛋白质的相互作用报道很多。Arroyo-Maya等[8]研究了乳球蛋白、乳清蛋白和酪蛋白与花色苷的相互作用。王丹等[9]研究表明牛血清蛋白(BSA)与花色苷结合后,花色苷的稳定性得以提升。郭莹[10]等通过荧光猝灭法揭示了紫薯蛋白与紫薯花色苷的结合机理。但目前对于蛋白质糖基化产物结合花色苷的研究缺乏深入报道,探讨两者的相互作用对自然环境中紫薯蛋白花色苷复合物的形成具有比较参考价值。本文采用反应过程绿色且有效的干法美拉德反应制备改性紫薯蛋白。运用聚丙烯酰胺凝胶电泳、红外光谱、差示量热扫描和荧光光谱法研究紫薯蛋白-葡萄糖美拉德产物性质及其与花色苷之间的相互作用。通过研究紫薯花色苷与紫薯蛋白-葡萄糖美拉德产物之间的相互作用为紫薯蛋白质花色苷复合物的形成提供比较参考。
1 材料与方法
1.1 材料与仪器
紫薯品种 为鄂薯12号,由湖北省农业科学院提供;紫薯花色苷(其中芍药素-3-(6′咖啡酰-6″阿魏酰槐糖苷)-5-葡糖苷占总花色苷含量的37%) 实验室自制[10];pH7.0 Tris HCl 索莱宝科技有限公司;葡萄糖 上海安耐吉化学有限公司;十二烷基硫酸钠 碧云天试剂公司;盐酸、溴化钾 国药集团化学试剂有限公司;交联聚乙烯吡咯烷酮(crosslinking polyvingypyrrolidone,PVPP) 上海阿拉丁试剂有限公司;透析袋(压平宽度10 mm,截留分子质量3500 D) 美国Viskase公司;所有试剂 均为分析纯。
AL204电子分析天平 梅特勒仪(上海)有限公司;HH-2数显恒温水浴锅 国华电器有限公司;Mini-Protean-3电泳仪配电泳槽 美国Bio-Rad公司;DSC-Q2000差示热量扫描仪 美国TA仪器有限公司;F-4600荧光光谱仪 日本日立公司;NEXUS670傅里叶变换红外光谱仪 美国尼高力仪器公司。
1.2 实验方法
1.2.1 紫薯蛋白-葡萄糖美拉德产物制备
1.2.1.1 紫薯蛋白花色苷复合物的制备 紫薯蛋白花色苷复合物的制备(Purple Sweet Potato Protein-Anthocyanin Complexs,PSPP-AC):称取1.25 kg新鲜紫薯,清洗打浆,按料液比1∶8加入水(pH6.5),在40 ℃下水浴超声提取90 min,提取液在4000 r/min条件下离心30 min,去除残渣。冰浴控制提取液温度为4 ℃条件并缓慢添加硫酸铵粉末至饱和度60%,并在此条件缓缓搅拌1 h,4000 r/min条件下离心30 min,收集沉淀,少量蒸馏水稀释后透析除去硫酸铵,冷冻干燥后即得复合物。
1.2.1.2 紫薯蛋白的分离纯化 紫薯蛋白(Purple Sweet Potato Protein,PSPP)的分离纯化[11-12]:取紫薯蛋白花色苷复合物0.2 g溶于50 mL去离子水中,搅拌30 min使其充分溶解,加入2 g交联聚乙烯比咯烷酮(PVPP)涡旋混匀,静置1 h,在4000 r/min、室温条件下离心30 min。取上清液,浓缩上清液至20 mL,等待上样。DEAE-52阴离子交换层析柱填料活化装填并采用去离子水平衡后,将处理过的紫薯蛋白花色苷复合物溶液上样,用含0.3 mol/L NaCl的50 mmol/L的Tris-HCl缓冲液(pH7.5)进行洗脱,流速为1 mL/min,使用紫外检测器在波长280 nm处在线检测,收集对应峰组分,置于透析袋中透析24 h,冷冻干燥得到紫薯蛋白粉末。
1.2.1.3 紫薯蛋白-葡萄糖美拉德产物的制备 紫薯蛋白-葡萄糖美拉德产物(Purple Sweet Potato Protein Maillard Product,PSPPMP)的制备[13]。干法制备美拉德产物:称取0.1 g紫薯蛋白粉末,溶解于50 mL去离子水中,加入同等质量的葡萄糖粉末,搅拌30 min使其充分溶解混合,冷冻干燥后,均匀平铺在直径为10 cm的培养皿中,置于温度为60 ℃,相对湿度为78.9%的反应环境中,分别在反应6、12、18、24 h后取出样品,用少量去离子水溶解,透析12 h除去未参与反应的葡萄糖分子,冷冻干燥,置于-20 ℃ 冰箱中保存备用。
湿法制备美拉德产物:称取0.1 g紫薯蛋白粉末,溶解于50 mL pH为7的磷酸盐缓冲液中,加入同等质量的葡萄糖,再加入0.02%的叠氮化钠,搅拌30 min使其充分溶解并混合均匀。置于60 ℃的恒温箱中反应24、48 h后取出,透析冷冻干燥即得湿法美拉德产物。
1.2.2 美拉德产物SDS-PAGE分析 紫薯蛋白-葡萄糖美拉德产物的SDS-聚丙烯酰胺凝胶电泳分析参考Laemmli[14]报道的方法,并稍作改进。选择12%浓度的分离胶,5%浓度的浓缩胶。取10 mg紫薯蛋白、紫薯蛋白花色苷复合物、紫薯蛋白-葡萄糖美拉德产物样品用去离子水溶解定容到10 mL,配制成浓度为1 mg/mL的样品溶液。按照4∶1的体积比将样品溶液加入到蛋白上样缓冲液(5×)中,充分混合蛋白样品和蛋白上样缓冲液,沸水浴10 min,冷却至室温后上样,上样量为10 μL。在60 V电压条件下电泳40 min,然后在120 V电压条件下电泳1 h左右,当溴酚蓝指示剂到达距离凝胶底部0.5 cm处时停止电泳。取下电泳凝胶,浸泡在0.25%的考马斯亮蓝R-250溶液中染色2 h,然后取出置于含50%乙酸的甲醇溶液中脱色12 h,取出使用凝胶成像系统对凝胶拍照。
1.2.3 美拉德产物红外光谱(FTIR)分析 参考文献[15],取一定量紫薯蛋白、紫薯蛋白花色苷复合物、紫薯蛋白-葡萄糖美拉德产物按质量比1∶100的比例与溴化钾粉末混合,充分研磨混匀,在保持干燥的条件下压成透明薄片,进行红外光谱扫描,扫描波数范围为4000~400 cm-1,分辨率为4 cm-1,重复扫描16次。
1.2.4 美拉德产物差式扫描量热(DSC)分析 参考文献[16]方法,并略做改进。称取(5±0.2) mg紫薯蛋白、紫薯蛋白花色苷复合物、紫薯蛋白-葡萄糖美拉德反应产物粉末分别放入铝盒中,加盖压实,以空铝盒作为空白对照,温度测定范围为25~150 ℃,升温速率为5 ℃/min,控制氮气流速为20 mL/min,测定样品变性峰温度及热焓值变化。
1.2.5 美拉德产物与花色苷相互作用
1.2.5.1 荧光光谱 参考文献[17]中的方法,配制0.5 mg/mL的紫薯蛋白-葡萄糖美拉德产物溶液和浓度为4×10-3mol/L的紫薯花色苷溶液,向2 mL的美拉德产物溶液中加入不同量的紫薯花色苷溶液,使花色苷与蛋白的浓度比分别为0、1、2、3、4、5、6、7、8、9、10、11、12,充分混匀,然后分别在25、30、35 ℃水浴锅中恒温,测定混合液的荧光发射光谱。
1.2.5.2 同步荧光光谱 参考文献[18]中的方法配制0.5 mg/mL的紫薯蛋白-葡萄糖美拉德产物溶液和浓度为4×10-3mol/L的紫薯花色苷溶液,向2 mL的美拉德产物溶液中加入不同量的紫薯花色苷溶液,使花色苷与蛋白的浓度比分别为0、1、2、3、4、5、6、7、8、9、10、11、12,充分混匀。固定激发波长为280 nm,发射波长范围为290~500 nm,激发和发射狭缝宽度均为2.5 nm,并分别测量Δλ=15 nm条件下激发波长为250~500 nm的同步荧光光谱,Δλ=60 nm条件下激发波长为200~440 nm处的同步荧光光谱。
2 结果与分析
2.1 美拉德产物SDS-PAGE分析
紫薯蛋白-葡萄糖美拉德产物的SDS-聚丙烯酰胺凝胶电泳图谱如图1所示。条带1、2、3、4代表紫薯蛋白与葡萄糖通过干法美拉德反应6、12、18、24 h的产物的特征条带,随着紫薯蛋白与葡萄糖美拉德反应时间的增加,美拉德反应产物分子量也逐渐增大。条带5和条带6分别为紫薯蛋白与葡萄糖通过湿法美拉德反应24、48 h得到的产物的条带。可以看到,干法反应情况下,在反应前紫薯蛋白染色带主要集中在20 kDa,反应后分子量渐渐增大,染色带逐渐接近紫薯蛋白花色苷复合物分子量的染色带为25 kDa。据研究,紫薯蛋白含有58 kDa分子量的蛋白质,从美拉德反应条带中可以看到在接近标准蛋白63 kDa的染色带处有新的染色带产生,并逐渐达到63 kDa,可以说明,干法美拉德反应形成了分子量更大的接枝产物。在湿法美拉德反应情况下,紫薯蛋白的分子量并没有增加,没有形成较大分子量的染色带,即葡萄糖分子与紫薯蛋白产生接枝反应程度非常小。经过对比,紫薯蛋白与葡萄糖的干法美拉德反应中,确实发生了以共价键形式结合为基础的接枝反应,并且生成了相对分子质量较大的物质,因此选择干法美拉德反应制备紫薯蛋白-葡萄糖美拉德产物。
2.2 美拉德产物红外光谱(FTIR)分析
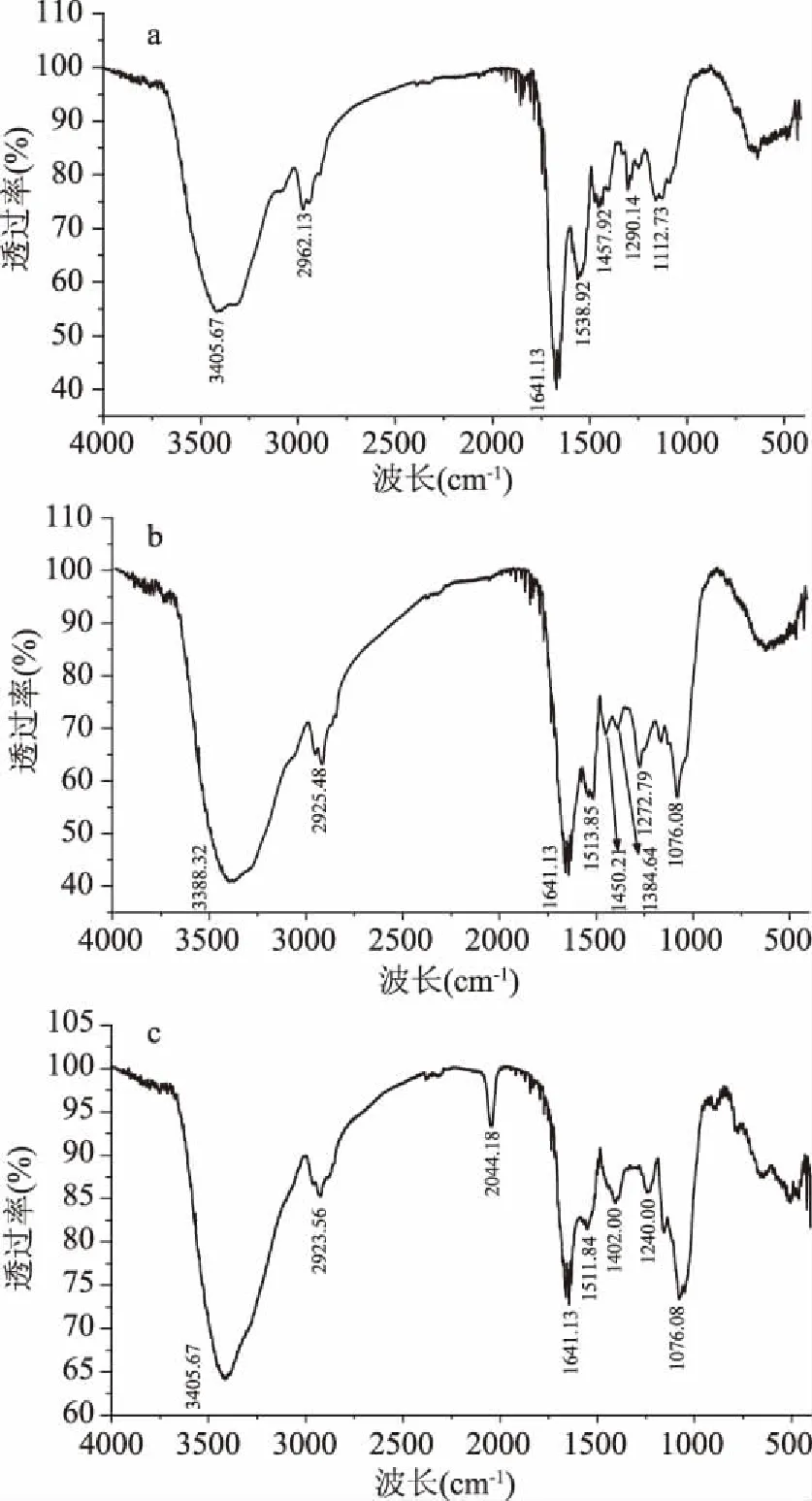
图2 各样品的红外面光谱图Fig.2 FTIR spectra of samples注:a. 紫薯蛋白;b. 紫薯蛋白花色苷复合物;c. 紫薯蛋白-葡萄糖美拉德产物。
傅里叶红外光谱广泛地应用在蛋白质二级结构的测定中。不仅能够对蛋白质的空间结构进行反映,而且可以提供蛋白质分子中的氨基基团。N-H伸缩振动与酰胺A有关,其吸收峰出现在3400~3440 cm-1范围内,当它与氢键缔合后,会向低波数发生位移[19],从图2可以得到,紫薯蛋白、复合物、美拉德产物的酰胺A分别出现在3405.67、3388.32、3405.67 cm-1。紫薯蛋白、复合物、美拉德产物分别在2962.13、2925.48、2923.56 cm-1处有弱吸收,是由酰胺B的CH2不对称伸缩引起的,其中复合物、美拉德产物与紫薯蛋白相比略有红移。相较于紫薯蛋白、复合物在1641.13处的吸收强度,美拉德产物吸收较低,这是来自酰胺I带的C=O伸缩振动。三种物质分别在1538.92、1513.83、1511.84 cm-1处的吸收是酰胺II带的特征吸收峰。紫薯蛋白在1457.92 cm-1及复合物在1450.21、1384.64 cm-1、美拉德产物在1402.00、1240.00 cm-1处的吸收可能是甲氧基中C-H面内弯曲振动吸收峰。紫薯蛋白在1112.73 cm-1处的吸收低于复合物及美拉德产物分别在1076.08 cm-1处的吸收强度,这一部分的吸收可能是由C-O-C伸缩振动引起的。
2.3 美拉德产物差式扫描量热(DSC)分析
蛋白质的变性热能够反映蛋白质在温度变化较大时其维持空间结构及次级键(主要是氢键)不被破坏、不断裂的稳定性的能力[20]。差式量热扫描法是检测包括蛋白质在内的物质的热性质的一种技术方法,工作原理是在控温程序下,测量升温、降温、恒温过程中样品与参比物之间的热量差与温度的关系。图3所示为紫薯蛋白、紫薯蛋白花色苷复合物、紫薯蛋白-葡萄糖美拉德产物的差式扫描量热图谱。从图3中可以看出,这三种物质在室温下就已经呈现变性趋势,表明这三种物质在室温下稳定性较差。紫薯蛋白和复合物的变性峰温度相差不多,分别为73.08、73.93 ℃。而紫薯蛋白-葡萄糖美拉德产物的变性峰温度有所提高,为76.00 ℃,这表明糖基的接入改变了紫薯蛋白的结构和构象,形成了变性峰值更大的新的物质。紫薯蛋白、紫薯蛋白花色苷复合物、紫薯蛋白-葡萄糖美拉德产物的变性焓值分别为554.8、466.1、366.7 J/g。说明自然环境中,紫薯蛋白结合了花色苷之后稳定性有所增强,制备的紫薯蛋白-葡萄糖美拉德产物稳定性比紫薯蛋白有所降低。

图3 DSC分析图谱Fig.3 DSC spectra of samples
2.4 紫薯花色苷对紫薯蛋白-葡萄糖美拉德产物的荧光光谱影响
荧光是光致发光现象。一般蛋白质都具有荧光特性,是因为蛋白质中的色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)残基具有荧光特性,这种荧光特性属于内源荧光特性,并且这三种残基具有不同的荧光光谱[21]。其中色氨酸残基的荧光强度最大,所以通常利用Trp的荧光性质来研究蛋白分子与猝灭剂之间的相互作用。由图4可以看到,美拉德产物的发射波长在310、340 nm左右出现峰值,其中310 nm处是由酪氨酸残基产生的,340 nm处是由色氨酸残基产生的,但340 nm处的峰值明显高于310 nm处的峰值。表明紫薯蛋白-葡萄糖美拉德产物的荧光特性主要来源于色氨酸残基。随着不同浓度花色苷的加入,色氨酸残基与酪氨酸残基的荧光性减弱,荧光强度不断降低。这证明花色苷与紫薯蛋白-葡萄糖美拉德产物之间产生了相互作用,对美拉德产物荧光形成了动态猝灭或者静态猝灭。

图4 紫薯花色苷与紫薯蛋白-葡萄糖产物相互作用的荧光光谱图Fig.4 Flourescence spectra of PSPA-PSPPMP systems注:a→n:c花色苷浓度/c美拉德产物浓度=1~12。
2.5 荧光猝灭机制
荧光猝灭机制有三种:动态猝灭、静态猝灭、非辐射能量转移。在动态猝灭机制下,当荧光物质体系中加入猝灭剂后,猝灭剂会与处于激发态的荧光物质接触并发生碰撞,从而产生能量和电子转移,使荧光物质回到基态不再发射光子。这一过程跟时间相关。静态猝灭机制下,猝灭剂加入到荧光体系后会与基态荧光物质接触并发生反应,生成新的基态复合物,复合物吸收光子后并不发射荧光。荧光猝灭机制的判定一般通过Stern-Volmer方程(2-1)来确定[22]。
F0/F=1+KSV[Q]=1+Kqτ0[Q]
式(1)
F0和F分别是美拉德产物加入花色苷前后的荧光强度;KSV、Kq、τ0、[Q]依次为猝灭常数、猝灭速率常数、不含猝灭体时生物大分子的平均荧光寿命(通常τ0=10-8s)和猝灭体的浓度[23]。一般,静态猝灭主要是因为形成了复合物,随着温度的升高复合物稳定性会下降,静态猝灭常数也会因此下降;动态猝灭主要是因为分子间的相互碰撞及扩散引起的,随着温度的升高,动态猝灭常数也会升高。通过这种温度的特点,可以判断猝灭机制。
根据Stern-Volmer方程,分别在298.15、303.15、308.15 K三个温度下测定计算了美拉德产物与花色苷的猝灭常数。结果见图6和表1。
一般,当荧光物质为生物大分子时,其最大扩散碰撞猝灭常数为2×1010L·mol-1s-1,当Kq>2×1010L·mol-1s-1时,属于静态猝灭,反之,则属于动态猝灭[24-25]。由表1可知,花色苷对美拉德产物的猝灭常数远大于2×1010L×mol-1s-1,且KSV值随温度的升高而减小。图5中拟合曲线并不是一条直线,是一条弯曲向上的上升曲线,这表明体系中既存在静态猝灭也存在动态猝灭。由此说明,紫薯花色苷对美拉德产物的猝灭主要是形成了新的复合物引起的静态猝灭。

图5 不同温度下紫薯花色苷与美拉德产物相互作用的Stern-Volmer曲线Fig.5 Stern-Volmer plots of PSPPMP interacting with PSPA at different temperatures

图6 不同温度下紫薯花色苷与美拉德产物相互作用的模拟曲线Fig.6 Fitting curve of PSPPMP interacting with PSPA at different temperatures

T(K)KSV(×104 L/mol)Kq(×1012 L/mol/s)R2298.153.0503.0500.9986303.153.0143.0140.9996308.152.9912.9910.9977
2.6 结合常数和结合位点数的确定
结合常数和结合位点数的确定采用双对数曲线方程得出,方程如下[26]:
lg[(F0-F)/F]=lgKa+nlg[Q]
式(2)
Ka:结合常数;n为结合位点数。以lg[(F0-F)/F]对lg[Q]作出拟合曲线如图7。结合常数及结合位点见表2,紫薯花色苷与紫薯蛋白-葡萄糖美拉德产物在不同温度下的结合位点数分别为1.273、1.336、1.323,温度变化对其影响很小,表明紫薯花色苷与紫薯蛋白-葡萄糖美拉德产物之间的相互作用力很强。

图7 不同温度下紫薯花色苷与美拉德产物相互作用的双对数曲线Fig.7 The double logarithm regression plots of PSPPMP interacting with PSPA at different temperatures

表2 不同温度下紫薯花色苷与美拉德产物相互作用结合常数Table 2 The binding constants of PSPPMP interacting with PSPA at different temperatures
2.7 热力学参数和作用力分析
分子间的作用力主要有范德华力、疏水作用力、静电引力和氢键等。一般通过反应热力学参数来确定作用力类型,比如通过反应前后热力学参数焓变和熵变的大小就可判断主要作用力类型。当ΔH>0、ΔS>0时,作用力为疏水作用力;当ΔH<0、ΔS>0时,为静电作用力;当ΔH<0、ΔS<0时,为范德华力和氢键作用力,这说明分子间作用力也可能存在多种作用力作用的情况[27-28]。
当温度变化不大时,ΔH可看成是一常数,热力学参数和小分子与蛋白质之间的作用力关系可通过以下方程计算得出:
式(3)
ΔG=ΔH-TΔS=-RTlnKa
式(4)
根据公式(2~4)及上述所得Ka,可以计算出花色苷与美拉德产物相互作用的热力学函数值,结果见表3。紫薯花色苷与美拉德产物的相互作用的ΔG<0,表明该反应可自发进行;ΔH<0,ΔS<0表明花色苷与美拉德产物结合的作用力主要表现为范德华力和氢键作用力。

表3 不同温度下紫薯花色苷与美拉德产物相互作用的热力学参数Table 3 The thermodynamics parameters of PSPPMP interacting with PSPA at different temperatures
2.8 同步荧光光谱分析
测定荧光光谱时,色氨酸、酪氨酸、苯丙氨酸残基的激发和发射光谱都不完全相同,谱图之间会产生干扰,所以不能同时测定。一般通过固定激发和发射单色器的波长差Δλ来测定单一的不同氨基酸残基,得到同步荧光光谱,同步荧光光谱可以反映生色团分子周围环境的信息。当Δλ=15时,可测定酪氨酸残基荧光吸收光谱;当Δλ=60时,可测定色氨酸残基的荧光吸收光谱。由荧光吸收光谱可以判断蛋白质中氨基酸残基微环境的变化[29-30]。由图8可知,随着花色苷浓度的不断增加,紫薯蛋白-葡萄糖美拉德产物中酪氨酸、色氨酸残基的同步荧光强度均逐渐减弱。其中酪氨酸残基的最大发射波长并未发生明显变化,而色氨酸残基的最大发射波长发生了轻微的蓝移,这说明紫薯花色苷的加入,使紫薯蛋白-葡萄糖美拉德产物的构象发生了变化,使色氨酸残基处的微环境改变。色氨酸残基最大发射波长的蓝移以及色氨酸残基荧光猝灭程度大于酪氨酸残基表明,紫薯花色苷与紫薯蛋白-葡萄糖美拉德产物的结合位点更接近色氨酸残基。这一点与本实验室郭莹等研究的紫薯花色苷与紫薯蛋白的相互作用一致[10]。

图8 紫薯花色苷和紫薯蛋白-葡萄糖美拉德产物反应的同步荧光光谱图Fig.8 Synchronous scanning fluorescence spectra of PSPPMP interacting with PSPA注:1:Δλ=15 nm;2:Δλ=60 nm;a→n:c花色苷浓度/c美拉德产物浓度=1→12。
3 结论
以紫薯蛋白和葡萄糖为原料,通过美拉德反应制备紫薯蛋白-葡萄糖美拉德产物,并研究产物的理化性质及其与花色苷的相互作用。研究结果表明,紫薯蛋白-葡萄糖美拉德反应主要产物的分子量约为25 kDa。美拉德产物的红外光谱吸收强度低于紫薯蛋白花色苷复合物,尤其于酰胺I带处的红外吸收强度。紫薯蛋白-葡萄糖美拉德产物变性峰温度为76 ℃,高于紫薯蛋白、紫薯蛋白花色苷复合物;三者变性焓值分别为554.8、466.1、366.7 J/g。紫薯蛋白-葡萄糖美拉德产物的最大荧光发射波长是340 nm,紫薯花色苷对其猝灭机理属于动静态联合猝灭,静态猝灭起主导作用。二者之间的作用力属于强作用力,主要表现为范德华力和氢键。花色苷与紫薯蛋白-葡萄糖美拉德产物的结合位点更靠近色氨酸残基。改性后的紫薯蛋白其溶解性、乳化性、起泡性等功能特性后续将进一步研究探讨。

