循环miR-21对新辅助化疗非小细胞肺癌患者的检测价值
董大鹏,安 然,刘 威
(吉林大学第一医院二部,吉林 长春130031)
非小细胞肺癌(NSCLC)作为较常见的肺癌,起病隐匿,通常发现较晚[1]。而手术根治是其主要的治疗手段,但存在复发率高预后不佳等问题[2]。近年来,研究发现新辅助化疗可在一定程度上降低术后的复发率[3],但缺乏明确指标提示何类患者受益更大。miR-21被证实在多种肿瘤中表达异常且与化疗耐药相关[4]。因此本研究拟探究血清miR-21对NSCLC新辅助化疗预后的检测价值。
1 材料和方法
1.1 临床资料
收集吉大一院二部2015年12月至2016年12月的住院患者血清标本115例,分别为非小细胞肺癌组85例,健康对照组30例,基本资料见表1。每例NSCLC患者至少经过CT和组织病理学确诊为NSCLC。NSCLC患者临床分期为Ⅰ(14例,16.5%)、Ⅱ(50例,58.8%)、Ⅲ(21例,24.7%),诊断依据为《原发性肺癌诊疗规范(2011年版)》。采血前未进行针对肿瘤的任何治疗措施。健康对照组血清来自本医院体检中心。留血后离心,血清于-80℃冰箱超低温保存。
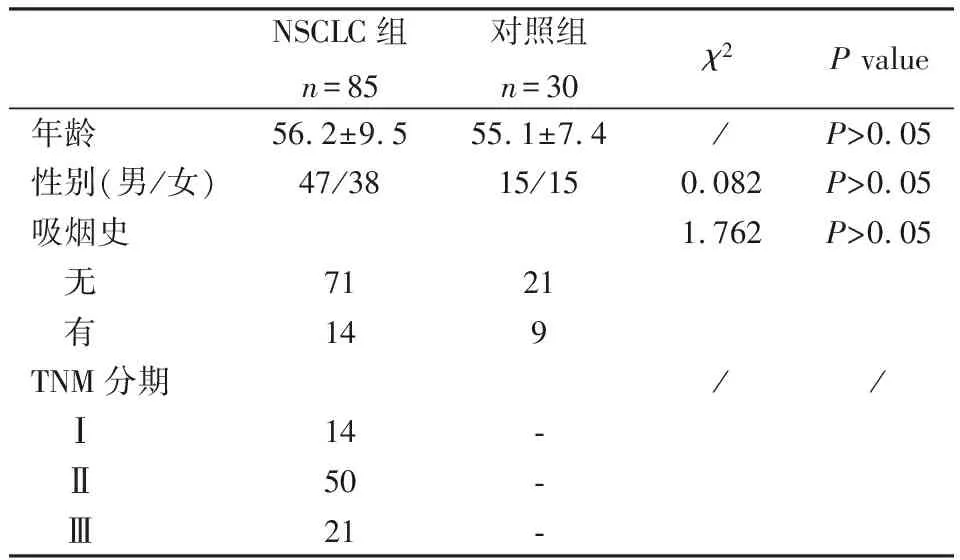
表1 NSCLC组与正常对照组一般资料比较
1.2 治疗方案
85例NSCLC患者进行手术切除治疗,治疗前加用GP方案新辅助化疗。第1-3天给予静脉滴注顺铂(30 mg/m2/生理盐水500 ml);第1至第8天给予静脉滴注吉西他滨(1000 mg/m2/生理盐水250 ml),滴注时间为30 min。化疗前静脉滴注地塞米松(5 mg/250 ml生理盐水)止吐。连续2周期42天辅助化疗。术后行4个疗程GP方案化疗。
1.3 实验试剂
美国Thermofisher公司 mirVanaTMPARIS Kit试剂盒、苏州金唯智生物科技有限公司miR-21和miR-232引物、北京全式金生物技术有限公司TransScript Green miRNA Two-Step qRT-PCR SuperMix试剂盒。
1.4 血清RNA逆转录和miRNA荧光定量
术前血清microRNA提取按照mirVanaTMPARIS Kit试剂盒说明书步骤进行,提取的microRNA采用加尾法进行逆转录,进而进行荧光定量,具体步骤按照TransScript Green miRNA Two-Step qRT-PCR SuperMix。血清中miRNA-232的Ct值NSCLC组和对照组无统计学差异(见图1),故血清miRNA内参选用miR-232。血清miRNA荧光定量数据处理采用2-ΔΔCt法相对定量法,公式如下:ΔΔCtNSCLC=(CtmiR-21-CtmiR-232)NSCLC-mean(CtmiR-21-CtmiR-232)Control;ΔΔCtControl=(CtmiR-21-CtmiR-232)Control-mean(CtmiR-21-CtmiR-232)Control。
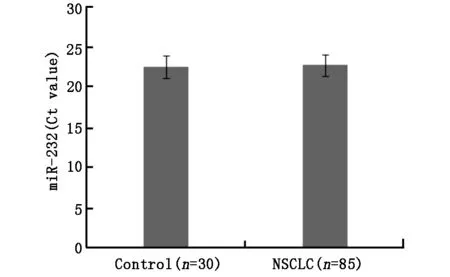
图1 血清miR-232在NSCLC中表达水平
1.5 统计学分析
研究使用卡方检验(χ2)和Student T-检验来评估NSCLC患者和正常对照之间临床变量的频率(IBM SPSS Statistics,Version 21.0.Armonk,NY:IBM Corp),P<0.05差异显著。
2 结果
2.1 NSCLC组和对照组血清miR-21表达量比较
通过荧光定量法测定85例NSCLC患者和30例正常对照组血清中miR-21含量,结果显示NSCLC患者血清中miR-21的相对表达量为12.54±14.54显著高于其在正常对照组血清中的相对表达量1.81±1.75(P<0.01),见图2和表2。

注:**P<0.001 与对照组相比
表2 血清miR-21在NSCLC组和对照组中的相对表达量

miR-21(2-ΔΔCt)Control1.81±1.75NSCLC12.54±14.54∗∗P value0.00
2.2 血清miR-21诊断NSCLC的价值
为了解血清miR-21在NSCLC患者中的诊断价值,采用ROC曲线进行评价。结果见图3和表3,miR-21对诊断NSCLC的ROC的AUC为0.854(0.785-0.922),最佳截取值为5.766,此时血清miR-21诊断NSCLC的敏感度为60.0%,特异度100.0%。
2.3 血清miR-21与新辅助化疗NSCLC患者复发的关系
为了解血清miR-21与新辅助化疗NSCLC患者复发之间的关系,将1年内复发患者、未复发患者和正常对照组血清miR-21含量进行比较。结果见图4和表4,结果显示复发NSCLC患者血清中miR-21的相对表达量为27.28±16.36显著高于未复发NSCLC组和正常对照组血清中的miR-21相对表达量5.03±3.87和1.81±1.75(P<0.01)。

图3 血清miR-21诊断NSCLC的ROC曲线
表3血清miR-21诊断NSCLC的ROC曲线线下面积和置信区间

AUC95%CImiR-210.8540.785-0.922
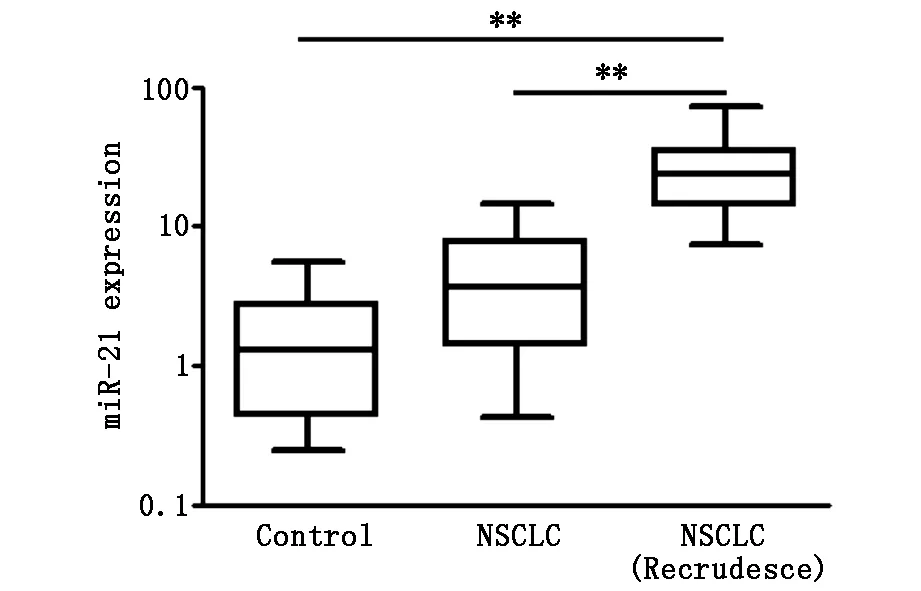
图4 血清miR-21在复发患者血清中的表达量
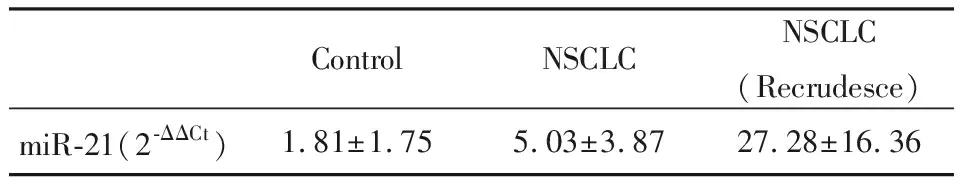
ControlNSCLCNSCLC(Recrudesce)miR-21(2-ΔΔCt)1.81±1.755.03±3.8727.28±16.36
3 讨论
miR21由单个基因编码,其位于17p23.2的脆弱位点FRA17B上,并与编码跨膜蛋白49的基因(TMEM49,也称为VMP1)重叠[5]。miR21在肺癌,乳腺癌,胶质母细胞瘤,胃癌,胰腺癌,胰腺神经内分泌肿瘤,肝癌,胆管癌,结肠癌和前列腺癌中过表达[6-8]。miR21通过调节靶基因参与肿瘤细胞侵袭,血管浸润和转移等[9,10]。此外,miR21在结直肠癌患者中的高表达与临床分期,淋巴结转移和远处转移相关,乳腺癌和肝转移阶段伴随着miR21表达水平的增加[11]。一些研究也证实miR-21与化疗耐药相关,抑制胆管癌细胞中miR-21的表达可以增加细胞对吉西他滨的敏感性,高miR-21表达与基于5-FU的化疗反应差, 预后不良有关[4,12]。
因此,我们通过检测非小细胞肺癌患者行新辅助化疗前血清中miR-21的表达量,分析循环miR-21含量与NSCLC新辅助化疗预后的关系。首先,通过对比85例NSCLC患者和30例正常对照组血清中miR-21含量,证实NSCLC患者血清中miR-21的相对表达量为12.54±14.54显著高于其在正常对照组血清中的相对表达量1.81±1.75。另外,miR-21对诊断NSCLC的ROC的AUC为0.854(0.785-0.922),最佳截取值为5.766,此时血清miR-21诊断NSCLC的敏感度为60.0%,特异度100.0%。这些结果说明miR-21可作为NSCLC的诊断标志物。进一步,我们将1年内复发患者、未复发患者和正常对照组血清miR-21含量进行了比较,发现复发NSCLC患者血清中miR-21的相对表达量为27.28±16.36显著高于未复发NSCLC组和正常对照组血清中的miR-21相对表达量5.03±3.87和1.81±1.75。这一结果说明循环miR-21含量越高患者预后越差。
综上所述,循环miR-21可作为NSCLC的诊断标志物,GP方案对于循环miR-21含量较低的NSCLC患者具有较高的应用价值。

