CO2分压对贴壁细胞MRC-5连续传代培养的影响
张伊丽 刘照平 陆敏依 蔡明勇 吴根鹏
(上海荣盛生物药业有限公司,上海 201108)
生物制品的质量控制不仅是对终产品的质量控制,而且是对整个生产过程的连续监控,包括原材料、中间品和制检过程的质控。细胞基质作为病毒性疫苗生产过程中必不可少的原材料,其状态优劣直接影响疫苗产品的质量和产量。MRC-5细胞是人胚肺成纤维细胞,可进行体外传代培养,对多类病毒敏感[1]。自建株以来用于多种病毒性疫苗的生产和检定,得到了良好的安全性验证,如水痘疫苗[2]、带状疱疹疫苗[3]、甲肝疫苗[4]及狂犬疫苗[5]。但MRC-5作为二倍体细胞,具有一定的传代寿命,超过一定代次细胞衰老,与传代细胞相比难以大规模生产。因此提高细胞状态和使用代次对该细胞的产业化应用具有重要意义。
细胞生长的微环境对细胞的影响极大。对于已建株的细胞系,很多工作都是围绕优化培养而开展[6-9]。pH是细胞培养过程中一个重要参数,并且不同细胞株有不同的pH适应范围[10-13]。根据细胞培养方式不同,悬浮培养(包括悬浮细胞和贴壁细胞的微载体培养)使用反应器控制pH更为精确和容易,在一定范围内的pH波动对细胞生长和产物表达不会产生太大影响[14-16]。而贴壁细胞有较多的方瓶、转瓶和细胞工厂静置培养方式,此类容器pH可控性差,在pH条件的优化研究中更多体现在培养起始阶段[6,17-19],对培养过程中pH动态变化及对细胞产生的影响研究较少。
目前较市售应用的细胞培养基多添加NaHCO3作为缓冲盐,匹配合适的CO2浓度组成pH缓冲对体系。空气中CO2分压会影响培养液pH的稳定性。特别是在开放式培养皿培养细胞或进行高浓度的转化细胞系培养时,需要使用CO2培养箱以保证足够的CO2分压。本实验以NaHCO3调节细胞培养基pH值,并在pH 7.2-7.6范围配合CO2使用情况,对MRC-5细胞连续传代过程中的细胞状态、工作代次和病毒敏感性进行检测分析,旨在提高MRC-5细胞连续传代水平。
1 材料与方法
1.1 材料
1.1.1 细胞 MRC-5细胞(ATCC)由本公司疫苗生产部提供建库,代次为27代,浓度为5.0×106个/mL。水痘-带状疱疹病毒(VZV)毒种,由本公司疫苗生产部提供,代次为32代,滴度约为5.0 Lg PFU/mL。
1.1.2 主要试剂 MEM干粉、胎牛血清、青-链霉素双抗、0.25%胰酶均购自Gibco公司;NaHCO3购自国药集团化学试剂有限公司;台盼蓝溶液购自碧云天生物;EDTA细胞消化液、病毒稳定剂由本公司疫苗生产部提供。
1.2 方法
1.2.1 配制细胞培养液 MEM干粉按照使用说明书溶解后过滤除菌,作为基础培养基备用。按照质量体积比配制5% NaHCO3母液,过滤除菌备用。配制细胞培养液时,使用5%NaHCO3母液调节基础培养基pH,添加胎牛血清10%-15%,抗生素1%。
1.2.2 细胞复苏 从液氮中取出1支冻存的MRC-5细胞,确认批号、代次、浓度,迅速在38±1℃水浴中融化,复苏至T225一次性细胞培养瓶中,轻微摇匀,置37℃,5% CO2浓度的细胞培养箱中连续培养3-4 d至细胞生长成片。
1.2.3 细胞传代培养 复苏细胞生长成片后进行传代。吸去原细胞培养液,添加0.25%胰酶5-10 mL消化1-2 min。加入新鲜细胞培养液重悬,按照1∶4传代比率分装细胞悬液至若干T25细胞培养瓶,置于37℃,5% CO2浓度的细胞培养箱中培养。
约4-5 h细胞贴壁后,更换不同NaHCO3浓度的细胞培养基,并对瓶盖进行封闭式(对照组,CO2气体不能进入细胞瓶)和开放式(试验组,CO2气体可以进入细胞瓶)处理。在继续培养过程中,每隔一定的时间进行培养基pH测定并统计细胞生长密度。每组保留1-2瓶,固定使用同一NaHCO3浓度的培养液和通气处理方式连续传代,并在细胞收获数较低(<0.2×105个/cm2)达不到传代要求时停止实验。
1.2.4 细胞监测 每天用倒置显微镜观察细胞的生长状态,包括细胞的形态、密度、增殖速度等,并拍照记录。在每一次传代的同时统计收获细胞数和细胞活率。
1.2.5 病毒接种及收获 取VZV毒种按照MOI=0.001-0.01接种生长成片的31代细胞,换液后连续培养2-3 d,待病变率达到35%-90%,使用EDTA消化病变细胞,1 800 r/min离心10 min,使用稳定剂重悬,-70℃冻存备用,进行滴度测定。
1.2.6 病毒滴定 以蚀斑法测定病毒滴度。取冻存的病变细胞,在冷冻和37±1℃条件下反复冻融3-4次,镜检观察细胞完整率≤20%。1 800 r/min×10 min离心取上清,对上清液进行500倍和1 000倍稀释。取预先铺满MRC-5细胞的6孔板,每孔接种病毒上清稀释液100 μL,吸附90 min后添加细胞维持液继续培养7 d,统计每孔蚀斑数。

n:每孔蚀斑数(平均值);D:稀释倍数;V:每孔接种体积。
2 结果
添加不同比例NaHCO3母液(2.0%、2.5%、3.0%、3.5%和4.0%)调节MEM基础培养基pH,配制后的完全培养液起始pH值为7.3-7.7。在2.0%和3.0%添加比例时pH分别为7.3和7.5,选择此两种浓度设计实验,观察CO2的使用对细胞培养液pH稳定性以及对细胞培养效果的影响。
2.1 培养条件对细胞培养液pH稳定性的影响
以2.0%封闭培养作为对照组,3%试验组同时设计封闭培养和开放培养,监测31代次细胞培养过程中的pH变化情况并统计。图1显示封闭培养的2%和3%两组细胞在培养2 h后pH即发生急速升高,在8-30 h内达到最高,2.0%组约7.7,3.0%组约8.0,此时培养液呈深红偏紫色。随后,pH开始下降,在96 h后2.0%组下降至7.2-6.8,3.0%组下降至7.3-7.1。此时培养基呈红偏黄色。而开放培养的3%组细胞培养液则相对稳定,在连续144 h的培养过程中最高为7.5,最低为7.2,培养液颜色呈红偏棕黄色。
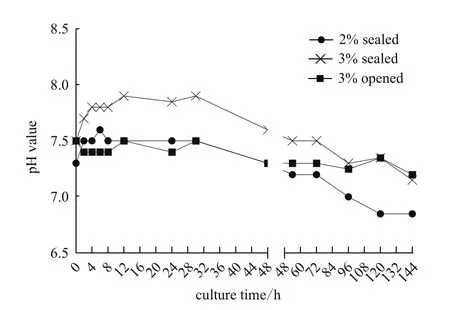
图1 细胞培养过程中pH动态变化趋势
2.2 培养条件对细胞传代培养的影响
镜检观察31代细胞状态,统计并绘制细胞生长增殖曲线。3组细胞在早期贴附、爬壁阶段(24-48 h)生长增殖相近,均可正常贴壁增殖,形态清晰呈典型纤维状。但在72 h汇合率开始体现出差异,3%开放组细胞排列成形,至96 h已有80%以上的汇合率。而封闭培养的细胞则增殖缓慢,细胞折光性强,3%组在培养120 h后仍未能成片(图2)。通过31代细胞生长增殖曲线也可以看出,开放培养的细胞从延滞期进入对数期明显快于封闭组(图3)。
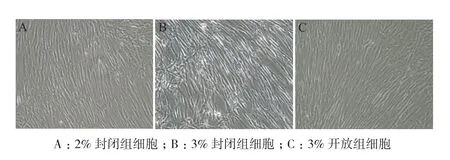
图2 31代细胞生长形态
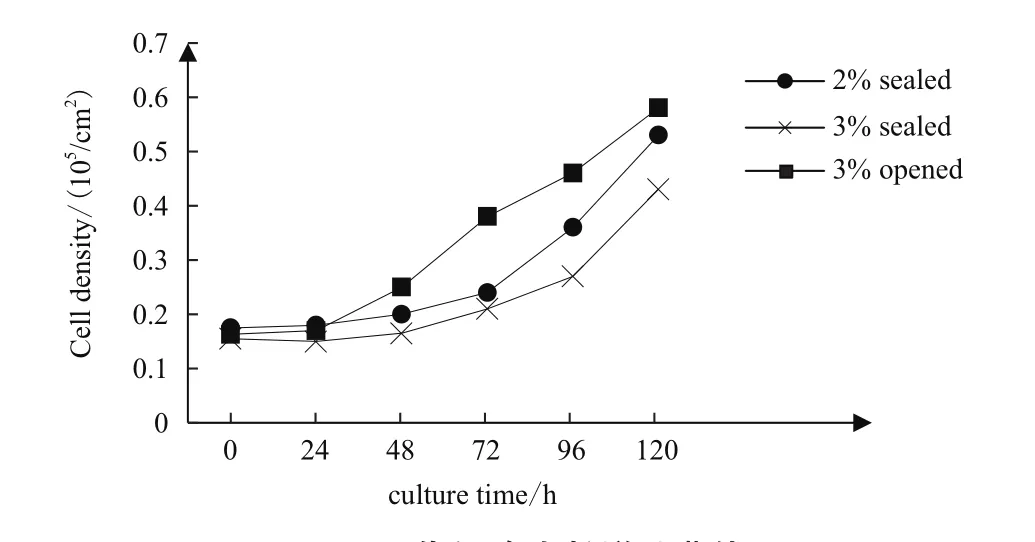
图3 31代细胞生长增殖曲线
传代早期细胞状态和细胞数尚无明显差异,细胞形态清晰呈典型纤维状,成片后细胞排列整齐,汇合率90%以上,收获细胞数在(0.5-0.7)×105个/cm2。连续传代至31代后3组细胞收获密度均开始下滑,细胞形态和细胞活率开始体现出差异。封闭培养细胞折光性增强,胞内颗粒性内涵物逐渐增多,细胞排列散乱,生长增殖速度和细胞活率急剧下降,至35-37代已不能成片,收获细胞数低于阈值,达不到继续传代要求,见图4。开放培养细胞形态仍保持纤维状排列,细胞活率维持在80%以上,细胞状态下降趋势相对缓慢,可连续传代至41代。
2.3 培养条件对细胞产毒影响
取31代细胞接种VZV病毒,观察病毒敏感性并统计产毒滴度。封闭培养细胞接毒后24 h细胞有圆缩、肿大、折光性增强,48 h局部融合病变,病变率约为60%-80%(图5)。收获病变细胞后采用反复冻融法释放病毒,噬斑法检测病毒滴度分别为4.67 Lg PFU/mL和4.60 Lg PFU/mL。开放组细胞病变与封闭组相似,产毒滴度略高约为4.83 Lg PFU/mL,但差异不显著(图6,P=0.13>0.05)。

图4 连续传代细胞收获密度和细胞活率
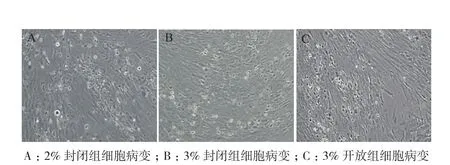
图5 MRC-5细胞接种VZV病变形态
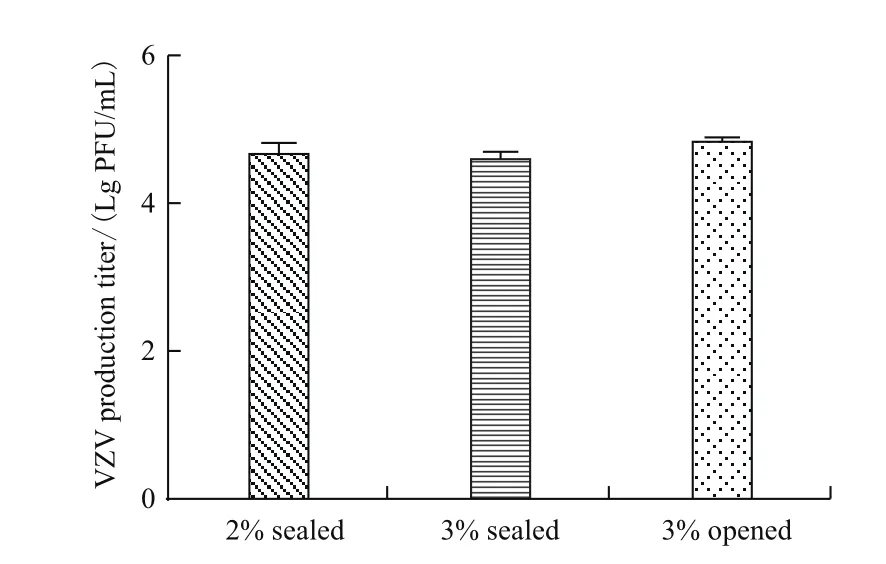
图6 MRC-5细胞接种VZV产毒滴度
3 讨论
细胞培养基除提供细胞生长所必须的营养成分外,还负责维持适宜的理化环境,如pH稳定。培养基一般通过添加碳酸氢盐或其他有机缓冲盐(如HEPES),稳定培养过程中pH变化在一个合理范围。在采用碳酸氢钠作为缓冲时,培养液pH值取决于碳酸氢根(HCO3-)和溶解态CO2浓度之间的精密平衡。若无CO2外环境或CO2分压不足,HCO3-水解反应平衡式右移,导致pH快速升高。而在培养过程中随着细胞生长、增殖,细胞代谢副产物,如乳酸逐渐累积增多,pH才会缓慢下降。这种pH值的较大起伏变化是细胞生长的不利因素。
本实验对细胞培养过程中的pH变化进行了动态监测。从pH变化曲线和对应的细胞生长曲线可以看出,不恰当的培养方式使得碳酸氢根被过度水解消耗,导致细胞培养液pH培养2 h就会急剧升高,并维持至30 h左右。此时细胞生长正处于延滞期,细胞行为处于贴附、爬壁过程中,过高的pH环境会造成细胞贴壁率低,细胞受损等。而在2-3 d(约48 h)后,随着细胞增殖进入对数期,细胞代谢加快,密度升高,细胞产酸增多,pH开始回落。但碳酸氢根浓度过低,已无法起到缓冲效果,导致培养基pH持续走低。pH大幅波动不仅对单代次细胞生长造成损伤,而且这种损伤还可能累积影响整个细胞培养周期。高代次的封闭组细胞折光性增强,细胞内含物、颗粒性物质增多,细胞活率下降明显。而开放组细胞仍能保持胞质均匀清晰,细胞骨架排列整齐,并维持较高的细胞活率,可连续传代至41代。两组细胞接种VZV测试产毒效果,开放组细胞产毒滴度略高于封闭组。综上验证了稳定的pH环境对细胞代次和状态具有重要的影响,并且这种影响会在连续的传代培养中得到累积体现。
疫苗生产用细胞基质通常包括原代细胞、二倍体细胞和连续传代细胞。MRC-5属于人类同源性二倍体细胞系,与原代细胞相比,可建立种子库系统进行充分鉴定和标准化,利于质量控制;与连续传代细胞相比,理论上不存在致肿瘤的潜在风险[20]。但MRC-5由于传代寿命的限制,难以大规模生产。为突破工作代次,提升细胞状态,可添加辅助成分进行优化研究[21-22],但由此可能带来引入外源因子的风险以及产品安全性风险。因此为提高细胞状态选择合适的培养优化方式具有重要意义。本实验仅通过调节NaHCO3浓度配合CO2分压的使用,显著提高了MRC-5细胞状态和连续传代能力,在使用方瓶、或放量应用细胞工厂、转瓶培养MRC-5细胞时,为其优化应用提供了数据支持。
4 结论
通过监测贴壁细胞MRC-5静置培养过程中的pH动态变化,发现不恰当的培养方式会导致细胞在延滞期和对数期早期受到损伤,并且这种损伤会在连续的传代培养中积累。而通过调节NaHCO3浓度与CO2分压的使用,可以明显提高MRC-5细胞状态和连续传代能力。

