抗癌药物埃博霉素的生产及工艺发展
田露 薛仁政 张志敏 薛春仙 沈兰芳 龚国利
(1. 陕西科技大学食品与生物工程学院,西安 710021;2. 陕西省微生物研究所,西安 710043)
埃博霉素是一类以16元大环内脂为中心体的天然细胞毒性化合物[1],到目前为止已有6种埃博霉素及其衍生物被报道(图1)。1993年德国生物技术研究中心(GBF)的Höfle等[2]首先从南非的一处河滩土壤中分离得到了一株具有细胞毒性及抗菌活性的黏细菌——纤维堆囊菌So ce90菌株。两年后,默克研究院的Bollag等[3]在大规模筛选微管抑制剂时发现并命名了这种具有抑菌活性的物质,即埃博霉素A和B。埃博霉素主要通过在低浓度条件下诱导微管蛋白在没有钙离子、微管偶联蛋白及三磷酸鸟苷(Guanosine triphosphate,GTP)的情况下,同微管蛋白N端第31位氨基酸与217-231位氨基酸结合,从而促进三磷酸鸟苷依赖性微管蛋白聚合形成稳定微管[4-6]。这也就导致了肿瘤细胞内的纺锤体出现异常,进而使有丝分裂过程中的分离受阻,由此达到抑制肿瘤细胞的功效。
埃博霉素也可通过和其他药物联合从而杀灭癌细胞,对耐紫杉醇等药物的癌细胞也具有良好的疗效,一些全合成的埃博霉素衍生物不仅可以抑制恶性肿瘤的生长,甚至还可以使恶性肿瘤收缩乃至消失[7-8]。然而天然的埃博霉素在细胞体内具有毒性高、选择性差、易产生耐药性等缺点,且国内目前还没有达到大规模工业化生产埃博霉素的条件,但其巨大的药用价值及市场前景已经引起了生物、医药等多个领域的高度重视,未来极有可能成为继紫杉醇之后的又一高效抗癌药[9-16]。已有一个埃博霉素药物伊沙匹隆(Ixabepilone)由美国食品药品管理局(FDA)批准成为第一个上市的埃博霉素药物IXEMPRA,标志了埃博霉素抗癌新药开发的重大成就。
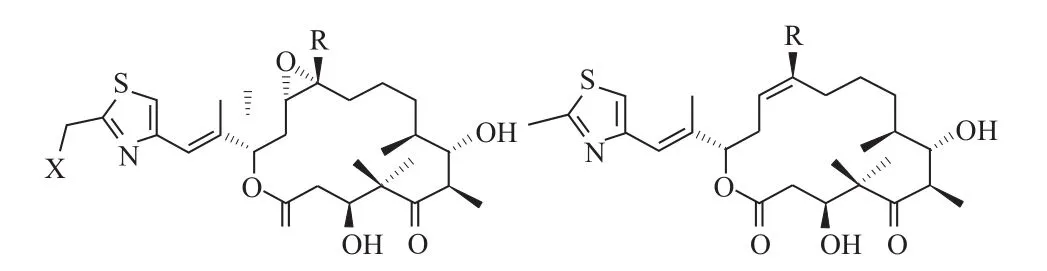
图1 埃博霉素主要化合物的结构
1 埃博霉素的合成
1996年,Gerth等[4]首先通过天然的纤维堆囊菌So ce90菌株生产出了埃博霉素A和B,其产率分别达到22 mg/L和11 mg/L,但后来的许多研究小组均未能成功复现其结果,并且这一产率也远远不能满足工业化生产埃博霉素的需求。因此,研究人员针对如何通过其他方法来提高埃博霉素及其衍生物的产量展开了漫长的研究,主要通过以下几种方法进行合成。
1.1 化学合成法
自Gerth等[4]由黏细菌的次级代谢产物中发现埃博霉素以来,除了通过常规的生物合成法来制备埃博霉素以外,因其相对简单的化学结构也使得人们不断尝试利用化学合成法来制备埃博霉素,并试图通过全合成和化学修饰来获得其衍生物。目前已知的埃博霉素化学合成法大约有30余种,其中典型的包括羟醛缩合成环法、烯烃复分解成环法和内酯化成环法等。然而由于目前已建立的化学合成法其合成路线都十分冗长、分离提纯成本极高且产率较低,真正具有商业价值的化学合成路线并不多[17]。
另外,尽管目前通过化学合成法合成埃博霉素及其衍生物的技术已经相对成熟,但改变这些天然产物的骨架仍是一项重大挑战。基于此,德国的Müller[17]曾提出一种通过化学改造改变这些天然产物骨架的替代方法——通过基因工程技术在阐明生产该有机体的理论基础上,设计出合理的生物合成途径,并将其称为“组合生物合成法”,特别是与半合成方法相结合来改变其天然产物的结构。同时,在了解了控制该生物合成调节机制的基础上,可进一步提高天然产物中埃博霉素的产量,或是将整个基因簇转移到异源宿主中,以更好地进行遗传改良及过表达来提高埃博霉素的产量。
1.2 生物合成法
由于埃博霉素只是黏细菌正常生命活动过程中的一种次级代谢产物,这也决定了天然细菌中埃博霉素的含量较低;另一方面,化学合成法的技术虽然已经相对成熟,但复杂的分离提取过程却使得工业化生产埃博霉素变得遥遥无期。因此,不少研究人员试图通过克隆微生物天然产物生物合成基因簇并使其在合适的宿主中异源表达来优化埃博霉素的生产或产生新的衍生物[18-19]。截至目前,已发现的可用于生物合成埃博霉素的异源宿主主要有共色链霉菌、委内瑞拉链霉菌、大肠杆菌、腐败假单胞菌和黄色黏球菌等[20-21]。
2000年,Tang等[22]首先克隆并测序了在含细胞毒性的纤维堆囊菌中负责埃博霉素生物合成的基因簇,这些基因簇共编码一个负载模块、一个非核糖体肽合成酶模块、8个聚酮合成酶模块和一个P450环氧化酶组成,其中P450环氧化酶用于将脱氧-埃博霉素转化成埃博霉素(图2),这些基因在共色链霉菌中共同表达并产生了埃博霉素A和B,由此证明了共色链霉菌可用于菌株改良,且生长速度比天然生产者快10倍。通过将65.4 kb的包涵了整个埃博霉素基因簇的纤维素链球菌DNA插入到黄色黏球菌的染色体中由此制得了可产埃博霉素A和B的菌株,并通过构建含埃博霉素突变的P450环氧化酶菌株,成功生产出可产埃博霉素C和D的菌株[23-24]。

图2 埃博霉素生物合成基因簇的遗传图谱
相比于天然生物合成法和化学合成法,通过基因工程修饰后的异源宿主产出埃博霉素的能力无论是从纯度还是产量方面都有了质的提升,然而由于埃博霉素对异源宿主产生的细胞毒性使得异源宿主的产量仍无法达到工业化生产埃博霉素的需求。因此,如何进一步提高埃博霉素在异源宿主中的产量无疑成为了国内外当下研究的热点。
1.2.1 启动子对异源宿主生物合成产量的影响 通过RNA聚合酶识别并结合启动子DNA序列来启动基因转录作为转录的分子调控机制之一,这提示我们可通过启动子使宿主的异源基因过表达从而提高产量。然而由于迄今为止关于埃博霉素生物合成启动子的研究仍相对较少,黄黏球菌作为提高埃博霉素产量的最佳宿主之一,也正是因为缺乏有效的启动子从而阻碍了其产量进一步提升的空间[25],因此,如何选择和设计一种有效的启动子来提高埃博霉素产量也是当前的研究热点之一。
2018年,Yue等[25]用两个内源强启动子P-pilA和P-groEL1替换黄色黏球菌埃博霉素生物合成基因簇的原始启动子P-epo,相比于只在稳定期起作用的原始启动子,两个内源强启动子的转录能力虽然在生长阶段很强,但在生长后期却大幅降低,综合产量仍低于前者。但若进一步通过串联重复启动子而转录整个埃博霉素基因簇(其模式虽与P-epo相似,但在促进埃博霉素产生方面明显高于P-epo),可使总产量从10 mg/L增加到21.8 mg/L,转录水平提高近2倍,产量提高约1.8倍,且仍有进一步改进的余地。Yue等[25]的研究无疑证明了不同转录方式能显著地影响启动子控制埃博霉素基因表达的效率,同时也为在具有有限已知启动子的宿主中开发有效的启动子来产生有价值的次生代谢产物提供了独特的见解。
1.2.2 通过转座子将基因簇导入异源宿主 转座子作为基因组中一段可移动的DNA序列,由于其可从原位上单独复制或断裂下来,经环化后插入另一位点,并对其后的基因起调控作用,因此常将这一过程用于解释生物遗传进化中分子作用引起的一系列现象,同时也为基因工程和分子生物学研究提供了强有力的理论依据[26]。
Fu等[27]在 Bryan等[28]研究的基础上,发现可通过转座子将大型转基因传递到异源宿主。他们用基因重组技术来改造埃博霉素基因簇用以在异源宿主中表达,并通过拼接技术成功从两个克隆基因簇中重构出了58 kb的埃博霉素基因簇,之后用异源宿主中的启动子替换原埃博霉素的启动子,从而在异源宿主黄链球菌中转染并表达了工程基因簇,其产量达到了500 mg/L。2017年,Bian等[29]又通过电穿孔技术建立了一个简单的转化体系,将来自纤维堆囊菌的56 kb埃博霉素生物合成基因簇通过随机转座导入到伯克霍尔德氏菌DSM 7029菌株的染色体中,经检测共发现两种启动子(TN5-KAN和PTET)在该菌株中起作用。在经过培养基优化、外源甲基丙二酰-辅酶A生物合成途径的引入和稀有tRNA基因的过表达(宿主改良)使得埃博霉素的总产量增加了约75倍,达到307 μg/L,且产量仍有提升的余地,这一研究也对其他黏细菌性聚酮合成酶和非核糖体肽合成酶的异源表达和加速基因组挖掘过程具有广泛的指导作用。
1.2.3 CRISPR-dCas9技术在埃博霉素合成中的应用 CRISPR-dCas9基因编辑技术是一种对靶向基因进行特定DNA修饰的技术,其介导的转录激活技术更是一种适用范围广泛的可用于提高微生物次级代谢产物转录效率的技术[30]。Peng等[31]首先通过优化Cas9密码子使其与黄色黏球菌相匹配,并通过基因突变使核酸酶失活,从而在黏细菌中构建并激活了用于微生物次生代谢产物生物合成的CRISPR/dCas9激活体系,然后比较了不同酶和激活蛋白对埃博霉素的产生和生物合成基因表达的改善效果,我们确定dCas9激活子的过表达促进了埃博霉素的生成。这也是首例在黏细菌中构建CRISPR/dCas9激活系统并测定其对微生物次级代谢产物生物合成的激活作用的应用实例。
2 生物法合成埃博霉素基础上的产量提升
无论研究人员通过何种方法来生产埃博霉素或是其衍生物,他们都需要面对如何进一步提升其产量的问题,产量的高低直接决定了其研究成果的普及程度。目前最常见的方法就是通过物理、化学诱变来提高埃博霉素的产量,典型的实例包括美国BMS公司通过传统的诱变育种技术(紫外及硝基胍诱变)来提高埃博霉素B的产量,国内方面诸如龚国利等[32]通过化学诱变来提升埃博霉素A和B的产量,而除此以外还有一些特殊的方法可用于提高埃博霉素的产量。
2.1 通过全基因组改组育种方法提高产量
对次级代谢产物而言,其合成主要是由微生物细胞内的多酶体系催化完成的,多酶体系中的各个酶由分散或连锁的结构基因编码,但由于人们至今仍不了解完整的次级代谢产物合成基因的性质,因此很难通过定向育种完成次级代谢产物产生菌的基因改造,在这样的背景下Zhang等[33]于1998年在DNA重排(DNA shuffling)育种技术的基础上提出了全基因重排(Genome shuffling)育种技术,即对原始菌株进行诱变育种从而获得多个产量有所提高的菌株,在此基础上构建突变候选株文库,再将这些表型提高的菌株作为首轮多亲本融合的直接亲株进行多亲株的融合,使其全基因组进行随机重组,获得第一代融合株,再以其作为下一轮起始时的原始菌株并重复上述操作,最终从获得的突变体库中筛选出性状被提升的目的菌株。
2012年,龚国利等[34]对全基因组改组育种方法进行了改良——在递归原生质体融合的过程中增加了原生质体的诱变过程,并用改良后的全基因组改组育种方法选育埃博霉素B高产菌株,在经过3轮全基因组改组育种后成功选育到了2株遗传稳定的高产埃博霉素B重组菌株,其中一株重组菌株埃博霉素B的产量达到了42.5 mg/L,相比于原始菌株产量(13.8 mg/L)提高了3倍。这无疑证明了证明改良后的基因组重组技术不仅能有效提高埃博霉素B的产量,且比传统的基因组重组技术更为高效。
2.2 通过糖基化修饰提高产量
蛋白质的糖基化是一种在蛋白质翻译后进行修饰的过程,在糖基转移酶作用下糖被转移至内质网和高尔基体上的蛋白质,并与蛋白质上的氨基酸残基相结合形成糖苷键,在经过一系列的修饰后可转化为糖蛋白[35]。
基于此,Gao等[36]提出化学法对该化合物进行半乳糖基化修饰并用发酵法合成埃博霉素B,从而使高活性的埃博霉素选择性地积聚在肿瘤细胞中,且在正常细胞中的丰度降低,由此达到选择性杀伤癌细胞的目的,这样不仅可以降低埃博霉素的毒性,还可提高其对肿瘤细胞的杀灭作用,实现肿瘤细胞的靶向治疗。经检测发现,游离埃博霉素B与半乳糖化埃博霉素B的细胞毒性比为150左右,这也为埃博霉素糖苷靶向治疗癌症提供了一条新思路。
2.3 通过调节细菌负转录调节因子提高产量
Yue等[37]通过鉴定埃博霉素生物合成的转录调节器ESI发现,它可与埃博霉素启动子结合以下调基因簇中所有基因的转录从而影响埃博霉素的合成,ESI的过量表达抑制了埃博霉素的产生,而该基因的失活促进了埃博霉素的产生,其产量可由9.9 mg/mL增加到13.7 mg/mL,这也是第一个为埃博霉素生物合成鉴定的转录调节子。然而,因为ESI基因仅存在于一些黏细菌基因组中所以这一调节方式在黏细菌中并不普遍,并且由于原核生物中没有组蛋白,其详细的分子功能模式需要进一步研究。
2.4 通过调节pH值提高产量
Han等[38]通过使用最新的测序技术对So0157-2菌株进行基因组测序,并在不同的pH条件下测量比较其转录组。结果显示,基因组的扩展受多种内部和外部因素影响。但值得注意的是,通过数据分析他们发现通过掺入外源遗传物质和复制内源基因会出现一种独特的碱式pH改善途径,这也证明埃博霉素的产量一定程度上与其pH值有关。
3 发酵液中埃博霉素的分离提取
相比于化学合成法在生产过程中高昂的成本、复杂的制备及分离提取流程,发酵法通过现代工程技术手段,利用微生物的某些特定功能,可以有目的的得到大量纯度较高且不含抗原的生物制品。而通过对埃博霉素产生菌纤维堆囊菌进行改造并优化其发酵工艺,一定程度上可以说是现阶段工业化生产埃博霉素的最佳途径,但是由于埃博霉素作为一种次级代谢产物所存在的负反馈抑制和黏细菌在液体环境中存在聚团非均匀生长特性,使得埃博霉素的发酵产量远低于预期,而在培养过程中加入固相吸附剂无疑是原位提取埃博霉素并进一步提高其发酵产量的方法之一。
3.1 大孔吸附树脂法
大孔吸附树脂作为一种不含交换基团的高分子吸附树脂,可通过物理吸附从水溶液中选择性的吸附有机物。因其具有不溶于酸、碱及各种有机溶剂、物理化学性质稳定、吸附量大且吸附速率较快、比表面积大、选择性好、解吸条件温和等优点,目前广泛应用于食品、医药、环境等多个领域。而利用大孔吸附树脂来进行埃博霉素的大规模分离提取就是其在医药领域应用的一个典型案例,这也是目前国内应用较为普遍的一个方法。
其中比较出色的包括刘斯淼等[39]通过直接吸附流经HLD-16大孔树脂的发酵液中的埃博霉素从而达到分离提取的目的,经分离提取后埃博霉素的产量可达到 2.105 2 mg/L;此外,还有张庆林等[40]通过利用大孔树脂和硅胶层析技术来进行埃博霉素的大规模分离提取,其中埃博霉素B的产量可达到9.9 mg/L,经两步纯化后纯度可达到95%;胡玮等[41]通过利用混合树脂吸附、固液分步萃取、分子筛层析、结晶和高效液相分离等手段,从黏细菌发酵液中成功分离提取出埃博霉素埃博霉素A和B,其收率达到80%以上。
3.2 多孔陶瓷吸附法
多孔陶瓷材料是一种以刚玉砂、碳化硅、堇青石等为主料、经成型和特殊高温烧结工艺制备的一种具有高开口气孔率的多孔性陶瓷材料,除了可以用作诸如催化剂载体、微晶载体和药剂载体等功能性载体外。因其具有耐高温、耐腐蚀、极佳的吸附能力和良好的生物、化学惰性等优点,故而也可用于医药工业中的疫苗、酶、病毒、核酸、蛋白质等生理活性物质的浓缩、精制和分离提取等。龚国立等通过造孔剂法并对多孔陶瓷进行改性成功制备出一种特殊硅藻土基多孔陶瓷,经检测改性的硅藻土基多孔陶瓷吸附固定纤维堆囊菌发酵后,埃博霉素产量可达到65.7 mg/L,多孔陶瓷固定量量达0.042 g/g[42-43]。
4 展望
自20世纪90年代紫杉醇上市以来,它已经为数以千万罹患癌症的人们带来了一线希望,其在临床方面所取得的成就延福至今,但由于紫杉醇受到来源及耐药性等诸多因素的限制,仍有许多不尽人意之处。而埃博霉素的问世可以说是弥补了紫杉醇绝大多数的缺点,其中最重要的便是相比于紫杉醇需要从植物中提取获得,埃博霉素通过从微生物中提取就可获得的这一天然优势也决定了埃博霉素的生产成本将远低于紫杉醇。尽管目前埃博霉素的产量仍有许多不尽人意之处,但随着研究的不断深入这一缺陷终将得到解决,届时,埃博霉素必将以其高效且廉价的价格成为21世纪的抗癌先锋之一。

