牛棒状杆菌环介导等温扩增快速检测方法的建立及初步应用
冯 洁, 张 泉, 钱 淼, 谢建云, 高 诚
(1.扬州大学兽医学院, 扬州 225009; 2. 上海实验动物研究中心,上海市实验动物质量监督检验站, 上海 201203)
牛棒状杆菌(Corynebacterium bovis, C.bovis)是一种革兰氏阳性小杆菌,条件性致病,世界范围内广泛分布,可感染多种动物,可导致裸小鼠表皮角化过度,俗称“鳞皮病”,也是引起奶牛乳房炎的常见病原菌之一[1,2]。无毛鼠、免疫缺陷鼠一旦感染,几乎终身携带。感染小鼠表现鳞屑状皮炎,SCID小鼠则出现脱毛、形成秃块等症状。通常呈一过性感染,感染后7~10 d出现“鳞屑”,14~20 d内自行消失,但感染至少要持续30 d左右。组织学检查可出现棘皮症、角化过度,真皮层可观察到单核细胞浸润[3-5]。感染动物通常伴随体质量减轻、结膜充血、摄水量增加、异种移植物生长缓慢等现象。对实验动物质量和实验结果有较大影响,因此已被全球众多实验动物机构列为实验大、小鼠尤其是免疫缺陷鼠的重点监测病原体之一。我国于2010年首次报道该菌感染情况[6], 但至今尚未列入国家标准规定的监测项目。仅在2017年颁布的团体标准[7]中规定了该菌的分离培养和PCR检测方法。本研究拟建立一种特异、敏感、高效的环介导等温扩增(loop-mediated isothermal amplification, LAMP)检测方法,旨在为牛棒状杆菌的监测提供技术支持。
1 材料与方法
1.1 材料、试剂及仪器
牛棒状杆菌ATCC 7715(C.bovis)、嗜肺巴斯德杆菌ATCC 35149(P. pneumotropica)、支气管鲍特杆菌ATCC 14065(B. bronchiseptica)、金黄色葡萄球菌ATCC 6538(S. aureus)、绿脓杆菌ATCC 27853(P. aeruginosa)、啮齿柠檬酸杆菌ATCC 51116(C. rodentium)均购自美国标准生物品收藏中心(American type culture collection,ATCC);鼠伤寒沙门菌CMCC50115(S. typhimurium)、福氏志贺菌CMCC 51572(S. flexneri)、肺炎克雷伯杆菌CMCC 46117(K. pneumoniae)均购自中国医学微生物细菌保藏管理中心。
脱氧核糖核酸扩增试剂盒(LAMP法)购自北京蓝谱生物科技有限公司,细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司,DL2000 DNA Marker购自日本TaKaRa公司,琼脂糖购自西班牙Bio-west公司,GoldViewTM核酸染料购自上海赛百盛(SBS)基因技术有限公司。实时浊度仪LA-320c,购自日本荣研化学株式会社。
1.2 方法
1.2.1 引物设计与合成 根据GenBank公布的牛棒状杆菌16S rRNA基因序列,针对其保守区域利用LAMP在线设计软件设计一套LAMP引物,包括外引物F3和B3、内引物FIP和BIP和环引物LB。引物序列如表1,由生工生物工程(上海)股份有限公司合成。

表 1 LAMP扩增引物序列Table 1 The sequences of LAMP primers
1.2.2 基因组DNA提取按照Tiangen细菌基因组DNA抽提试剂盒说明书进行操作。提取的细菌基因组DNA经紫外分光光度计测定A260/280在1.6~2.0范围内方可使用。获得DNA样品于-20 ℃保存备用。
1.2.3 LAMP方法的建立与优化以牛棒状杆菌基因组为扩增模板,灭菌纯净水为空白模板,采用稀释好的LAMP引物,参照LAMP扩增试剂盒说明,采用表2体系进行预实验。将反应管置于实时浊度仪内反应并绘制曲线,曲线上升表示发生扩增反应即为阳性。为确保反应精确性,设置60~66 ℃扩增温度范围、30~75 min反应时间,对反应条件进行优化。
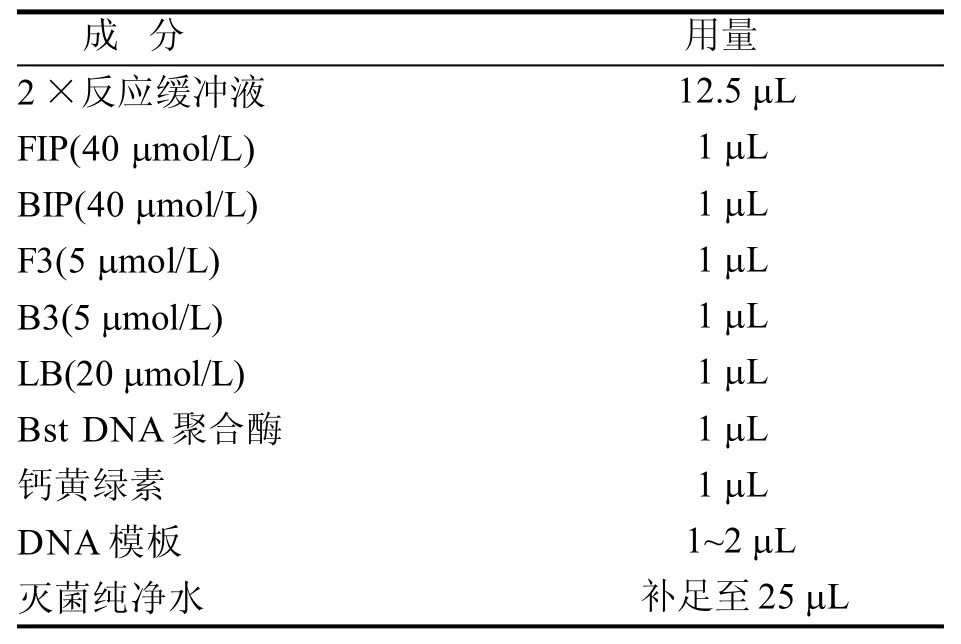
表 2 LAMP扩增体系Table 2 The Amplification system of LAMP
1.2.4 扩增产物检测经2.0%琼脂糖凝胶电泳检测或直接荧光染料目测观察。取2 μL扩增产物经琼脂糖凝胶电泳检测,若出现LAMP特征性的梯形带则判为阳性,未出现扩增条带则判为阴性。在LAMP反应结束后目测,反应管出现绿色荧光判为阳性,橙色则判为阴性。
1.2.5 LAMP特异性检测 以牛棒状杆菌基因组DNA为阳性对照模板,灭菌纯净水为阴性对照模板,嗜肺巴斯德杆菌、支气管鲍特杆菌、金黄色葡萄球菌、绿脓杆菌、鼠伤寒沙门菌、福氏志贺菌、啮齿柠檬酸杆菌、肺炎克雷伯杆菌基因组DNA为模板,利用本文建立的LAMP检测方法分别进行扩增,以评价该方法的特异性。
1.2.6 LAMP灵敏度检测 牛棒状杆菌基因组DNA模板按10 倍梯度稀释成11.8 ng/μL、1.18 ng/μL、118 pg/μL、11.8 pg/μL、1.18 pg/μL、118 fg/μL、11.8 fg/μL、1.18 fg/μL共8个稀释度作为模板,采用本文建立的LAMP检测方法进行扩增,以确定其最低检测限。
1.2.7 临床应用验证无菌采集52只SPF级小鼠(BALB/c小鼠17只, 裸小鼠35只, 均为上海市实验动物生产许可证单位年检抽检样品)回盲部内容物0.2 g, 悬浮于1 mL PBS(pH7.4)中制成悬液, 按照细菌基因组DNA提取试剂盒说明书提取DNA。分别采用LAMP法和团体标准(T/CALAS 20-2017)实验动物 牛棒状杆菌检测方法[7]进行检测,对检测结果进行分析。
2 结果
2.1 LAMP检测方法的建立
为优化扩增条件,对不同反应温度和反应时间进行摸索。如图1所示,温度优化的结果显示60~66 ℃都能将阳性核酸扩增,对照正常,其中64 ℃的出峰时间最早,反应效率较高,故选择64 ℃反应60 min为最佳反应条件。如图2所示,采用本研究建立的LAMP扩增体系对样品进行扩增,结果经电泳检测可见典型梯状条带,阴性对照未见条带。初步表明本研究建立的LAMP扩增方法可行。
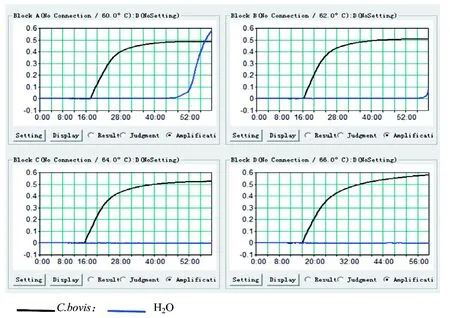
图 1 LAMP反应温度的优化Figure 1 The optimization of the amplification temperature
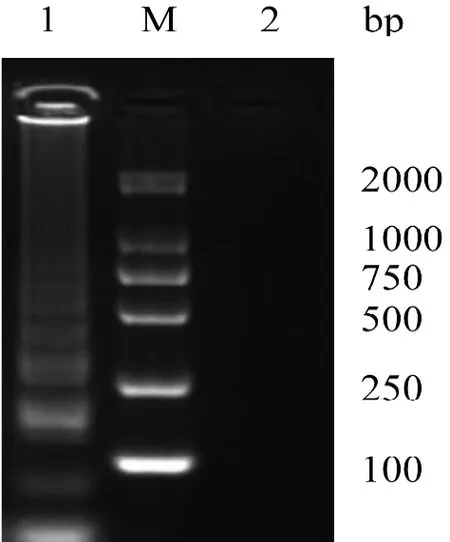
图 2 牛棒状杆菌LAMP扩增结果检测Figure 2 LAMP detection of C. bovis
2.2 LAMP特异性检测
分别以嗜肺巴斯德杆菌、支气管鲍特杆菌、金黄色葡萄球菌、绿脓杆菌、鼠伤寒沙门菌、福氏志贺菌、啮齿柠檬酸杆菌、肺炎克雷伯杆菌的基因组DNA为模板进行LAMP扩增,牛棒状杆菌基因组DNA为阳性对照模板,灭菌纯净水为阴性对照模板。结果如图3、图4所示,仅牛棒状杆菌出现上升性扩增曲线即特异性扩增,而其他菌株均未出现扩增,表明建立的LAMP检测方法特异性良好。
2.3 LAMP灵敏度检测
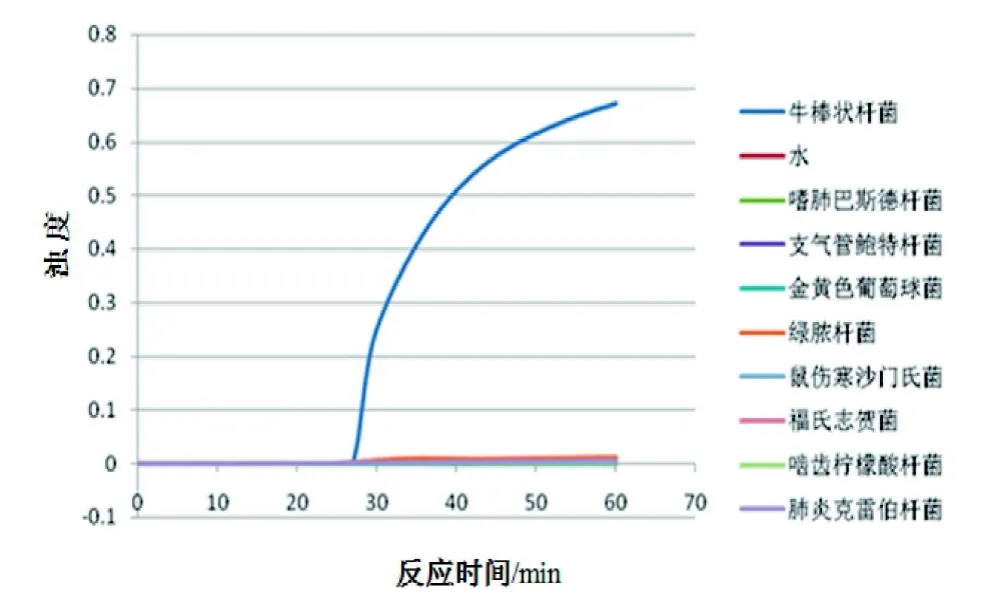
图 3 特异性试验LAMP扩增图Figure 3 LAMP amplification of specificity test
以11.8 ng/μL的牛棒状杆菌基因组DNA为起始浓度, 按10倍梯度稀释后进行LAMP扩增, 以验证LAMP检测体系的敏感性。结果显示本研究建立的LAMP方法能够检出的最低模板量为118 fg(图 5)。
2.4临床应用验证
应用本文建立的LAMP检测方法和团体标准推荐的PCR方法对52份样品进行检测。结果如表3所示,LAMP阳性检出率为98.08%(51/52),PCR阳性检出率为94.23%(49/52), LAMP方法的阳性检出率较PCR高3.85%, 二者符合率为96.15%。
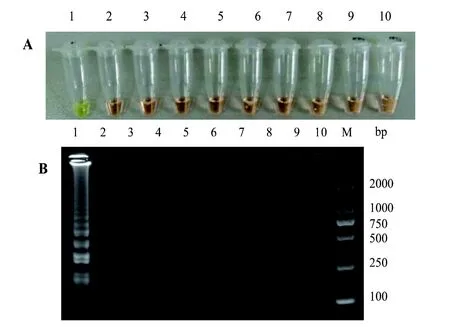
图 4 LAMP特异性试验Figure 4 Specificity test of LAMP
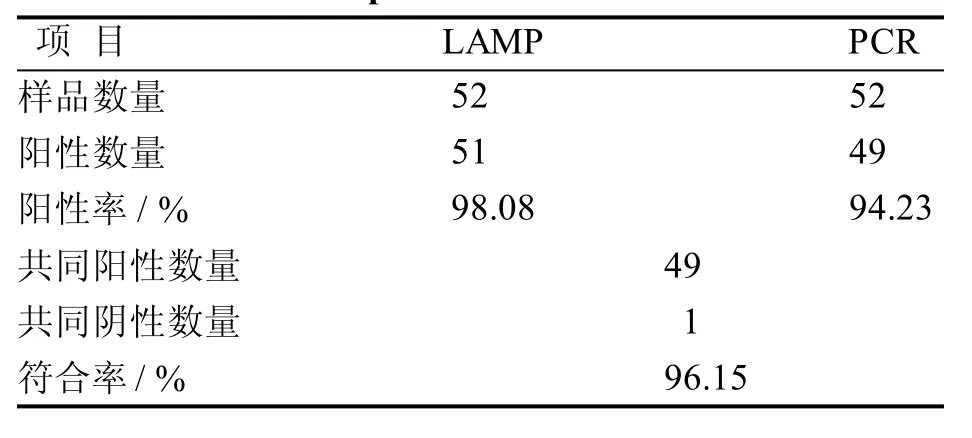
表 3 LAMP和PCR方法的比较Table 3 Comparison of LAMP and PCR
3 讨论
牛棒状杆菌可寄居于感染小鼠的口腔、消化道,引起小鼠角化过度和体质量减轻,牛棒状杆菌感染可影响肿瘤生长、干扰异种移植、改变自然杀伤(NK)细胞活性等。因此感染了该菌的小鼠被认为不适用于科学实验[8-10]。近年来,国际上实验动物设施内牛棒状杆菌污染的案例时有发生,牛棒状杆菌感染成为裸小鼠常见病原体之一[11-14]。实验动物设施内牛棒状杆菌感染控制非常困难,传播迅速,发病率高但死亡率低。携带牛棒状杆菌而无临床症状的裸小鼠是该病重要的传染源,可通过污染物如动物皮屑、垫料、笼具、手套及隔离衣等进行直接传播,还可经移植的肿瘤细胞系进行传播。已污染的设施内通过生物安全柜进行笼盒的更换及相关操作,并不能有效防止该菌的传播[15]。控制该病原体最有效的方法是减少饲养密度和大范围的环境净化。屏障系统、限制人员及物品进出、物品进入设施前充分消毒也是重要的保护手段。环境一旦被污染则很难清除。对于污染群体,一般建议全群淘汰,通过熏蒸重新净化环境,对于珍贵动物则需采用胚胎移植手段进行净化。

图 5 LAMP敏感性试验Figure 5 Sensitivity test of LAMP
目前,该病可通过培养法和分子生物学方法进行诊断。牛棒状杆菌为革兰氏阳性小杆菌,菌体短小、一端或两端膨大呈棒状,无鞭毛、无荚膜、无芽孢,兼性厌氧。生长缓慢,分离困难,因裸小鼠皮肤表面的其他微生物生长速度快,直接从皮肤组织进行细菌分离培养,会出现杂菌阻碍牛棒状杆菌生长,甚至将其覆盖,往往会造成漏检[9],不适用于大规模流行病学调查。分子生物学检测方法具备高效快速、操作简便等优势,近年来应用十分广泛,尤其对于生长缓慢及苛养菌的检测尤为适用。LAMP技术是2000年Notomi等[16]报道的一种快速核酸扩增技术, 该技术利用一种链置换DNA聚合酶(Bst DNA polymerase)和2对特殊引物, 特异性识别靶序列上的6个独立区域, 在等温条件下(65 ℃左右)保温数十分钟即可完成核酸扩增。反应结果可通过反应副产物焦磷酸镁白色沉淀直接进行肉眼观察判定, 无需特殊、昂贵仪器。因具备简单、快速、灵敏、特异、易于推广等优势, 尤其适合于现场使用, 已广泛应用于病原体的快速检测和早期诊断。但是, LAMP的灵敏度高,一旦开盖容易形成气溶胶污染,分区不严格则易造成假阳性,在操作过程中应尽量规避。另外,该方法对引物设计要求比较高。
16S rRNA具有高度的保守性和特异性,已成为细菌基因分类理想的靶序列,可实现对细菌的快速、特异、灵敏检测,应用日益广泛。本研究根据牛棒状杆菌16S rRNA基因序列设计一组LAMP扩增特异性引物,对新建LAMP检测体系进行条件优化、特异性和敏感性分析。实验结果显示,LAMP扩增可在恒温条件下短时间内完成检测,特异性好,灵敏度较PCR高。检测结果可直接通过肉眼实现可视化观察,无需开盖进行电泳,操作简便、高效,且避免了核酸污染检测场所。临床检测数据表明,PCR和LAMP两种分子生物学检测方法相比,LAMP方法敏感性较PCR方法高,与敏感度检测结果一致, PCR检测呈阳性的样品均能被LAMP方法检出。分子生物学检测方法具备精准、高效、便捷的优势,可用于病原体的初步筛查,但仍需结合分离培养等病原学检测金标准进行验证。
综上,本研究建立了牛棒状杆菌LAMP快速检测方法,与现有技术相比不受培养条件和检测仪器的限制,具备简便、快捷、特异、灵敏的优势,结果判定简单易行,可用于实验动物、相关动物源性生物制品及实验动物环境中牛棒状杆菌的检测,该方法的建立可为实验动物质量控制提供技术支撑。

