中国仓鼠口腔鳞癌miR-504的表达特征分析
卫佳宁, 续国强, 高继萍, 王晓堂, 肖兰飞, 宋国华
(山西医科大学实验动物中心, 实验动物与人类疾病模型动物模型山西省重点实验室, 太原 030001)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部最常见的恶性肿瘤之一,约占头颈部恶性肿瘤的90%左右[1],其发病率在全球呈逐年上升趋势[2]。每年头颈部恶性肿瘤新发病患者人数高达60万例[3,4],且患病人群趋向于年轻化[5],这对人类健康和生命构成了严重的威胁。
微小RNA(microRNA,miRNA)是具有调控基因表达功能的非编码小分子单链RNA, 在癌症以及其他疾病的发生、发展中发挥着重要作用, 参与了肿瘤细胞的增殖、侵袭和转移等生物学特性的调控过程, 发挥类似癌基因或抑癌基因的作用。关于miRNA在OSCC方面的研究有: miR-29b-1-5p诱导OSCC的上皮间充质转化[6]; miR-125b通过靶向抗氧化因子过氧化物样酶2A(peroxiredoxin-like 2A, PRXL2A)来抑制口腔致癌性[7]; miR-127-3p靶向驱动蛋白(kinesin-like protein,KIF3B)以抑制OSCC的发展[8]; miR-199a-5p通过靶向丝氨酸-苏氨酸激酶/核因子κB (IKKβ/ NF-κB)信号通路在OSCC中起肿瘤抑制剂的作用[9]等相关研究,miR-504是我们课题组前期通过对中国仓鼠OSCC模型高通量测序筛选得到的,目前其在OSCC方面的相关研究知之甚少。
中国仓鼠是我国具有特色的实验动物,其口腔两侧各有一个伸缩性大的颊囊,颊囊组织主要由纤维组织、鳞状上皮细胞及疏松结缔组织构成,血供丰富,微血管网密、颜色淡、透光性好,是进行OSCC研究的理想动物模型[10]。本实验室完成了中国仓鼠口腔颊囊组织miRNA高通量测序和生物信息学分析,鉴定得到差异表达的miRNA共有268个, 137个表达上调, 131个表达下调, 其中miR-504表达下调[11]。本文对miR-504进行了克隆测序, 并对其结构进行预测, 采用qRTPCR方法鉴定miR-504中中国仓鼠OSCC模型的癌组颊囊和癌旁舌组织的不同阶段的表达特征, 为OSCC中miR-504下游相关通路研究奠定基础。
1 材料与方法
1.1 动物模型建立及分组
选取清洁级雄性中国仓鼠90只,8~10周龄,体质量30~40 g(误差不大于10%),山西医科大学实验动物中心生产[SCXK(晋)2015-0001];90只中国仓鼠分为3组: 空白组30只、阴性对照组12只、实验组48只, 空白组不做处理,阴性对照组涂抹丙酮,实验组涂抹丙酮溶解的0.5%二甲基苯丙蒽(9,10-Dimethy1-1, 2-Benzanthracence,DMBA)。仓鼠分笼饲养在屏障动物实验设施中[SCXK(晋)2015-0001],饲养室温度 23~25 ℃,环境相对湿度40%。涂药后禁食禁水2 h,其余时间自由进食和饮水,仔细观察每只鼠的生活状况,对外观产生病变的鼠及时进行标记。
1.2样本采集及病理HE染色
模型建立开始,隔日涂一次DMBA。定期在造模6周、12周和18周解剖13只(8只实验组+5只对照组)仓鼠取样:取仓鼠的左右颊囊和舌组织,将采集的一部分颊囊组织和所有舌组织做好标记立即放入液氮中冷冻,然后于-80℃冰箱中保存,以备提取RNA; 另一部分颊囊组织放入质量分数4%多聚甲醛溶液中固定24~72 h,然后进行乙醇溶液梯度脱水、石蜡包埋、切片、伊红-苏木素(HE)染色、中性树脂封片。
1.3 RNA提取及反转录
采用Trizol试剂(日本TaKaRa公司)提取组织中的RNA, 按照说明书操作。用酶标仪(FLX-8000型, 美国Gene公司)对RNA的浓度和纯度进行定量评估,参照miRNA cDNA第一链合成试剂盒(日本TaKaRa公司)说明书合成cDNA,10 μL反应体系: mRQ Buffer (2×) 5 μL,组织中提取的miRNA(0.25~8 μg) 3.75 μL,mRQ Enzyme 1.25 μL。在PTC-200PCR仪上进行反转录反应程序设置:第一步在单引物的介导和反转录酶的催化下合成RNA的互补链cDNA: 37℃,60 min; 第二步加热后cDNA与RNA链解离: 85℃, 5 min。最终生成miRNA对应的 cDNA 第一链,-20 ℃保存备用。
1.4miR-504前体序列的克隆
中国仓鼠中miR-504的成熟体序列来自miRBase数据库,将成熟体序列比对到OSCC基因组,得到miR-504前体的基因组序列,根据所获得的序列设计特异性miR-504引物(表1),用于扩增miR-504的前体序列,克隆得到了符合预期结果的片段,连接到GV268载体上(GENE,吉凯基因),转化质感受态细胞中,挑取单克隆,经过验证得到阳性克隆的序列,将测序结果在miRBase(http://www.mirbase.org/)上进行BLAST分析,并使用miRNA前体二级结构在线预测软件The mfold Web Server(http://unafold.rna.albany.edu/?q=mfold/RNA-Folding-Form)对miR-504前体进行二级结构预测。
1.5颊囊和舌中miR-504实时定量分析
使用RT-PCR方法检测miR-504在中国仓鼠OSCC四个阶段中的表达特征。RT-PCR 实验正向引物基于 miRNA 成熟体序列设计, 反向引物使用 miRcute miRNA qPCR (TaKaRra公司, 日本)检测试剂盒自带的引物。用U6基因作为内参,引物序列见表1。RT-PCR按照TaKaRa试剂盒说明书进行操作,25 μL 反应体系: 正向引物 0.5 μL,反向引物0.5 μL,ROX Dye (50×) 0.5 μL,miRNA第一链cDNA 2.0 μL,SYBR Advantage Premix (2×) 12.5 μL,ddH2O 9 μL。在Real time PCR 仪(美国ABI 公司)上进行RT-PCR反应程序设定,反应条件,步骤 1∶95℃ 5 min;步骤2∶95 ℃ 30 s, 60 ℃ 30 s,40 个循环,实验重复3次, 每组设置3个重复, Ct值取3个重复的平均值, 结果以 2-ΔΔct相对表达量表示[12]。2-ΔΔCt计算方法: ΔΔCt=[(样本Ct目的基因-样本Ct内参基因)-(对照组Ct目的基因-对照组 Ct内参基因)]。
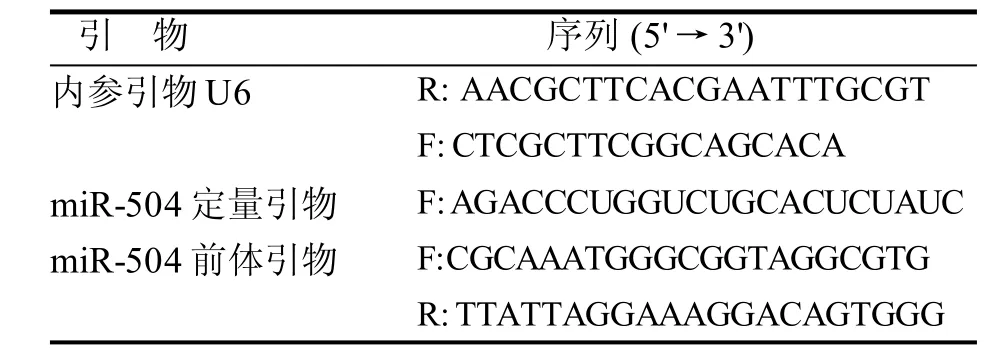
表 1 荧光实时定量PCR引物序列
1.6miR-504的qRT-PCR数据统计分析
采用SPSS 17.0统计软件对qRT-PCR检测结果的数据进行分析, 对PCR结果的数据采用±s表示,结果采用t检验,多组样本均数间的两两比较采用单因素方差分析法(ANOVA)中的LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 中国仓鼠颊囊组织病理学观察
光学显微镜下,正常颊囊组织棘细胞层薄,基底层细胞明显、排列整齐, 钉突不明显,空白组和阴性对照组组织学观察一致, 未出现异常改变(图1A和B); 模型组在6周时颊囊黏膜出现轻度充血,病理观察可见棘层细胞增厚, 基底层细胞形态正常,相对于正常组略微增厚, 极少数钉突形成(图1C); 12周时黏膜增厚, 病理观察见棘层细胞明显增厚,基底层细胞增生且呈明显改变,钉突较6周明显增宽(图1D); 18周时局部有白斑样病变和糜烂,病理观察见棘层细胞呈单个或成团角化,基底层细胞增厚,大部分的基底层细胞异常增生,大量细胞极性消失,散乱排列(图1E)。
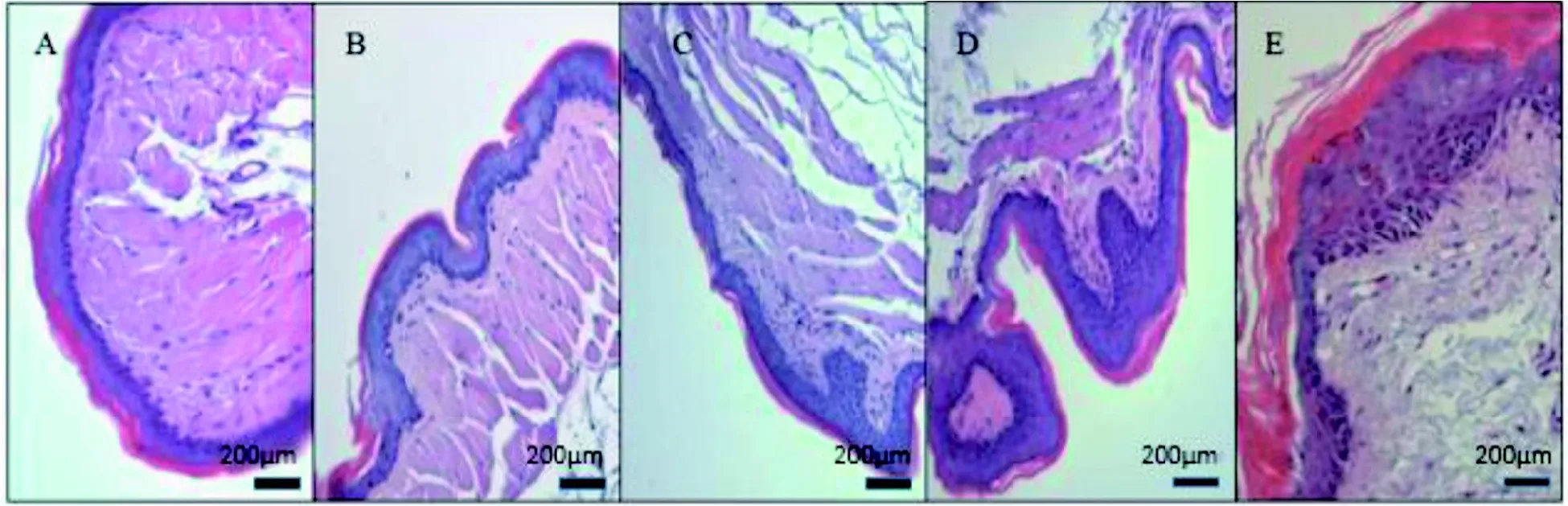
图 1 中国仓鼠颊囊黏膜癌变的组织病理学观察 (HE×200)Figure 1 Histopathological observation of mucosal carcinogenesis in Chinese hamsters (HE×200)
2.2miR-504前体序列的克隆及测序验证
测序结果去除载体后显示片段大小为325 bp,将该序列在miRBase(http://www.mirbase.org/)数据库进行BLAST分析,结果显示该序列与野猪、猕猴、黑猩猩、犬、牛、人、小鼠等的miR-504具有同源性。测序比对结果如下(红色为miR-504前体序列):


2.3 miR-504前体二级结构预测
通过 The mfold Web Server 分析, 颊囊 miR-504前体序列的二级结构有6个,其中由最小折叠自由能(Δ G =-76.40 kcal/mol)形成的二级结构最稳定 (图 2),可以看出口腔颊囊miR-504 前体序列二级结构具有典型的颈环结构特征。经二级结构分析和 miRBase 前体序列同源性分析,在前体序列中发现了miR-504的成熟体序列,确认克隆得到的序列为miR-504 前体序列。
2.4miR-504在OSCC颊囊组织四个阶段表达量
采用qRT-PCR方法检测颊囊样本中miR-504的表达量,miR-504和内参U6特异性扩增,熔解曲线均为单一峰,特异性较好。采用2-ΔΔct法计算相对表达量,每周组织的个体数为3只,每个至少重复3次,可以准确反映miRNA的表达情况。经过统计学分析,miR-504在颊囊组织中的表达特征如下:在6周、12周和18周时,实验组的表达量约是空白组的0.83、0.33,0.23倍; 12周时的表达量显著低于前一个时间段(P<0.001),其余两组两两比较差异有显著性(P<0.05); 相对于空白组,实验组miR-504的表达水平均较低(图3左)。
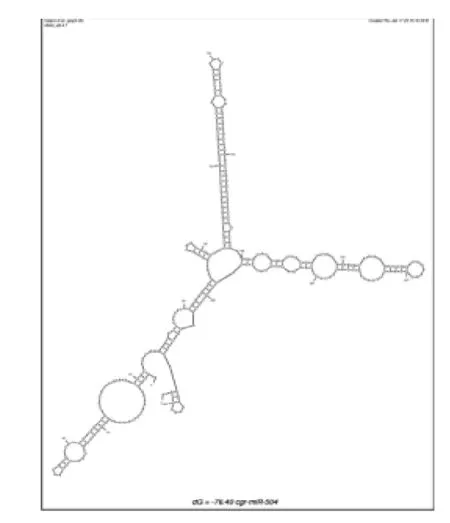
图 2 miR-504 前体序列形成的颈环结构Figure 2 Hairpin structures formed by precursor sequences of miR-504
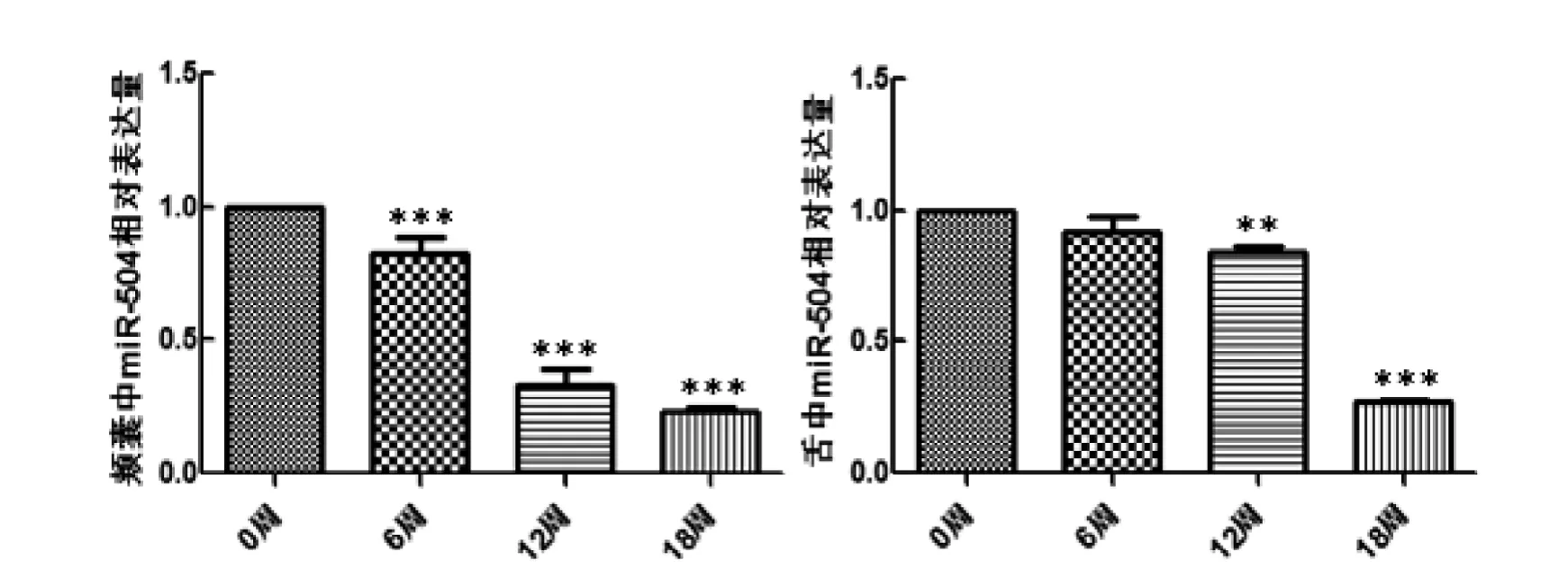
图 3 中国仓鼠OSCC的miR-504相对表达量Figure 3 Relative expression of miR-504 in OSCC of Chinese hamster
经过统计学分析, miR-504在舌组织中的表达特征如下:在6周、12周和18周时,miR-504在舌组织的相对表达量约是正常舌组织的0.92、0.84、0.27倍, 12周和18周miR-504的相对表达量差异性极显著(P<0.01),相应的miR-504的表达水平不断降低(图3右)。
2.5中国仓鼠OSCC模型中癌组织颊囊和癌旁组织舌中miR-504表达差异比较
结果显示, 相对于正常组织, 在6周、12周、18周的实验组颊囊和癌旁舌组织中miR-504的表达水平在不断下调,且差异有显著性(图4)。
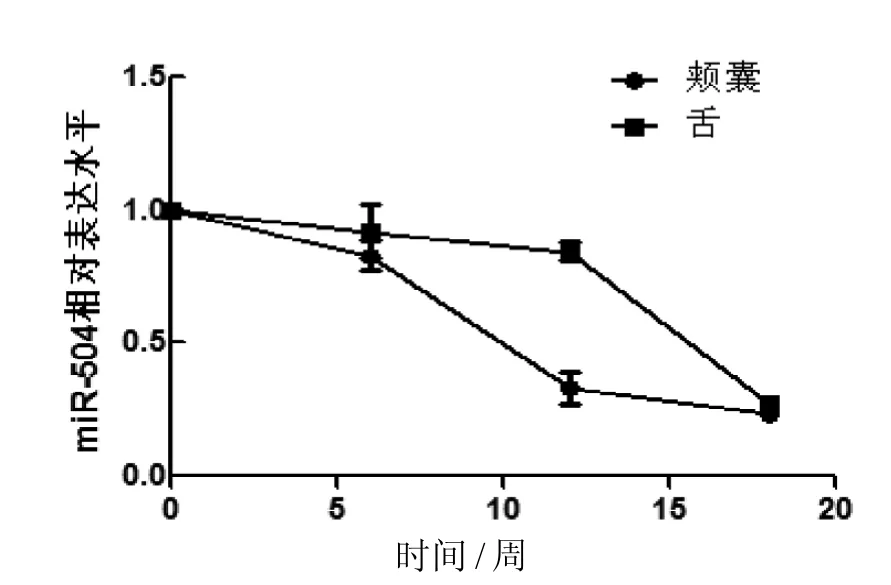
图 4 中国仓鼠OSCC的miR-504表达水平Figure 4 Expression of miR-504 in OSCC of Chinese hamster
3 讨论
近年来,除了基于临床的对OSCC相关病因、诊断标准和预后的回顾性研究,研究人员越来越重视OSCC动物模型的建立,旨在进行OSCC发病机制与抗癌药物药理学的研究。目前关于OSCC动物模型方面有注射法建立金黄仓鼠颊囊癌模型[13],质量分数0.002%的4-硝基喹林-1-氧化物(4-NQO)饮水法诱导Wistar大鼠舌白斑癌变动物模型[14]等。每种方法有各自的特点,相对于饮水法,涂抹法能有效避免OSCC癌变以外的并发症。本研究使用的中国仓鼠源于我国,具有中国特色的实验动物,利用其两侧大颊囊的特点制备OSCC动物模型具有显著优势。
前期的研究采用二代高通量测序技术筛选出与OSCC通路相关的差异表达的基因miR-504[11],本文研究了miR-504在中国仓鼠颊囊和舌组织中的表达特征。首先克隆得到中国仓鼠miR-504前体,经The mfold Web Server对前体进行二级结构预测,miR-504能形成经典的颈环结构。初级miR-504经过2个步骤的剪切最终形成成熟的miR-504。第一步在细胞核中,初级miR-504由RNase Ⅲ内切酶家族的Drosha酶剪切成颈环结构的miR-504前体; 第二步在细胞质中,由RNase Ⅲ内切酶家族的Dicer酶剪切成RNA双链复合体,该复合体在Dicer酶作用下解旋, 其中一条或者两条与AGO蛋白形成RNA的沉默复合体(RNA-induced silencing complex,RISC)。包含RNA的RISC通过成熟miRNA识别沉默靶标,并与靶标基因的mRNA的3’非编码区域进行互补配对,引导RISC与靶标基因结合或将靶标基因降解,从而达到调控靶标基因表达的目的[15]。与人类基因组的其他区域或基因座相比,miRNA基因的单核苷酸多态性(single nucleotide polymorphism, SNP)较低[16,17]。此外, Han等[18]通过NCBI和UCSC数据库挖掘数据和分析指出miRNA的保守性, 概因二级结构及其功能的重要性影响了miRNA基因中SNP的积累。
目前, 关于miR-504在其他疾病及相关信号通路中的研究有不少。如miR-504通过抑制Frizzled-7介导的Wnt /β-连环蛋白信号传导而在肝细胞癌中起肿瘤抑制剂的作用[21]; miR-504通过在非小细胞肺癌中靶向赖氨酰氧化酶样蛋白2(LOXL2)来抑制细胞增殖和侵袭[22]; miR-504通过靶向肿瘤蛋白p53诱导的核蛋白1(TP53INP1)促进人骨肉瘤中的肿瘤生长和转移[23]; miR-504还是一种肿瘤抑制性microRNA,通过靶向人脑胶质瘤中的FOXP1来抑制细胞增殖并促进细胞凋亡[19]; 结缔组织生长因子(CTGF)通过激活miR-504 / FOXP1信号传导来调节OSCC的侵袭性[24]。这些研究为探讨miR-504在OSCC发生发展中分子机制提供了借鉴。
本实验显示, DMBA涂抹过的颊囊中miR-504的表达下调, 而癌旁舌组织中miR-504的表达先降低后升高。有文献[19]报道, miR-504在FOXPI(FOX家族基因)的相关通路中高表达并发挥促癌作用;在周期蛋白依赖性激酶6(cyclin-dependent kinases 6, CDK6)的相关通路中低表达并发挥抑癌作用[20]。癌组颊囊和癌旁组舌中miR-504的表达出现的差异,可能与相关信号通路上的调控机制相关。
综上所述,DMBA涂抹法建立的中国仓鼠OSCC动物模型为研究OSCC的发病机理提供了可靠的材料,显著下调的miR-504与OSCC的发生机制有关,可能是OSCC诊断的潜在标志物。因此,从miR-504对OSCC的致病机制及相关信号通路的研究具有重要意义,可为临床OSCC的早发现早治疗提供依据。

