鹿科不同物种血液的分子鉴定
周辰杰,党 平,周翠霞,张晓晨
(1.苏州红冠庄国药股份有限公司,江苏 昆山 215343;2.上海中医药大学中药学院,上海 201203)
鹿血为鹿科动物的血液,鹿种的基源产自我国东北地区,据《本草纲目》记载:“鹿血主阳痿、补虚、止腰痛、鼻衄、跌伤、狂犬伤,和酒服治肺痿吐血,及崩中带下,诸气痛欲危者饮之立愈。大补虚损,益精血,解痘毒、药毒”。鹿血来源于《中国药典》鹿茸基源梅花鹿Cervus nipponTemminck 或马鹿Cervus elaphusLinnacus 的新鲜血液,作为珍贵的中药材在药用或功能性食品方面被广泛认可,如鹿血酒、鹿血晶等制品。鹿血饮片含有多种活性成分,并且在人类血液系统疾病和恶性肿瘤的治疗中取得良好效果[1-4],其中也包含临床研究报道[5-6]。因鹿血产品较昂贵,也成为了不法分子造假或者以次充好的对象,近年来有了一些对鹿血真伪和品质检测的文献报道,但结果仍存在一定偏差[7]。为了确保鹿血的真实度和纯度,从源头上控制鹿血的品质,课题组在相关鹿血鉴别文献[8-9]的基础上采用聚合酶链式反应技术(PCR)成功鉴别了包括基源药材梅花鹿血在内的10 种常见物种(鹿、猪、马、驴、牛、羊、兔、鸡、鸭、鹅)血液样本线粒体DNA 序列上的差异,并且方法简便快速[10-11],以期为制定鹿血饮片的炮制规范提供依据。
聚合酶链式反应是一种用于放大扩增特定DNA 片段的分子生物学技术,是生物体外的特殊DNA 复制,其最大优势便是将微量样品中的DNA 片段大幅增加,从而达到放大核酸信号的目的。PCR 具有极高的反应灵敏性和特异性,能够区分少至几个核苷酸碱基的差异,无论是化石中的古生物、或是几十年前凶杀案遗留的残骸,只要分离出微量的DNA,就能以PCR 技术放大,进行比对。由于进化过程中不同物种的遗传物质DNA 存在序列上的保守和多变性,因此物种之间存在一定的差别,其中线粒体DNA 相对基因组DNA 具有更高的突变率和遗传多变性,因此线粒体DNA序列上的差别及其特异性便更多地运用于不同物种、相近物种及物种内部的进化分析和诊断检验[12-14]。
本课题组采用PCR 技术不但鉴定了鹿血和其他常见家畜家禽血液线粒体DNA 序列的不同,同时也以此技术鉴别了4 个鹿科物种(东北梅花鹿、东北马鹿、塔河马鹿、坡鹿、白唇鹿,其中东北马鹿、塔河马鹿为马鹿的2 个亚种,共5 种鹿科动物血液)在该序列上的差异,也为来源于不同鹿科物种的血液鉴别提供了依据。
1 材料与方法
1.1 鹿血晶制备 取鹿科动物梅花鹿Cervus nipponTemminck 或马鹿Cervus elaphusLinnacus 的新鲜血液,匀浆,过滤,滤液喷雾,冻结,依法循环操作,使冻结物至一定厚度,冷冻干燥,干燥品表面呈紫红色或紫黑色、具晶体光泽、大小不一的碎片。样本由苏州红冠庄国药股份有限公司提供。
1.2 动物样本 东北梅花鹿(Cervus nipponTemminck)、东北马鹿(Cervus elaphusXanthopygus)样本为鲜血,血液样本中均添加抗凝剂,于-20 ℃保存;塔河马鹿(Cervus elaphusYarkandensis)、坡鹿(Cervus eldii)样本为血干粉,白唇鹿(Cervus albirostris)样本为毛发(此样本来源见讨论部分);鹿血晶DNA 模板取样于鹿血晶中药饮片;所有动物血液样本均采自苏州红冠庄国药股份有限公司长春分公司,国家重点保护野生动物驯养繁殖许可证号林护驯繁(吉)2014-55。
1.3 引物 供本实验鉴定用的引物体系以对比各物种线粒体DNA(mtDNA)上的D-loop 区序列进行设计,由上海生工生物工程股份有限公司合成。序列见表1。
1.4 试剂 DNA 抽提试剂盒(德国Qiagen 公司);预混Taq 酶(天津市莱博科技有限公司);琼脂糖(德国Sigma公司);磷酸缓冲液;溴化乙锭;50 bp DNA 分子标记[天根生化科技(北京)有限公司];电泳缓冲液。

表1 鉴定用引物体系的特异性引物序列
1.5 仪器 Sigma 1-14 台式离心机(德国Sigma 公司);Bio-Rad T-100PCR 仪(美国Bio-Rad 公司);HE-120 水平电泳仪、UV-2000 凝胶紫外分析割胶仪(上海天能科技有限公司)。
1.6 试剂制备 溴化乙锭贮备液10 mg/mL;磷酸缓冲液(NaCl 8 g、KCl 0.2 g、Na2HPO41.42 g、KH2PO40.27 g,加水至1 L,调pH 7.4);电泳缓冲液(Tris 121 g、EDTA 11.5 g、冰醋酸28.55 mL,加水至500 mL)。
1.7 鹿鲜血样本DNA 模板提取[8,13-14]按文献[5]的鲜血样本提取方法,使用“DNeasy® Blood & Tissue Kit”试剂盒,或“TIANamp Genomic DNA Kit”试剂盒,以柱亲和层析法提取DNA。取动物血液样本200 μL,置于1.5 mL离心管中,依次加入蛋白酶K、AL 裂解缓冲液,分别吹打混匀;56 ℃水浴保温10 min;加入无水乙醇,吹打混匀,进样至DNA 纯化柱中,8 000 r/min 离心1 min;弃过滤液,分别加入AW1、AW2 漂洗液,8 000、14 000 r/min 离心1、3 min;弃去过滤液,再离心1 min,将DNA 纯化柱移入新1.5 mL 离心管中,加入洗脱缓冲液,室温放置1 min 后,8 000 r/min离心1 min,取洗脱下的DNA 溶液,作为供试品溶液,置-20 ℃保存备用。
1.8 鹿血晶样本DNA 模板提取[10,15]使用DNeasy®Blood & Tissue Kit 或TIANamp Genomic DNA Kit 试剂盒,以柱亲和层析法提取DNA。取鹿血晶20 mg,置1.5 mL 离心管中,加入磷酸盐缓冲液振荡溶解,加入蛋白酶K、AL 裂解缓冲液吹打混匀,56 ℃水浴保温10 min,之后按“1.7”项下方法提取。
1.9 鹿毛发样本DNA 模板提取 使用DNeasy® Blood &Tissue Kit 试剂盒,以柱亲和层析法提取DNA。取鹿毛发20 mg,剪碎,置1.5 mL 离心管中,用75%乙醇清洗2 次,再用双蒸水清洗3 次,加入ATL 缓冲液、蛋白酶K 吹打混匀,于56 ℃ 水浴消化过夜,之后按“1.7”项下方法提取。
1.10 PCR 反应体系和反应条件 在200 μL 薄壁管中进行PCR 反应,反应体系的总体积为10 μL,包括预混Taq 酶5 μL、鉴别引物正反向各1 μL、DNA 模板1 μL、双蒸水2 μL。将离心管置PCR 仪,PCR 反应参数为94 ℃预变性5 min,循环反应35 次(94 ℃,45 s;56 ℃,45 s;72 ℃,45 s),延伸(72 ℃)10 min。
1.11 电泳检测 采用琼脂糖凝胶电泳法检测PCR 产物,琼脂糖凝胶浓度为1.5%,凝胶中加入核酸染色剂溴化乙锭;PCR 反应液的上样量为8 μL,DNA 分子量标记上样量为5 μL(0.08 μg/μL)。在120 V 下电泳约30 min。完成电泳后,在紫外透射仪或凝胶成像仪上对凝胶片进行检测。
1.12 PCR 检测 将5 种鹿科物种的DNA 模板按相同比例混合,即各组分的占比为20%,作为PCR 反应的模板。在200 μL 薄壁管中进行PCR 反应,反应体系的总体积为10 μL,包括预混Taq 酶5 μL、鉴别引物正反向各1 μL、混合模板1 μL、双蒸水2 μL。将离心管置于PCR 检测仪,PCR 反应参数为94 ℃预变性5 min,循环反应40 次(94 ℃,45 s;56 ℃,45 s;72 ℃,45 s),延伸(72 ℃)10 min。
1.13 测序与BLAST
制备测序样品的PCR 反应总体积为20 μL,反应体系包括Taq 酶10 μL、鉴别引物正反向各2 μL、DNA 模板2 μL、无菌双蒸水4 μL。将离心管置PCR 仪上,反应参数为94 ℃预变性5 min,循环反应40 次(94 ℃,45 s;56 ℃,45 s;72 ℃,45 s),延伸(72 ℃)10 min。
PCR 反应结束后,从每一管预测序样品中吸取5 μL 电泳检测,没有问题便提交测序公司测序。同时,需提交测序样品所使用的正反向引物各10 μL,浓度5 μmol/L。
将正反向测序结果拼接,作为最终测序结果,使用BLAST 工具对测序结果进行数据库比对。
2 结果
2.1 PCR 结果 见图1~2。
2.2 方法学考察
2.2.1 重复性考察 将同批次的供试品以相同的PCR 反应体系及反应条件重复进行6 次上述PCR 实验。结果见图3~8。
东北梅花鹿的特异性引物仅对东北梅花鹿DNA 模板特异性扩增出247 bp 大小的条带,而其他物种DNA 模板无扩增,6 次实验结果一致。
东北马鹿的特异性引物仅对东北马鹿DNA 模板特异性扩增出164 bp 大小的条带,而其他物种DNA 模板无扩增,6 次实验结果一致。

图1 各样品DNA 模板特异性扩增条带

图2 5 种鹿的特异性引物PCR 扩增DNA 条带
塔河马鹿的特异性引物仅对塔河马鹿DNA 模板特异性扩增出299 bp 大小的条带,而其他物种DNA 模板无扩增,6 次实验结果一致。
坡鹿的特异性引物仅对坡鹿DNA 模板特异扩增出401 bp大小的条带,而其他物种DNA 模板无扩增,6 次实验结果一致。
白唇鹿的特异性引物仅对白唇鹿DNA 模板特异性扩增出534 bp 大小的条带,而其他物种DNA 模板无扩增,6 次实验结果一致。
各种鹿科物种的特异性引物都能从混合模板中扩增出相对应的鹿科物种特异性大小条带,6 次实验结果一致。
综上所述,东北梅花鹿、东北马鹿、塔河马鹿、坡鹿、白唇鹿鉴定用引物体系都表现了很好的一致性,所有阳性、阴性结果都能够重复。
2.2.2 重复性试验 通过3 家实验室以相同的方法、条件进行试验,来考察东北梅花鹿、东北马鹿、塔河马鹿、坡鹿、白唇鹿鉴定用引物体系的重复性。
2.2.3 中间精密度试验 同一实验室的不同人员,在不同时间进行试验,对东北梅花鹿、东北马鹿、塔河马鹿、坡鹿、白唇鹿鉴定用引物体系进行中间精密度考察,上述重复性试验便是由不同的人员在不同的时间内完成。结果显示,均能再现一致的试验结果,验证了梅花鹿、东北马鹿、塔河马鹿、坡鹿、白唇鹿鉴定用引物体系的中间精密度。
3 讨论
由于前期的鹿和其他9 种家畜家禽鉴定用引物体系中的鹿引物无法对于不同鹿种进行鉴别[7],于是课题组建立了这套针对不同鹿种的引物体系,用来鉴别正品鹿血、正品鹿血药材和饮片的具体来源。
图2 显示,使用东北梅花鹿、东北马鹿、塔河马鹿、坡鹿、白唇鹿鉴定用引物体系来对鹿血晶DNA 模板扩增,其中东北梅花鹿、东北马鹿、塔河马鹿的引物都能够从鹿血晶DNA 模板中扩增出条带,而坡鹿和白唇鹿的引物无此条带,表明鹿血晶的原料来源为梅花鹿和马鹿的血液,其中并不含坡鹿和白唇鹿这两种国家保护动物的血液。
白唇鹿属于我国一级保护动物,仅分布于青藏高原,样本采集困难,课题组从位于四川西部的新路海白唇鹿自然保护区中采集到了毛发样本,从中提取DNA 来进行研究。
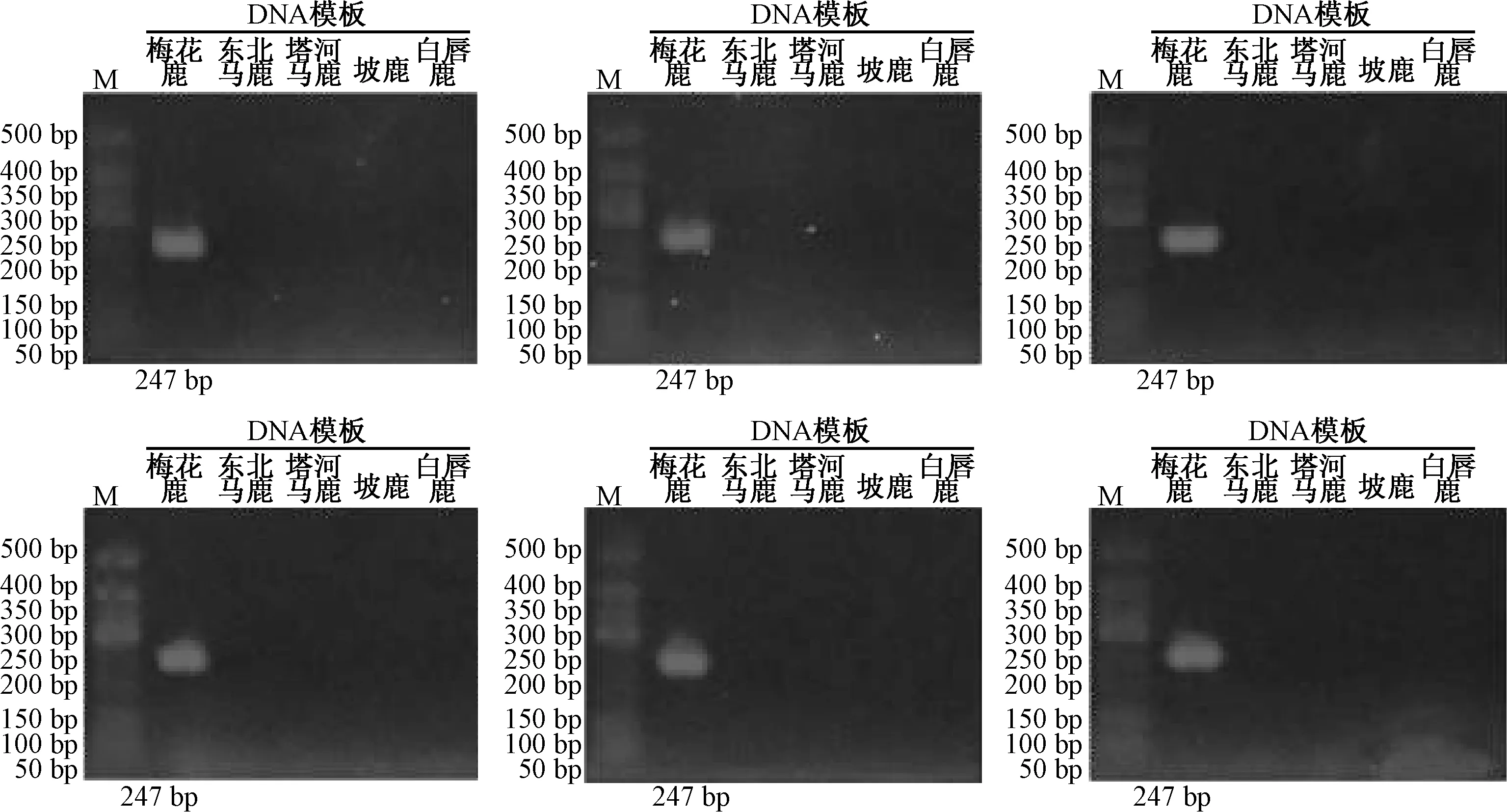
图3 东北梅花鹿特异性引物PCR 扩增DNA 条带

图4 东北马鹿特异性引物PCR 扩增DNA 条带

图5 塔河马鹿特异性引物PCR 扩增DNA 条带

图6 坡鹿特异性引物PCR 扩增DNA 条带
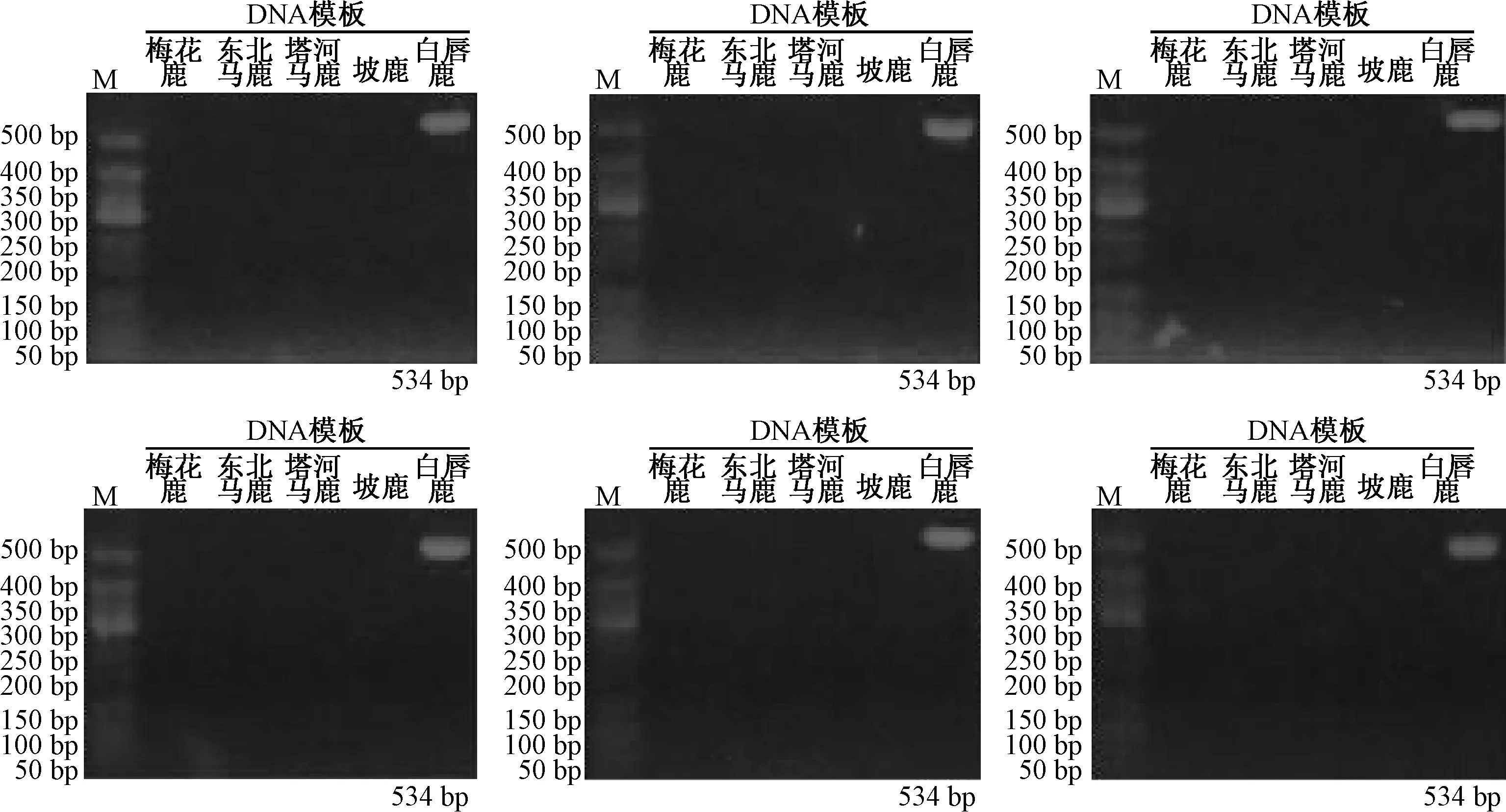
图7 白唇鹿特异性引物PCR 扩增DNA 条带

图8 5 种鹿科物种特异性引物PCR 扩增DNA 条带
由于该物种数量不多,因此在GenBank 数据库中的序列数据相比其他鹿种要少很多。在设计引物时课题组发现,即使在GenBank 有限的白唇鹿序列中,也出现了2 套不一样的数据,其中之一为四川大学所提交的HM049636.1 等,另一套为法国和吉林的研究者提交的JN632690.1 与GQ304765.1 等,这2 套不同的序列经过对比表现出了很大的不一致性,其区别已经和其他同属不同种的鹿物种之间的序列差别相当。课题组无法设计一套引物来涵盖这2 种白唇鹿并将其与其他鹿种区分开来,于是根据这2 套数据分别设计了引物。
通过PCR 实验以及测序验证,课题组从新路海所采集的白唇鹿标本能够匹配上述后一套数据,既法国和吉林的研究者所提交的数据;自然PCR 产物的测序结果与四川大学所提交的序列有较大不同,因此根据这套序列所设计的引物是无法从所采集的白唇鹿标本中扩增出条带的。课题组所提交的引物体系中的白唇鹿引物是经过验证,能够从所采集到的白唇鹿样本中扩增出条带的引物。
从目前所掌握的情况看,白唇鹿物种应该没有分亚种,因此其个体间的序列差别不应该像上述2 套序列数据之间的差别那么显著。至于为什么会出现这种情况,并不在课题组这系列实验的研究范围内,课题组也没有资源在短时间内完全解决这个疑问。
本研究建立了针对不同鹿科物种的鉴定引物体系,能够鉴别东北梅花鹿、东北马鹿、塔河马鹿、坡鹿、白唇鹿,通过PCR 实验、测序、方法学验证,证明了该体系的有效性和可靠性。

